Nauka >Chemia >Pierwiastki trzeciego rzędu >Charakter metaliczny pierwiastków trzeciego rzędu
W tym artykule będziemy badać trend im charakter metaliczny pierwiastków trzeciego rzędu.
Charakter metaliczny:
Tendencja atomu do utraty elektronów w celu utworzenia dodatnio naładowanego jonu jest nazywana jego charakterem metalicznym lub charakterem elektropozytywnym. Zazwyczaj metale wykazują połysk i są dobrymi przewodnikami ciepła i elektryczności.
Charakter niemetaliczny:
Tendencja atomu do zyskiwania elektronów w celu utworzenia ujemnie naładowanego jonu nazywana jest jego niemetalicznym charakterem lub charakterem elektronegatywnym.
Faktory wpływające na charakter metaliczny i niemetaliczny:
- Rozmiar atomu
- Intalpia jonizacji
- Ładunek jądrowy
Trendy w charakterach metalicznych i niemetalicznych:
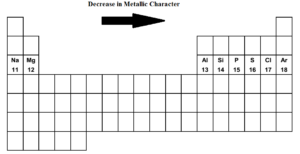
Jak poruszamy się po układzie okresowym od lewej do prawej strony i.tj. od sodu do argonu w trzecim okresie charakter metaliczny maleje, a niemetaliczny rośnie. Sód, magnez, aluminium są typowymi metalami. Krzem jest metaloidem. (słabo nie metaliczny). Fosfor, Siarka, Chlor są niemetalami. Argon jest gazem obojętnym.
Sód jest najbardziej metalicznym pierwiastkiem, natomiast chlor jest najbardziej niemetalicznym pierwiastkiem. Oba skrajne pierwiastki sód i chlor są niezwykle reaktywne. Argon nie jest ani elektropozytywny ani elektronegatywny.
Przyczyny naukowe:
Jak poruszamy się po układzie okresowym od lewej do prawej tj. od sodu do argonu w trzecim okresie metaliczny charakter maleje i niemetaliczny charakter wzrasta.
Jak poruszamy się od lewej do prawej w trzecim okresie liczba atomowa wzrasta. Tak więc, jak poruszać się od sodu do argonu ładunek jądrowy wzrasta i od lewej do prawej dodatkowy elektron jest dodawany do tego samego, tj. trzeci orbital. Ze względu na wzrost ładunku jądrowego siła przyciągania na elektrony w skrajnej orbicie wzrasta i tym samym rozmiar atomu maleje.
As we move from left to right in the third period the ionization enthalpy increases. Od lewej do prawej w trzecim okresie rośnie elektronegatywność, tzn. maleje tendencja do tracenia elektronów, a rośnie tendencja do zyskiwania elektronów. W miarę przesuwania się od lewej do prawej strony w trzecim okresie liczba walencyjna wzrasta. Stąd, gdy poruszamy się po układzie okresowym od lewej do prawej strony tj. od sodu do argonu w trzecim okresie charakter metaliczny maleje, a niemetaliczny wzrasta.
Sód, magnez, aluminium są typowymi metalami.
Charakter metaliczny i niemetaliczny pierwiastków zależy od ich wielkości atomowej, ładunku jądrowego i potencjału jonizacji. Sód, magnez, glin mają liczby atomowe odpowiednio 11, 12, 13. Zawierają one 1, 2, 3 elektrony walencyjne w swojej najbardziej zewnętrznej powłoce.
W porównaniu z innymi pierwiastkami z trzeciego rzędu ich rozmiary atomowe są większe. Podobnie, ładunki jądrowe są również mniejsze. Z tego powodu siła przyciągania na elektrony walencyjne jest mniejsza. W porównaniu z innymi pierwiastkami w trzecim rzędzie ich entalpie jonizacji są niższe. Stąd tendencja tych pierwiastków do utraty elektronów walencyjnych. Stąd sód, magnez, glin są typowymi metalami.
Fosfor, siarka, chlor są niemetalami.
Metaliczność i niemetaliczność pierwiastków zależy od ich wielkości atomowej, ładunku jądrowego i potencjału jonizacji. Fosfor, siarka, chlor mają liczby atomowe odpowiednio 15, 16, 17. Zawierają one 5, 6, 7 elektronów walencyjnych w swojej najbardziej zewnętrznej powłoce.
W porównaniu z innymi pierwiastkami w trzecim rzędzie ich rozmiary atomowe są mniejsze. Podobnie, ładunki jądrowe są również większe. W związku z tym siła przyciągania na elektrony walencyjne jest większa. W porównaniu z innymi pierwiastkami w trzecim rzędzie ich entalpie jonizacji są wyższe. Tak więc tendencja tych elementów nie jest do utraty ich elektronów walencyjnych, ale do zyskania elektronów. Stąd fosfor, siarka, chlor są niemetalami.
Argon nie jest ani pierwiastkiem elektrododatnim ani elektronoegatywnym.
Metaliczne i niemetaliczne charaktery pierwiastków zależą od ich wielkości atomowej, ładunku jądrowego i potencjału jonizacji. Argon ma liczbę atomową 18. Zawiera 8 elektronów walencyjnych w swojej najbardziej zewnętrznej powłoce. Argon ma kompletny oktet i całkowicie wypełnione orbitale s i p, dzięki czemu ma najbardziej stabilną konfigurację elektronową wśród pierwiastków trzeciego rzędu, której nie zaburzy przez przyjęcie lub utratę elektronu.
W porównaniu z innymi pierwiastkami trzeciego rzędu jego rozmiary atomowe są większe, ale efekt wypełnionych orbitali s i p jest dominujący. W porównaniu z innymi pierwiastkami w trzecim rzędzie jego entalpia jonizacji jest najwyższa. W związku z tym tendencja Argonu do tracenia lub zyskiwania elektronów walencyjnych jest prawie nieobecna. Stąd Argon nie jest ani pierwiastkiem elektrododatnim ani elektronoegatywnym.
Sód jest najbardziej metalicznym pierwiastkiem.
Metaliczne i niemetaliczne charaktery pierwiastków zależą od ich wielkości atomowej, ładunku jądrowego i potencjału jonizacji. Sód ma liczbę atomową 11. Zawiera 1 elektron walencyjny w jego najbardziej zewnętrznej powłoki.
W porównaniu z innymi pierwiastkami w trzecim rzędzie jego rozmiar atomowy jest większy. Podobnie, ładunek jądrowy jest również mniejszy. W związku z tym siła przyciągania na elektron walencyjny jest mniejsza. W porównaniu z innymi pierwiastkami w trzecim rzędzie jego entalpia jonizacji jest najniższa. Tak więc tendencja Sodu jest do utraty elektronu walencyjnego. Stąd Sód jest najbardziej metaliczny element.
Chlor jest najbardziej niemetaliczny element.
Metaliczny i niemetaliczny charakter pierwiastków zależy od ich wielkości atomowej, ładunku jądrowego i potencjału jonizacji. Chlor ma liczbę atomową 17. Zawiera on 7 elektronów walencyjnych w swojej najbardziej zewnętrznej powłoce.
W porównaniu z innymi pierwiastkami w trzecim rzędzie jego rozmiar atomowy jest najmniejszy. Podobnie, ładunek jądrowy jest również więcej. W związku z tym siła przyciągania na elektrony walencyjne jest więcej. W porównaniu z innymi pierwiastkami w trzecim rzędzie jego entalpia jonizacji jest najwyższa. Tak więc tendencja Chlor nie jest stracić swoje elektrony walencyjne, ale aby uzyskać elektrony. Stąd Chlor jest najbardziej niemetaliczny element.
Nauka > Chemia > Pierwiastki trzeciego rzędu > Metaliczny charakter pierwiastków trzeciego rzędu
.