Stabilita karbokationtových meziproduktů
Víme, že rychlost limitujícím krokem SN1 reakce je první krok – vznik tohoto karbokationtového meziproduktu. Rychlost tohoto kroku – a tedy i rychlost celé substituční reakce – závisí na aktivační energii procesu, při kterém se přeruší vazba mezi uhlíkem a odcházející skupinou a vznikne karbokacion. Podle Hammondova postulátu (oddíl 6.2B) platí, že čím stabilnější je karbokacionový meziprodukt, tím rychleji proběhne tento první krok přerušení vazby. Jinými slovy, pravděpodobnost, že nukleofilní substituční reakce proběhne disociačním mechanismem (SN1), závisí do značné míry na stabilitě vznikajícího karbokačního meziproduktu.
Kritickou otázkou nyní je, co stabilizuje karbocation?
Jestliže je tedy ke stabilizaci záporného náboje zapotřebí skupiny odebírající elektrony, co stabilizuje kladný náboj? Skupina darující elektrony!
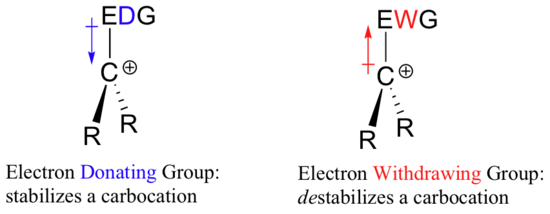
Kladně nabitý druh, jako je karbokation, je velmi elektronově chudý, a proto vše, co daruje elektronovou hustotu do centra elektronové chudoby, jej pomůže stabilizovat. Naopak karbokacion bude destabilizován skupinou odebírající elektrony.
Alkylové skupiny – methyl, ethyl a podobně – jsou slabé skupiny odebírající elektrony, a proto stabilizují blízké karbokacion. To znamená, že obecně platí, že více substituované karbokationty jsou stabilnější: například terc-butylkarbocation je stabilnější než isopropylkarbocation. Primární karbokationty jsou velmi nestabilní a nejsou často pozorovány jako meziprodukty reakcí; methylové karbokationty jsou ještě méně stabilní.
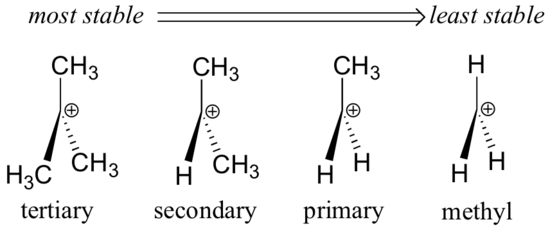
Alkylové skupiny jsou elektronově donující a stabilizují karbokationty, protože elektrony kolem sousedních uhlíků jsou přitahovány k blízkému kladnému náboji, čímž se mírně snižuje elektronová chudost kladně nabitého uhlíku.
Není však přesné tvrdit, že karbokationty s vyšší substitucí jsou vždy stabilnější než karbokationty s nižší substitucí. Stejně jako elektron-donující skupiny mohou stabilizovat karbokaci, elektron-odtahující skupiny působí na destabilizaci karbokací. Karbonylové skupiny odčerpávají elektrony indukčními účinky v důsledku polarity dvojné vazby C=O. V laboratoři je možné prokázat (viz oddíl 16.1D), že níže uvedený karbocation A je stabilnější než karbocation B, přestože A je primární karbocation a B je sekundární.
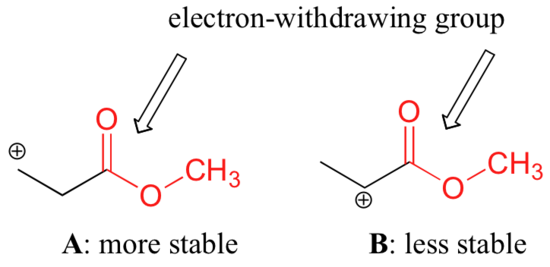
Rozdíl ve stabilitě lze vysvětlit úvahou o indukčním účinku esterového karbonylu, který stahuje elektrony. Připomeňme si, že indukční účinky – ať už odebírající nebo darující elektrony – se přenášejí prostřednictvím kovalentních vazeb a že síla účinku rychle klesá s rostoucím počtem mezilehlých vazeb. Jinými slovy, účinek klesá se vzdáleností. U druhu B je kladný náboj blíže ke karbonylové skupině, a proto je destabilizující účinek odebírání elektronů silnější než u druhu A.
V příští kapitole uvidíme, jak lze karbokacion-destabilizující účinek substituentů fluoru odebírajících elektrony využít v experimentech určených k řešení otázky, zda je biochemická nukleofilní substituční reakce SN1 nebo SN2.
Stabilizace karbokationu může probíhat také prostřednictvím rezonančních efektů, a jak jsme již uvedli v kapitole o kyselinách a zásadách, rezonanční efekty jsou zpravidla silnější než indukční efekty. Uvažujme jednoduchý případ benzylového karbokationu:
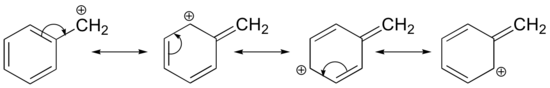
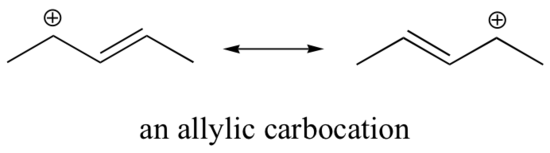
Tento karbokation je poměrně stabilní. V tomto případě je darování elektronů rezonančním účinkem. Pro tento karbocation lze nakreslit tři další rezonanční struktury, ve kterých se kladný náboj nachází na jednom ze tří aromatických uhlíků. Kladný náboj není izolován na benzylovém uhlíku, ale je delokalizován kolem aromatické struktury: tato delokalizace náboje vede k výrazné stabilizaci. V důsledku toho jsou benzylové a alkylové karbokationty (kde je kladně nabitý uhlík konjugován s jednou nebo více nearomatickými dvojnými vazbami) výrazně stabilnější než dokonce terciární alkylové karbokationty.
Protože heteroatomy, jako je kyslík a dusík, jsou elektronegativnější než uhlík, dalo by se očekávat, že budou z definice skupinami stahujícími elektrony, které destabilizují karbokationty. Ve skutečnosti je často opak pravdou: pokud je atom kyslíku nebo dusíku ve správné poloze, celkovým efektem je stabilizace karbokace. To je způsobeno tím, že ačkoli jsou tyto heteroatomy indukčně elektronově stahujícími skupinami, rezonančně jsou elektronově donujícími skupinami a právě tento rezonanční efekt je silnější. (Se stejnou myšlenkou jsme se již dříve setkali při úvahách o relativní kyselosti a zásaditosti fenolů a aromatických aminů v oddíle 7.4). Uvažujme dva níže uvedené páry karbokationtů:
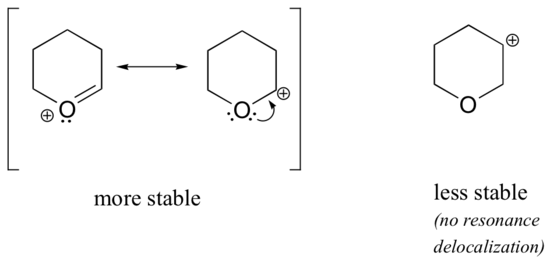
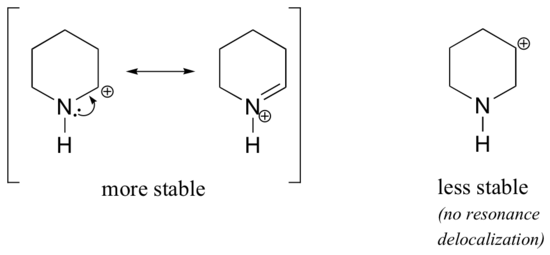
U stabilnějších karbokationtů působí heteroatom rezonancí jako skupina darující elektrony: ve skutečnosti je osamělý pár na heteroatomu k dispozici pro delokalizaci kladného náboje. V méně stabilních karbokationtech je kladně nabitý uhlík vzdálen od heteroatomu více než jednu vazbu, a proto není možný žádný rezonanční efekt. Ve skutečnosti v těchto karbokationtech heteroatomy ve skutečnosti destabilizují kladný náboj, protože indukčně odebírají elektrony.
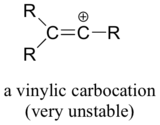
Nakonec vinylové karbokationty, v nichž se kladný náboj nachází na uhlíku s dvojitou vazbou, jsou velmi nestabilní, a proto je nepravděpodobné, že by vznikaly jako meziprodukty v jakékoli reakci.
Příklad 7.9.1
V které z níže uvedených struktur se očekává větší stabilita karbokationtu? Vysvětlete.
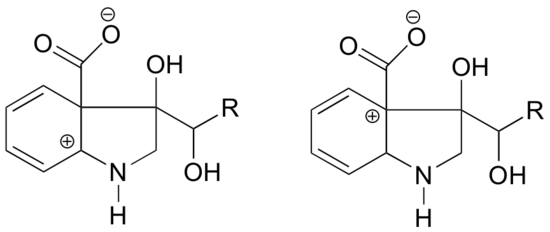
Odpověď
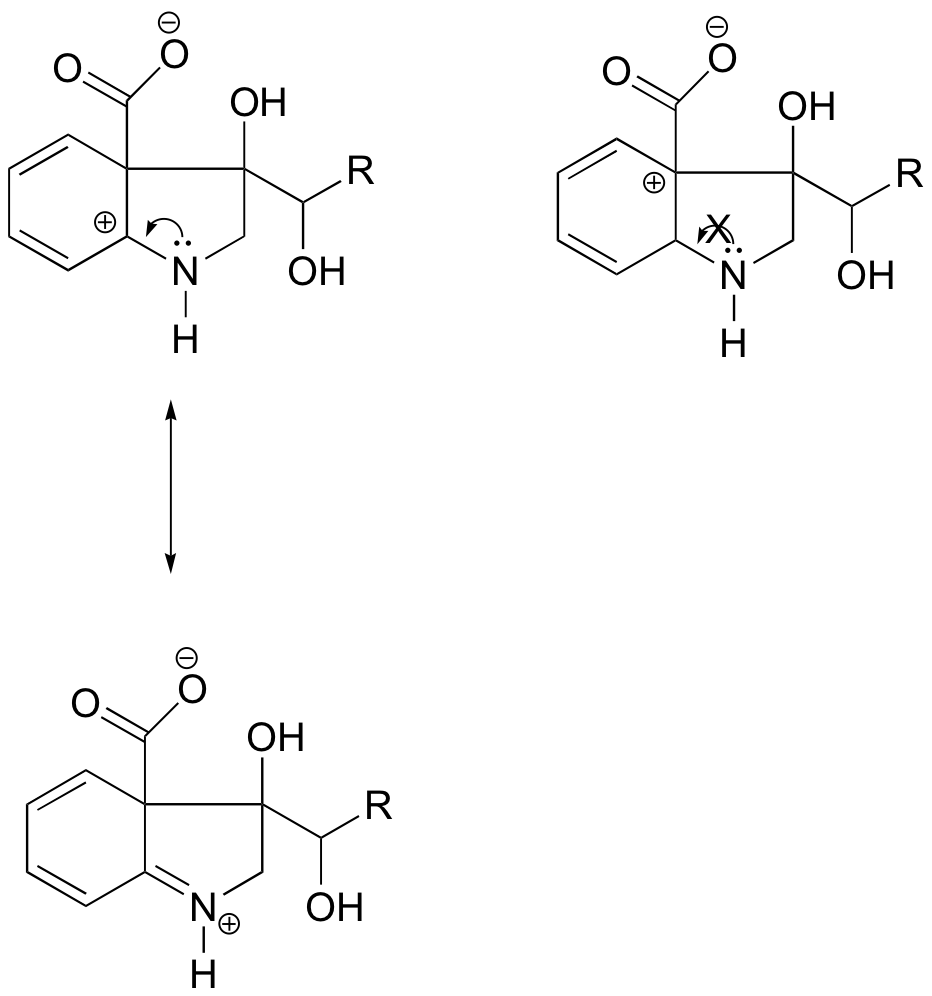
V karbokaci vlevo se kladný náboj nachází vzhledem k dusíku v takové poloze, že osamělý pár elektronů na dusíku může být donován k zaplnění prázdného orbitalu. U karbokationtu vpravo to možné není.
Karbokationty jsou většinou velmi energeticky náročné, přechodné mezidruhy v organických reakcích. Existují však některé neobvyklé příklady velmi stabilních karbokationtů, které mají podobu organických solí. Krystalová violeť je běžný název pro chloridovou sůl karbokationtu, jehož struktura je znázorněna níže. Všimněte si strukturních možností rozsáhlé rezonanční delokalizace kladného náboje a přítomnosti tří elektron-donujících aminoskupin.
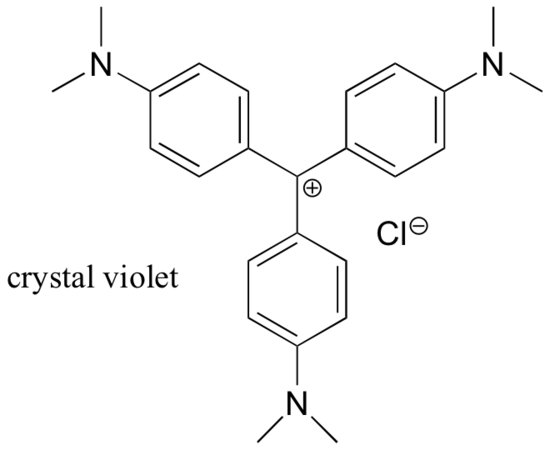
Příklad 7.9.2
Nakreslete rezonanční strukturu kationtu krystalové violeti, ve které je kladný náboj delokalizován na jeden z atomů dusíku.
Odpověď 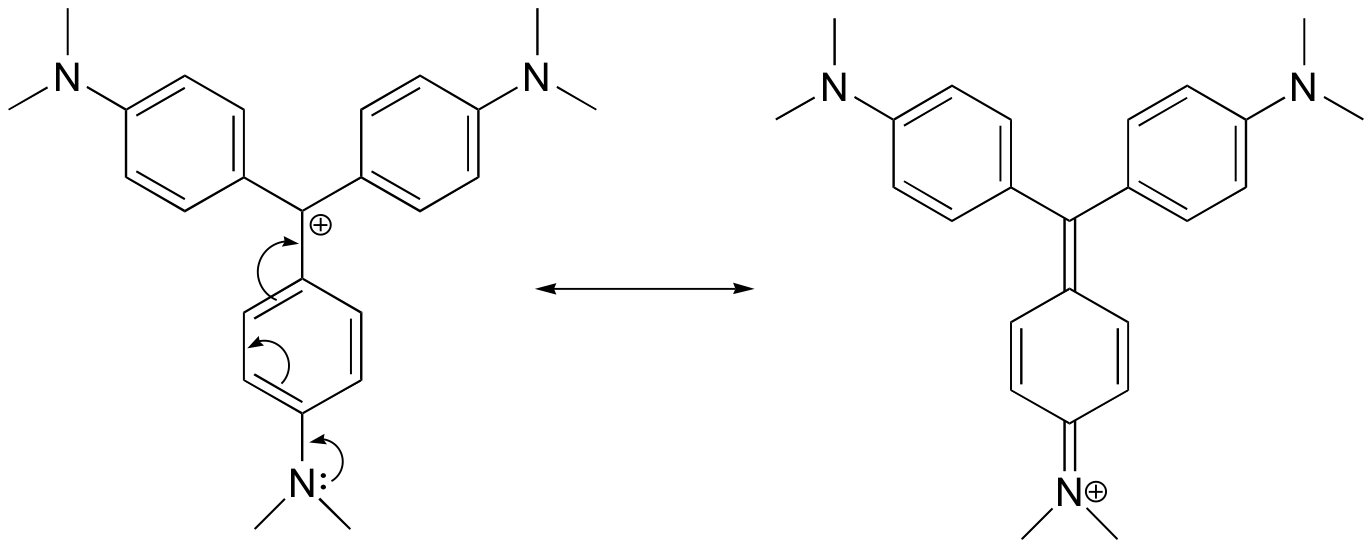
Při zvažování možnosti, že nukleofilní substituční reakce probíhá cestou SN1, je rozhodující posoudit stabilitu hypotetického karbokačního meziproduktu. Pokud tento meziprodukt není dostatečně stabilní, je třeba považovat mechanismus SN1 za nepravděpodobný a reakce pravděpodobně probíhá mechanismem SN2. V příští kapitole uvidíme několik příkladů biologicky důležitých SN1 reakcí, ve kterých je kladně nabitý meziprodukt stabilizován indukčními a rezonančními efekty vlastními jeho vlastní molekulární struktuře.
Příklad 7.9.3
Uveďte, který karbokacion v každé z níže uvedených dvojic je stabilnější, nebo zda se předpokládá, že jsou přibližně stejné. Vysvětlete své zdůvodnění.
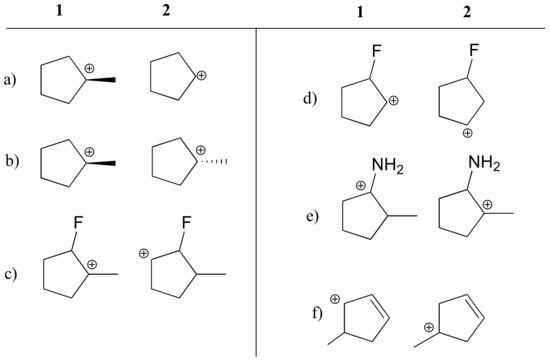
Odpověď
a) 1 (terciární vs. sekundární karbocation)
b) stejný
c) 1 (terciární vs. sekundární karbocation). sekundární karbokation)
d) 2 (kladný náboj je dále od fluoru odvádějícího elektrony)
e) 1 (osamělý pár na dusíku může rezonancí odevzdávat elektrony)
f) 1 (alický karbokation – kladný náboj může být delokalizován na druhý uhlík)