Chemguide:
Výsledek učení 11.2(f)
Toto tvrzení se týká rozdělovacích koeficientů.
Předtím, než budete pokračovat, měli byste si toto tvrzení najít a přečíst ve své kopii učebních osnov.
Dělicí součinitel
Máte-li dvě nemísitelné kapaliny, například éter a vodu, a protřepete je v dělící nálevce, vytvoří samozřejmě dvě vrstvy. Éter má menší hustotu než voda, a proto tvoří horní vrstvu.
Předpokládejme nyní, že protřepeme směs éteru a vody obsahující látku, která je rozpustná v obou. Předpokládejme, že látka X je rozpustnější v éteru než ve vodě.
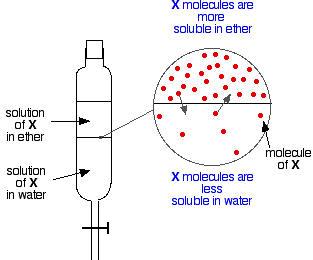
Částice látky X budou překračovat hranici mezi oběma kapalnými vrstvami a brzy se ustaví dynamická rovnováha. Za každou částici, která se přesune do horní vrstvy, se jedna přesune zpět do spodní vrstvy.
Mohli byste pro to napsat rovnici:
![]()
![]()
. . a jako u každé jiné rovnováhy můžete najít rovnovážnou konstantu:
![]()
![]()
Tato rovnovážná konstanta se nazývá rozdělovací koeficient a často se jí dává symbol Kpc.
Stejně jako ostatní rovnovážné konstanty jsou i rozdělovací koeficienty konstantní při stálé teplotě, ale mají i některá další omezení. Správně fungují pouze pro poměrně zředěné roztoky a rozpuštěná látka musí být v obou rozpouštědlech ve stejné chemické formě. Nesmí reagovat, ionizovat ani asociovat (například se spojovat v dimery).
Výpočet rozdělovacího koeficientu
Poznámka k jednotkám
Všimněte si, že rozdělovací koeficient je prostý poměr dvou koncentrací. Nezáleží na tom, jaké jednotky koncentrace použijete – pokud použijete stejné nahoře i dole.
Mohli byste použít mol dm-3, ale častěji se používají g cm-3 – gramy na centimetr krychlový.
Technicky lze hranaté závorky použít pouze pro koncentraci v mol dm-3, ale v brožuře Application Support Booklet i ve schématech známek CIE se používají i pro jiné jednotky.
Nejsem na to připraven, a proto budu používat spíše termín „koncentrace X“ než tam, kde se používají nestandardní jednotky koncentrace.
Výpočet rozdělovacího koeficientu
Když se roztok 1,00 g X ve 100 cm3 vody protřepal s 10 cm3 éteru, přešlo 0,80 g X do éterové vrstvy. Vypočítejte rozdělovací koeficient X mezi éter a vodu.
Pokud jste požádáni o výpočet rozdělovacího koeficientu mezi dvěma rozpouštědly, koncentrace prvního uvedeného rozpouštědla jde na začátek výrazu Kpc. V tomto případě tedy:
![]()
![]()
Máte dostatek informací k výpočtu obou koncentrací v g cm-3.
![]() koncentrace X v éteru = 0,80/10 g cm-3
koncentrace X v éteru = 0,80/10 g cm-3
Pokud by 0,80 g přešlo do éteru, 1,00 – 0,80 g = 0.20 g zůstalo ve vodě.
![]() koncentrace X ve vodě = 0,20/100 g cm-3
koncentrace X ve vodě = 0,20/100 g cm-3
Takže:
![]()
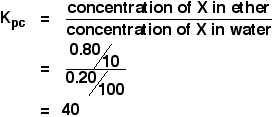
Očividně jste mohli koncentrace v éteru a ve vodě vypočítat jako skutečná čísla, než jste je dosadili do výrazu. Udělejte to tak, jak je vám to nejpohodlnější.
Rozdělovací koeficienty jako tento nemají jednotky – jednotky se ruší, protože jsou nahoře i dole stejné.
Výpočty zahrnující rozdělovací koeficienty
Sylabus CIE výslovně říká, že byste měli umět vypočítat rozdělovací koeficient (jinými slovy to, co jsme právě udělali). Neříká vůbec nic o jejich použití k výpočtu jiných věcí. O těchto dodatečných výpočtech se hovoří v brožuře Application Support Booklet a ve zkouškách do června 2013 se na ně ptali dvakrát (v obou případech v roce 2009).
The Coursebook je neobsahuje (zcela správně!), protože osnovy se o nich nezmiňují, a tato kniha byla schválena zkoušejícími CIE jako „úplné a přesné pokrytí“ osnov. Znamená to tedy, že CIE nebude v budoucnu klást žádné další otázky? S tím nepočítejte!
Základní příklad
Použijeme stejný případ jako dříve – stejná rozpouštědla, stejné X a stejný rozdělovací koeficient, který jsme právě vypočítali.
Tentokrát budeme zjišťovat, kolik by se extrahovalo do éterové vrstvy, kdybychom původní roztok 1,00 g X ve 100 cm3 vody protřepali s pouhými 5 cm3 éteru.
Snažíme se zjistit hmotnost extrahovaného X.
Vypočítáme hmotnost X, kterou jsme extrahovali. Nazvěme ji m.
Nyní vypracujeme výraz pro koncentraci roztoku X v éteru.
![]() koncentrace X v éteru = m/5 g cm-3
koncentrace X v éteru = m/5 g cm-3
Co s vodou? Ve vodě zůstane (1,00 – m) g X. Takže:
![]() koncentrace X ve vodě = (1,00 – m)/100 g cm-3
koncentrace X ve vodě = (1,00 – m)/100 g cm-3
Nyní to vše můžete dosadit do výrazu pro rozdělovací koeficient. Nezapomeňte, že rozdělovací koeficient X mezi éterem a vodou jsme již vypočítali jako 40.
![]()
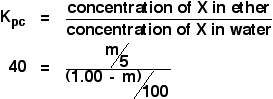
Před vámi je pak už jen jednoduchá, ale trochu zdlouhavá algebra:
![]()
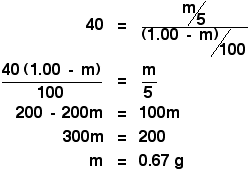
Ještě zdlouhavější!
Při původním výpočtu pro zjištění rozdělovacího koeficientu vám bylo řečeno, že když původní roztok 1,00 g X ve 100 cm3 vody protřepete s 10 cm3 éteru, extrahujete 0,80 g X.
Třepáním s 5 cm3 éteru jsme právě došli k tomu, že extrahujete 0,67 g X.
Tak by ve 100 cm3 vody zůstalo 0,33 g X.
Takové roztoky by se daly použít pro stanovení rozdělovacího koeficientu. Předpokládejme, že byste tento roztok pečlivě uchovali a pak jej protřepali s druhými čerstvými 5 cm3 éteru.
Kolik X byste celkem extrahovali, kdybyste použili éter jako dvě samostatné dávky po 5 cm3 namísto 10 cm3 najednou?
Hmotnost X extrahovaného druhou dávkou éteru nazvěme n – aby se nám to nepletlo.
Vypracujte výraz pro koncentraci roztoku X v éteru.
![]() koncentrace X v éteru = n/5 g cm-3
koncentrace X v éteru = n/5 g cm-3
A co voda? Po druhé extrakci zůstane ve vodě (0,33 – n) g X. Jaký je výsledek? Takže:
![]() koncentrace X ve vodě = (0,33 – n)/100 g cm-3
koncentrace X ve vodě = (0,33 – n)/100 g cm-3
Nyní to vše můžete dosadit do výrazu pro rozdělovací koeficient X mezi éter a vodu jako dříve.
![]()

To znamená, že kdybyste spojili dvě dávky éteru o objemu 5 cm3 , extrahovali byste celkem 0,67 + 0,22 g X. To je 0. To znamená, že byste získali 0,67 + 0,22 g X.89 g.
Původně vám bylo řečeno, že kdybyste to udělali pouze jednou a použili ether jako jednu dávku o objemu 10 cm3 , extrahovali byste pouze 0,80 g.
Účinnější extrakce dosáhnete rozdělením rozpouštědla na menší objemy, jak je uvedeno výše.
Tento druh techniky se používá při přípravě některých organických sloučenin. Extrahujete to, co se snažíte vyrobit, z nějakého neuspořádaného roztoku ve vodě tak, aby to skončilo v organickém rozpouštědle. Rozpouštědlo pak odstraníte opatrnou destilací.
CIE položila podobnou otázku v červnu 2009 v písemné práci 4 Q8. Měli jste vypočítat hodnotu rozdělovacího koeficientu a pak ji použít při dvoustupňové extrakci přesně podle výše uvedeného postupu. Výpočet měl hodnotu 4 bodů. Je to sice zdlouhavé a (kromě výpočtu rozdělovacího koeficientu) není v učebních osnovách, ale nemůžete si dovolit to nezvládnout
.