Cíle učení
- Použít zápis článků k popisu galvanických článků
- Popsat základní součásti galvanických článků
Galvanické články, známé také jako voltážní články, jsou elektrochemické články, ve kterých samovolnými oxidačně-redukčními reakcemi vzniká elektrická energie. Při psaní rovnic je často vhodné rozdělit oxidačně-redukční reakce na poloreakce, aby se usnadnilo vyvážení celkové rovnice a zdůraznily se skutečné chemické přeměny.
Přemýšlejte, co se stane, když čistý kousek měděného kovu umístíte do roztoku dusičnanu stříbrného (obrázek 1). Jakmile se přidá kov mědi, začne se tvořit kov stříbra a do roztoku přecházejí ionty mědi. Modrá barva roztoku zcela vpravo ukazuje na přítomnost měďnatých iontů. Reakci lze rozdělit na dvě poloreakce. Poloreakce oddělují oxidaci od redukce, takže každou z nich lze posuzovat samostatně.
Rovnice pro redukční poloreakci musela být zdvojena, aby se počet elektronů „získaných“ při redukční poloreakci rovnal počtu elektronů „ztracených“ při oxidační poloreakci.

Galvanické nebo voltaické články zahrnují spontánní elektrochemické reakce, při nichž jsou odděleny poloreakce (obrázek 2), takže vnějším vodičem může protékat proud. Kádinka na levé straně obrázku se nazývá poloviční článek a obsahuje 1 M roztok dusičnanu měďnatého(II) s kouskem měděného kovu částečně ponořeným do roztoku. Kov mědi je elektroda. Měď prochází oxidací, proto je měděná elektroda anodou. Anoda je drátem připojena k voltmetru a druhá svorka voltmetru je drátem připojena ke stříbrné elektrodě. Na stříbře probíhá redukce, proto je stříbrná elektroda katodou. Poločlánek na pravé straně obrázku tvoří stříbrná elektroda v 1 M roztoku dusičnanu stříbrného (AgNO3). V tomto bodě neteče žádný proud – to znamená, že nedochází k žádnému významnému pohybu elektronů vodičem, protože obvod je otevřený. Obvod se uzavírá pomocí solného můstku, který přenáší proud s pohybujícími se ionty. Solný můstek se skládá z koncentrovaného, nereaktivního roztoku elektrolytu, jako je roztok dusičnanu sodného (NaNO3) použitý v tomto příkladu. Jak elektrony proudí zleva doprava přes elektrodu a vodič, dusičnanové ionty (anionty) procházejí porézní zátkou vlevo do roztoku dusičnanu měďnatého(II). Tím se udržuje kádinka vlevo elektricky neutrální tím, že se neutralizuje náboj iontů mědi(II), které vznikají v roztoku při oxidaci kovové mědi. Ve stejné době, kdy se dusičnanové ionty pohybují doleva, se sodíkové ionty (kationty) pohybují doprava, přes porézní zátku, do roztoku dusičnanu stříbrného vpravo. Tyto přidané kationty „nahrazují“ ionty stříbra, které byly z roztoku odstraněny při redukci na kovové stříbro, a udržují kádinku vpravo elektricky neutrální. Bez solného můstku by přihrádky nezůstaly elektricky neutrální a neprotékal by žádný významný proud. Pokud jsou však obě komory v přímém kontaktu, solný můstek není nutný. V okamžiku, kdy je obvod uzavřen, ukazuje voltmetr +0,46 V, což se nazývá potenciál článku. Potenciál článku vzniká při spojení dvou různorodých kovů a je mírou energie na jednotku náboje, která je k dispozici při oxidačně-redukční reakci. Volt je odvozená jednotka SI pro elektrický potenciál
V této rovnici je A proud v ampérech a C náboj v coulombech. Všimněte si, že volty je třeba vynásobit nábojem v coulombech (C), abychom získali energii v joulech (J).
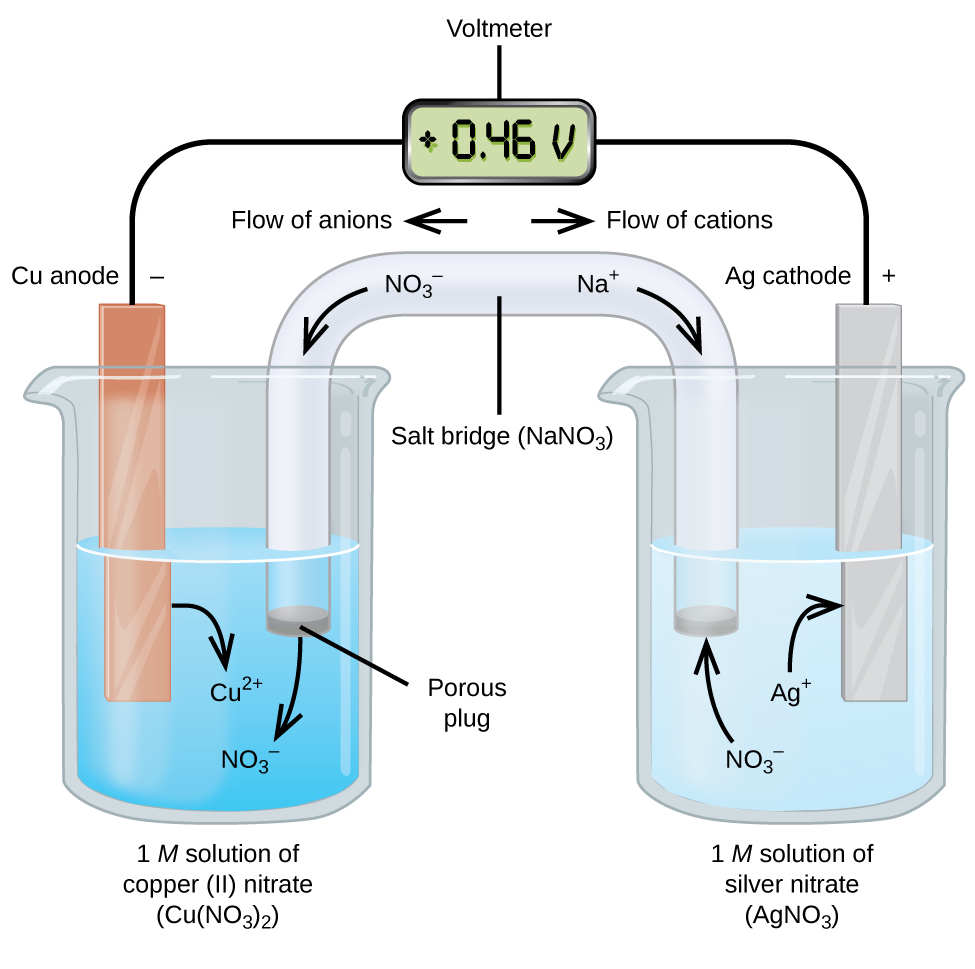
Pokud je elektrochemický článek konstruován tímto způsobem, kladný potenciál článku znamená, že probíhá spontánní reakce a že elektrony proudí zleva doprava. Na obrázku 2 se toho děje hodně, proto je užitečné věci pro tento systém shrnout:
- Elektrony proudí od anody ke katodě: zleva doprava ve standardním galvanickém článku na obrázku.
- Elektroda v levém půlčlánku je anoda, protože zde dochází k oxidaci. Název odkazuje na tok aniontů v solném můstku směrem k ní.
- Elektroda v pravém půlčlánku je katoda, protože zde dochází k redukci. Název odkazuje na tok kationtů v solném můstku směrem k ní.
- Na anodě (levá polovina článku na obrázku) dochází k oxidaci.
- Na katodě (pravá polovina článku na obrázku) dochází k redukci.
- Potenciál článku, +0.46 V v tomto případě vyplývá z přirozených rozdílů v povaze materiálů použitých k výrobě obou polovičních článků.
- K uzavření (dokončení) obvodu musí být přítomen solný můstek a pro průchod proudu musí dojít jak k oxidaci, tak k redukci.
Možných galvanických článků je mnoho, proto se pro jejich popis obvykle používá zkrácený zápis. Zápis článku (někdy nazývaný schéma článku) poskytuje informace o různých druzích, které se reakce účastní. Tento zápis funguje i pro jiné typy článků. Svislá čára │ označuje fázovou hranici a dvojitá čára ‖ solný můstek. Informace o anodě se zapisují vlevo, následuje anodový roztok, pak solný můstek (je-li přítomen), pak katodový roztok a nakonec informace o katodě vpravo. Zápis článku pro galvanický článek na obrázku 2 je tedy
Všimněte si, že nejsou zahrnuty spektrální ionty a že byla použita nejjednodušší forma každé poloreakce. Jsou-li známy počáteční koncentrace jednotlivých iontů, jsou obvykle zahrnuty.
Jednou z nejjednodušších buněk je Daniellův článek. Tuto baterii je možné sestrojit tak, že na dno nádoby umístíme měděnou elektrodu a kov pokryjeme roztokem síranu měďnatého. Na roztoku síranu měďnatého plave roztok síranu zinečnatého; do roztoku síranu zinečnatého se pak umístí zinková elektroda. Připojení měděné elektrody ke zinkové elektrodě umožňuje průchod elektrického proudu. Toto je příklad článku bez solného můstku a přes rozhraní mezi oběma roztoky mohou proudit ionty.
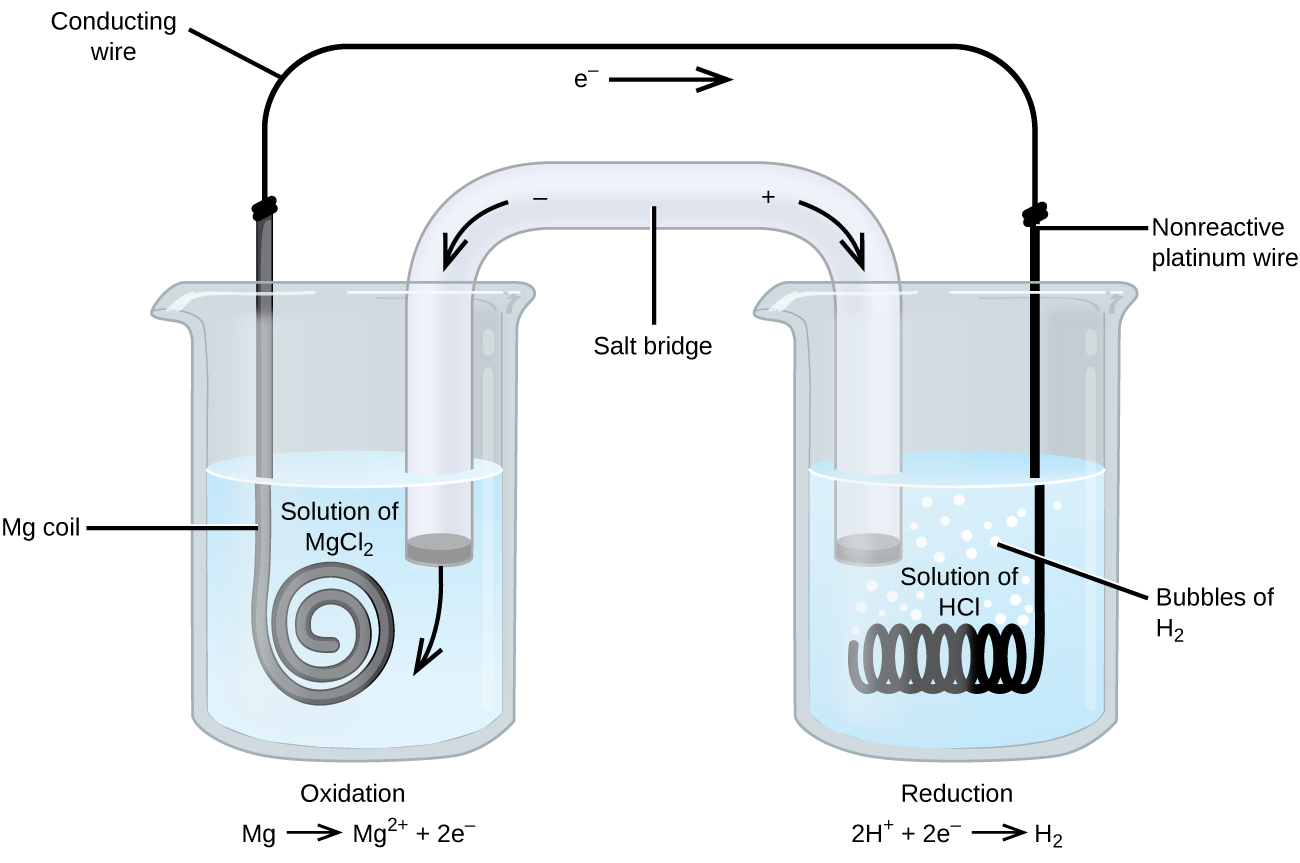
Některé oxidačně-redukční reakce zahrnují druhy, které jsou špatnými vodiči elektřiny, a proto se používá elektroda, která se reakcí neúčastní. Často je elektrodou platina, zlato nebo grafit, které jsou vůči mnoha chemickým reakcím inertní. Jeden takový systém je znázorněn na obrázku 3. Na anodě vlevo na obrázku probíhá oxidace hořčíku a na katodě vpravo probíhá redukce vodíkových iontů. Reakci lze shrnout takto
V článku byl jako katoda použit inertní platinový drát, takže zápis článku je
Hořčíková elektroda je aktivní elektrodou, protože se účastní oxidačně-redukční reakce. Inertní elektrody, jako je platinová elektroda na obrázku 3, se neúčastní oxidačně-redukční reakce a jsou přítomny proto, aby článkem mohl protékat proud. Platina nebo zlato jsou obecně dobrými inertními elektrodami, protože jsou chemicky nereaktivní.
Příklad 1
Použití zápisu článku
Považujte galvanický článek složený z
Zapište oxidační a redukční poloreakci a zapište reakci pomocí buněčného zápisu. Která reakce probíhá na anodě? Na katodě?
Roztok
Podle kontroly se Cr oxiduje, když ztrácí tři elektrony za vzniku Cr3+, a Cu2+ se redukuje, když získává dva elektrony za vzniku Cu. Vyvážení náboje dává
Celkový zápis používá nejjednodušší formu každé z rovnic a začíná reakcí na anodě. Nebyly tak uvedeny žádné koncentrace: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Na anodě dochází k oxidaci a na katodě k redukci.
Použití zápisu článku
Považujte galvanický článek složený z
Zapište oxidační a redukční poloreakci a zapište reakci pomocí buněčného zápisu. Která reakce probíhá na anodě? Na katodě?
Roztok
Podle kontroly Fe2+ podléhá oxidaci, když ztrácí jeden elektron za vzniku Fe3+, a MnO4- se redukuje, když získává pět elektronů za vzniku Mn2+. Vyvážení náboje dává
Celkový zápis používá nejjednodušší formu každé z rovnic a začíná reakcí na anodě. Je nutné použít inertní elektrodu, například platinu, protože není přítomen žádný kov, který by vedl elektrony od anody ke katodě. Nebyly tak specifikovány žádné koncentrace: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Na anodě dochází k oxidaci a na katodě k redukci.
Ověřte si své znalosti
Popis galvanického článku, ve kterém se ionty mědi(II) redukují na kovovou měď a kovový zinek se oxiduje na zinečnaté ionty.
Odpověď:
Z informací uvedených v úloze:
\begin{array}{lr @{{}\longrightarrow{}} l} \text{anoda\;(oxidace):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \\ \text{katoda\;(redukce):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \\ \hline \\ \text{celkem:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
Pomocí buněčného zápisu:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Elektrochemické články se obvykle skládají ze dvou poločlánků. Poločlánky oddělují oxidační poloreakci od redukční poloreakce a umožňují průchod proudu vnějším vodičem. Jeden půlčlánek, na obrázku obvykle zobrazený na levé straně, obsahuje anodu. Na anodě dochází k oxidaci. Anoda je spojena s katodou v druhém půlčlánku, který je na obrázku často znázorněn na pravé straně. Na katodě dochází k redukci. Přidáním solného můstku se obvod uzavře a umožní průchod proudu. Anionty v solném můstku proudí směrem k anodě a kationty v solném můstku proudí směrem ke katodě. Pohyb těchto iontů uzavírá obvod a udržuje každý poločlánek elektricky neutrální. Elektrochemické články lze popsat pomocí zápisu článků. V tomto zápisu se informace o reakci na anodě zobrazují vlevo a informace o reakci na katodě vpravo. Solný můstek je znázorněn dvojitou čarou ‖. Pevná, kapalná nebo vodná fáze v polobuňce jsou odděleny jedinou čarou, │. Za názvem druhu je uvedena fáze a koncentrace jednotlivých druhů. Elektrody, které se účastní oxidačně-redukční reakce, se nazývají aktivní elektrody. Elektrody, které se neúčastní oxidačně-redukční reakce, ale jsou zde proto, aby umožnily průchod proudu, se nazývají inertní elektrody. Inertní elektrody se často vyrábějí z platiny nebo zlata, které se při mnoha chemických reakcích nemění.
Chemie Cvičení ke konci kapitoly
- Napsat následující vyvážené reakce pomocí buněčného zápisu. V případě potřeby použijte jako inertní elektrodu platinu.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- Díky následujícím zápisům buněk určete oxidovaný druh, redukovaný druh a oxidační a redukční činidlo, aniž byste psali vyvážené reakce.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\paralelní}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- Pro zápisy buněk v předchozí úloze, napište odpovídající vyvážené reakce.
- Vyvažte následující reakce a zapište je pomocí buněčného zápisu. Ignorujte všechny inertní elektrody, protože nikdy nejsou součástí poloreakcí.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(základní\;roztok)}
- U všech reakcí v předchozí úloze určete oxidovaný druh, redukovaný druh a oxidační a redukční činidlo.
- Na základě poskytnutých informací popište pomocí buněčného zápisu následující soustavy:
(a) V jedné polobuňce vzniká z roztoku Pt(NO3)2 kov Pt, zatímco v druhé polobuňce přechází kov Cu do roztoku Cu(NO3)2 o koncentraci všech rozpuštěných látek 1 M.
(b) Katodu tvoří zlatá elektroda v 0,55 M roztoku Au(NO3)3 a anodou je hořčíková elektroda v 0,55 M roztoku Au(NO3)3.
(c) Katoda je tvořena zlatou elektrodou v 0,55 M roztoku Au(NO3)3.75 M roztoku Mg(NO3)2.
(c) Jeden půlčlánek tvoří stříbrná elektroda v 1 M roztoku AgNO3 a v druhém půlčlánku se oxiduje měděná elektroda v 1 M roztoku Cu(NO3)2.
- Proč je v galvanických článcích, jako je ten na obrázku 2, nutný solný můstek?
- Zjistilo se, že aktivní (kovová) elektroda ztrácí hmotnost, když se nechá probíhat oxidačně-redukční reakce. Byla elektroda součástí anody nebo katody? Vysvětlete.
- Aktivní elektrody se účastní oxidačně-redukční reakce. Protože kovy tvoří kationty, elektroda by ztratila hmotnost, kdyby atomy kovů v elektrodě oxidovaly a přešly do roztoku. K oxidaci dochází na anodě.
- Hmotnost tří různých kovových elektrod, každé z jiného galvanického článku, byla stanovena před a po průchodu proudu vzniklého oxidačně-redukční reakcí v každém článku po dobu několika minut. Bylo zjištěno, že hmotnost první kovové elektrody s označením A se zvýšila, hmotnost druhé kovové elektrody s označením B se nezměnila a hmotnost třetí kovové elektrody s označením C se snížila. Odhadněte, které elektrody byly aktivní a které inertní a které anoda (anody) a které katoda (katody).
Slovník
aktivní elektroda elektroda, která se účastní oxidačně-redukční reakce elektrochemického článku; hmotnost aktivní elektrody se mění během oxidačně-redukční reakce anodová elektroda v elektrochemickém článku, u které dochází k oxidaci; informace o anodě se zaznamenávají na levé straně solného můstku v zápisu článku katodová elektroda v elektrochemickém článku, při níž dochází k redukci; informace o katodě se zaznamenávají na pravé straně solného můstku v zápisu článku zkrácený způsob vyjádření reakcí v elektrochemickém článku rozdíl elektrických potenciálů, který vzniká při spojení různorodých kovů; hnací síla pro tok náboje (proudu) v oxidačně-redukčních reakcích galvanický článek elektrochemický článek, ve kterém probíhá samovolná oxidačně-redukční reakce; elektrochemické články s kladným potenciálem článku; nazývají se také voltážní článek inertní elektroda elektroda, která umožňuje průtok proudu, ale jinak se neúčastní oxidačně-redukční reakce v elektrochemickém článku; hmotnost inertní elektrody se během oxidačně-redukční reakce nemění; inertní elektrody jsou často vyrobeny z platiny nebo zlata, protože tyto kovy jsou chemicky nereaktivní. Voltův článek jiný název pro galvanický článek
Řešení
Odpovědi na cvičení z chemie ke konci kapitoly
1. Co je to galvanický článek? (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Oxidovaný druh = redukční činidlo: (a) Al(s); (b) NO(g); c) Mg(s); a d) MnO2(s); Druh redukovaný = oxidační činidlo: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\;\;2-}(aq); a (d) \text{ClO}_3^{\;\;-}(aq)
7. Bez solného můstku by byl obvod otevřený (nebo přerušený) a nemohl by protékat žádný proud. Se solným můstkem zůstává každý půlčlánek elektricky neutrální a obvodem může protékat proud.
9. Co je to solný můstek? Bylo zjištěno, že aktivní (kovová) elektroda nabývá na hmotnosti, když se nechá probíhat oxidačně-redukční reakce. Byla elektroda součástí anody nebo katody? Vysvětlete.
.