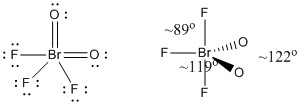Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Napište elektronovou konfiguraci (pomocí notace vzácných plynů pro uzavřené slupky) a základní stav Term Symbol pro následující látky: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
K term symbolu přispívá pouze 3d elektron: L = 2 a S = ½ dává 2D
b) Sc+
3d2
L = 3 a S = 1 dává 3F
c) Sc2+
3d1
L = 2 a S = ½ dává 2D
d) Sc3+
L = 0 a S = 0 dává 1S
d) Sc-
4s23d2
L = 3 a S = 1 dává 3F
2. Napište Lewisovu bodovou strukturu, uveďte formální náboje všech atomů, předpovězte molekulovou geometrii, odhadněte všechny vazebné úhly a uveďte pravděpodobný hybridní orbital pro: a) BrO2-; b) BrO3-; c) BrO2F3.
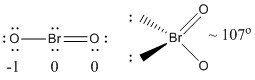
a) BrO2-
Lewisova struktura:
Formální náboje jsou uvedeny na Lewisově struktuře
Struktura: ohnutá planární s vazebným úhlem ~107°
Hybridní orbital na Br: sp3
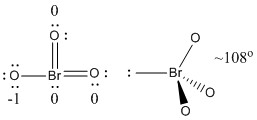
b) BrO3-
Lewisova struktura:
Formální náboje jsou uvedeny na Lewisově struktuře
Struktura: pyramidální s vazebnými úhly O-Br-O ~108°
Hybridní orbital na Br: sp3
c) BrO2F3
Lewisova struktura:
Formální náboje jsou uvedeny na Lewisově struktuře
Struktura: trigonální bipyramidální s vazebnými úhly uvedenými na obrázku
Hybridní orbital na Br: dsp3
3. Absolutní tvrdost atomu je definována jako η = ½(IP – EA), IP je ionizační potenciál a EA je elektronová afinita. Předpovězte periodické trendy η a svou předpověď zdůvodněte.
Pro téměř všechny atomy platí IP >> EA, takže η bude sledovat periodické trendy IP: roste, když se pohybujeme v periodické tabulce doprava (po Z*), a mírně klesá, když se pohybujeme v periodické tabulce dolů s rostoucím poloměrem atomu.
4. Cr2 má elektronovou konfiguraci σ2π4δ4δ*2. V tomto případě se jedná o elektronovou konfiguraci. Jaké je pořadí vazeb a kolik nepárových spinů se předpokládá? Očekávali byste, že Cr2 bude absorbovat světlo ve viditelné oblasti spektra? Proč nebo proč ne?
Vazbový řád = ½(2 + 4 + 4 – 2) = 4 se 2 nepárovými spiny (protože existují 2 orbitaly δ, musí existovat také 2 orbitaly δ*, které mají na základě Hundových pravidel každý jeden elektron). Překrývání d orbitalů vedle sebe, které tvoří δ orbitaly, je slabé, takže rozdělení mezi δ a δ* orbitaly bude malé. To naznačuje, že energie potřebná k přesunu elektronu z HOMO do LUMO je také malá, což předpovídá absorpci ve viditelné části spektra.
.