Elektrochemický článek se v nejjednodušším případě skládá ze dvou elektronových vodičů oddělených iontovým vodičem a spojených elektronovým vodičem.
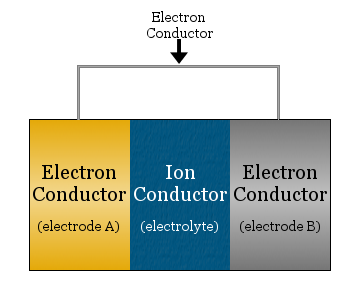
- Iontový vodič se nazývá elektrolyt
- Elektronové vodiče oddělené elektrolytem se nazývají elektrody
- Elektronový vodič použitý k propojení elektrod je často kovový drát, například měděné vedení
Dva typy článků
Existují dva základní typy elektrochemických článků: galvanický a elektrolytický.
K přeměně energie dochází spontánními (ΔG < 0) redoxními reakcemi, při nichž vzniká tok elektronů.
Tok elektronů pohání nesamovolné (ΔG ≥ 0) redoxní reakce.
Příklady
- Příkladem galvanického článku je baterie, která něco napájí.
- Dobíjecí baterie jsou příkladem obou typů článků: fungují jako galvanické články, když napájejí nějaké zařízení, a jako elektrolytické články, když se dobíjejí.
- Příkladem elektrolytických článků jsou také články používané k rozdělení vody na vodík a kyslík a články, které přeměňují hliníkovou rudu na kovový hliník.
Zdroj termodynamických údajů
Kromě praktického využití, jako je výše popsané, poskytují elektrochemické články vynikající způsob shromažďování termodynamických údajů. umožňují například stanovit standardní redoxní potenciály, z nichž lze pohodlně získat údaje o standardní entalpii, standardní entropii a standardní Gibbsově volné energii reakcí.
Dělení reakcí
Elektrochemické články mohou:
- dodávat elektrickou energii, nebo
- přeměňovat kovové rudy na kov, nebo
- poskytovat termodynamická data,
protože redoxní reakce probíhají odděleně.
Příklad: Vezměme si jeden z prvních galvanických článků, Daniellův článek
V elektrochemických článcích probíhají reakce na oddělených elektrodách – a samotné elektrody mohou být umístěny v různých nádobách.
Zdrojem energie Daniellův článek je spontánní reakce kovového zinku se síranem měďnatým za vzniku síranu zinečnatého a kovové mědi.
ΔG° = -212.6 kJ mol-1
Při spojení materiálů:
- v přímém kontaktu v jedné nádobě se chemická potenciální energie přemění na tepelnou a reakční nádoba se zahřeje
- v elektrochemickém článku se chemická potenciální energie přemění na energii elektrickou
Daniellův článek
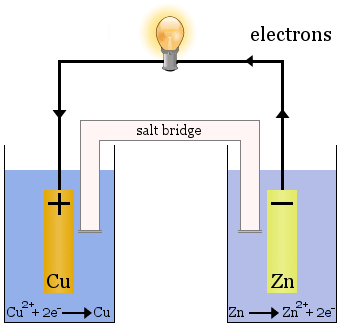
Daniellův článek se skládá ze dvou polovičních článků: V jednom se redukují ionty mědi a v druhém se oxiduje zinek.
Při provozu článku se z jednoho článku odvádí Cu2+ a v druhém článku se vytváří Zn2+. měděná elektroda se začne zvětšovat, protože je pokryta čerstvě naneseným kovem mědi, a zinková elektroda se začne zmenšovat v důsledku ztráty zinku ve formě iontů do roztoku.
Slaný můstek ve výše uvedeném případě je skleněná trubice naplněná nasyceným roztokem KNO3.Na jejích koncích jsou fritézy, které zabraňují promíchání roztoků v jednotlivých poločláncích, ale umožňují průchod iontů, aby se dokončil elektrický obvod a každý poločlánek zůstal elektricky neutrální.
Hnací síla je stejná ΔG° = -212 .6 kJ mol-1 , kterou získáme při pouhém smíchání reaktantů v jedné nádobě;oddělením obou poloreakcí musí elektrony procházet vodičem a my můžeme využít elektrickou energii.

.