- Přehledový článek
- Enterokutánní píštěl: Evidence-based Management
- Abstrakt
- Úvod
- Tabulka 1
- Tabulka 1: Klasifikace.
- Tabulka 2
- Tabulka 2: Prognostické proměnné ECF.
- Klasifikace
- Prognostické faktory pro ECF
- Diagnostika
- Obrázek 1
- Řízení
- Resuscitace
- Kontrola zdrojů
- Řízení výpotku
- Péče o rány
- Tabulka 3
- Tabulka 3: Načasování do definitivního řízení.
- Výživa
- Závěr
Přehledový článek
Enterokutánní píštěl: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 a Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Corresponding author: Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstrakt
Řešení enterokutánní píštěle (ECF) je klinická dovednost, která by měla být ve výbavě každého všeobecného chirurga. Ačkoli definitivní léčba často spočívá vchirurgickém uzávěru, předoperační péče a pečlivost jsou pro zajištění úspěšného výsledku prvořadé. Péče o tyto pacienty by se měla zaměřit na čtyři klíčové fáze. První fáze je charakterizována vhodnýmrozpoznáním a resuscitací. Během druhé fáze se provádí kompletní nutriční posouzení a plán. Rentgenologické hodnocení během třetí fáze pomáhá definovat anatomii ECF. Konečně čtvrtá fáze je charakterizována definitivním uzavřením, pokud se píštěl spontánně nezhojí.Tento přehled se zaměří na klíčové aspekty, které definují jednotlivé fáze a pomáhají všeobecnému chirurgovi maximalizovat šance na pozitivní výsledek.
Úvod
Vznik enterokutánní píštěle (ECF), definované jako anomální spojení mezi lumen střeva a zevní kůží, je významným zdrojem morbidity a mortality navzdory pokroku v chirurgické i lékařské péči. Celková incidence ECF je však neznámá, přičemž většina údajů o ECF pochází z velkých institucionálních retrospektivních nebo chirurgických sérií. Pozoruhodné je, že pouze 25 % všech ECF je sekundárních v důsledku zánětlivých střevních onemocnění, divertikulární patologie, traumatu, ozařování a malignity . Naproti tomu téměř 75 % všech ECF je přímým důsledkem laparoskopické nebo otevřené operace, přičemž za více než 50 % těchto píštělí je zodpovědný astomotický únik poenterectomii. Zbývající píštěle vznikají při neúmyslných iatrogenních poraněních, jako jsouenterotomie nebo nerozpoznaná termická poranění vzniklá v průběhu operace . Vzhledem k tomu, že ECF je nejčastěji problémem způsobeným chirurgem, leží břemeno prevence i vhodného řízení, plánování a definitivní léčby právem na chirurgovi.
Morbidita a mortalita po ECF je mimořádně vysoká. Odhaduje se, že u 90 % pacientů se vyskytne morbidita související s ECF, od exkoriace kůže přes dehydrataci až po sepsi.Navíc se mortalita způsobená ECF pohybuje v rozmezí 5-20 % a závisí na řadě faktorů včetně základní infekce a umístění píštěle. Vzhledem k tomu, že hlavní příčinou úmrtí u pacientů s ECF je sepse, zůstává kontrola zdroje jedním ze základních kamenů léčby. V retrospektivních sériích bylo zaznamenáno 16násobné zvýšení úmrtnosti v případě sepse a 22násobné v případě nekontrolované infekce . Včasná a definitivní léčba nedrenovaných kolekcí ve spojení s krátkodobým podáváním antimikrobiálních látek má proto potenciál významnězlepšit výsledky. Ve většině sérií se také zdá, že úmrtnost koreluje s výkonem a umístěním píštěle. Mortalita se zvyšuje z 26 % u píštělí s nízkým výdejem na 50 % u píštělí s vysokým výdejem vzhledem k tekutinovým, elektrolytovým a nutričním problémům spojeným s léčbou ECF . Mortalita rovněž koreluje s umístěním a klesá u distálnějších píštělí. Zatímco u jejunální píštěle je mortalita nejvyšší (29 %) a její zvládnutí je podstatně náročnější, mortalita u kolonické píštěle je nejnižší (6 %).
Kromě dopadu na pacienta, který se pohybuje od fyziologického po psychický, představuje zvládání ECF obrovskou zátěž pro zdravotnické zdroje. Odhaduje se, že náklady na léčbuECF značně přesahují 500 000 dolarů a vyžadují multidisciplinární tým odborníků na výživu, sester pro péči o rány a chirurgů, aby byl zajištěn dobrý výsledek . Význam vysoce odborných léčebných center by neměl být podceňován a bylo prokázáno, že významně snižují úmrtnost ze 42 % na 20 % .
Tabulka 1

| Anatomické | Proximální nebo distální | Žaludeční, duodenální, jejunální, ileální, tlustého střeva |
| Fyziologický | Vysoký, střední, nízký výdej | Vysoký výdej >500 cm3/den Střední 200-500 cm3/den Nízký výdej < 200 cm3/den |
| Etiologie | Iatrogenní vs. spontánní Traumatická |
Maligní Radiační Zánětlivé střevní onemocnění Divertikulární |
Tabulka 1: Klasifikace.
Tabulka 1
Klasifikace.
Tabulka 2

| PŘÍP. | NEVHODNÝ |
|---|---|
| Nutričně plný | Nutričně ochuzený |
| – Albumin >3.0 | -Nízká hladina albuminu, nízká hladina transferinu |
| Dlouhý píštělový trakt (>2cm) | Krátká píštěl, mnohočetné, složité píštěle |
| Divertikulární píštěl | Velký enterální defekt (>1cm), viditelná sliznice |
| Malý výdej | Vysoký výdej (>500cc/den) |
| Jediná píštěl | Předchozí ozáření |
| Střevní kontinuita | Více předchozích operací |
| Indexová operace provedená ve stejném centru | Externí odeslání do vysokého centracentru |
Tabulka 2: Prognostické proměnné ECF.
Tabulka 2
Prognostické proměnnéECF.
Klasifikace
Neexistuje žádné univerzální nebo zavedené klasifikační schéma proECF. Fistuly jsou obecně klasifikovány anatomicky, fyziologickynebo podle chorobného procesu . Fistuly lze navíc klasifikovat podle množství denního výdeje. Je nezbytné, aby byl výstup píštěle přesně zdokumentován, protože jeho množství může diktovat změny v managementu. Tabulka 1 podrobně popisuje tři různá klasifikační paradigmata.
Prognostické faktory pro ECF
Prognostické faktory pro ECF byly velmi dobře popsánya jsou v souladu se standardními chirurgickými dogmaty. Pacienti s proximální píštělí s vysokým výdejem doprovázenou nízkým albuminem(. Naopak pacienti bez komorbidit, kteří mají píštěle, které jsou výsledkem chirurgického zákroku a mají nízký výdej, si vedou příznivěji s vyššími spontánními uzávěry . V tabulce 2 je podrobně popsáno mnoho proměnných, které mohou předpovídat úspěšný výsledek.
Důležitost institucionální podpory a multidisciplinární odbornosti jako pozitivního prognostického faktoru nelze přeceňovat.
Mnohé studie potvrdily institucionální zkušenosti a objem jako rozhodující faktory při snižování morbidity a zlepšování mortality. Kanadská asociace pro enterostomální terapii nedávno kodifikovala význam multidisciplinární péče tím, že ve svých doporučeních „ECF Best Practice“ určila devět základních členů týmu. Tento integrovaný týmový přístup, od chirurgů přes lékárníky až po kaplany, uznává odbornost, kterou každá specializace přináší do péče o tyto složité pacienty .
Diagnostika
Tlumivý pooperační průběh komplikovaný ileem a rozvojem pooperační infekce rány je předzvěstíECF. Jakmile je podezření na píštěl nebo byla zjištěna při fyzikálnímvyšetření, jsou radiologická vyšetření nezbytným doplňkem a 97 % všechpacientů podstoupí nějakou formu radiologického vyšetření . Kontrastní CT vyšetření je nezbytné, protože hodnotí přítomnost přidruženého abscesu nebo nedrenované kolekce. Po optimalizaci kontroly zdroje hraje fluoroskopická fistulografie důležitou roli při definování anatomie píštěle. Fistulogram pomůže lokalizovat původ, určit délku, zhodnotit přítomnost distálníobstrukce a určit, zda je píštěl v kontinuitě se zbytkem střeva. Jakmile je diagnóza ECF potvrzena, je třeba se zaměřit na léčbu.
Obrázek 1
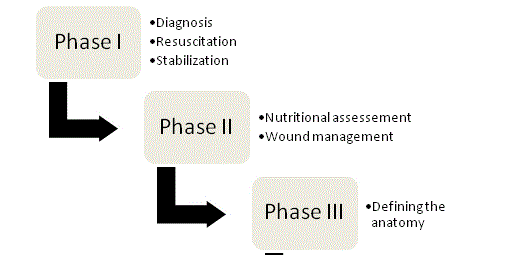
Obrázek 1
Čtyři fáze řízení ECF.
Řízení
Desatero řízení EKF poprvé obhájilChapman s kolegy v roce 1964 a dodnes zůstává základním kamenem terapie. Ve svém původním článku Chapman a spol. identifikovali čtyři klíčové faktory: resuscitaci tekutin, kontrolu zdrojů, řízení výtoku a ochranu kůže. V poslední době se jako pátý klíčový prvek objevil význam výživy. U každého pacienta s píštělí by měl být uplatňován organizovaný, systematickýpřístup, aby se optimalizovaly šance na úspěšný výsledek; a management lze v konečném důsledku rozdělit do čtyř fází (obrázek 1).
Resuscitace
Resuscitace pacienta s nově diagnostikovanou ECF se řídí mnohými stejnými principy jako resuscitace septických pacientů a zásady kampaně Surviving Sepsis Campaign by měly sloužit jako rámec . Počáteční péče by se měla zaměřit na agresivní resuscitaci tekutin,rychlé posouzení a korekci elektrolytové nerovnováhy a normalizaci laktátové acidózy. Pacienti s ECF jsou běžněhyponatremičtí, hypokalemičtí a acidotičtí v důsledku pokračujících gastrointestinálních ztrát.U pacientů s píštělemi s vysokým výdejem by měly být ztráty tekutin, elektrolytů a bikarbonátů nahrazeny intravenózně, aby se zabránilo dehydrataci a hluboké metabolické nestabilitě během počátečního stabilizačního období. Pečlivé monitorování výdeje moči a cílenénahrazování výtoku z píštěle každých 4 až 8 hodin zabrání pokračujícídehydrataci.
Kontrola zdrojů
Po resuscitaci pacienta by se pozornost měla přesunout na zavedení kontroly zdrojů. Jak již bylo zmíněno, CT vyšetření s kontrastní látkou je nápomocné při identifikaci neodvodněnýchkolonií a abscesů. U pacientů po operaci je kontrola zdroje nejpravděpodobněji provedena intervenční radiologií. V případě nepřístupných kolekcí nebo nekontrolované intraabdominálnísepse však může být operace nevyhnutelná. Široké spektrum empirických nitrožilních antibiotik by nemělo být k léčbě ECF rutinně používáno, pokud není prokázána intraabdominální kolekce nebo infekce rány s přidruženou celulitidou. Kdykoli je to možné, měla by být antibiotika zaměřena na specifické kultivační údaje a omezena na dobu kratší než 2 týdny.
Řízení výpotku
Řízení výpotku při úspěchu může mít významný vlivna objemový stav, elektrolytovou rovnováhu, výživu a integritu kůže.Doplňkový lékařský management výtoku z ECF se tradičnězaměřuje na dvě hlavní oblasti: neutralizaci kyselin a snížení objemu. použití inhibitorů protonové pumpy může dosáhnout obou cílů a dávka by měla být titrována, dokud není pH výtoku vyšší než 6 a objem výtoku menší než 1 l/den . Ačkoli psyllium může být velmi užitečné pro zvětšení objemu výtoku a prodloužení tranzitní doby, antimotilitní a antisekreční látky včetně loperamidu, atropindifenoxylátu, kodeinu, opiové tinktury a dokonce i metadonu jsou základem redukce objemu. Vzhledem k jeho úloze univerzálního inhibitoru gastrointestinálních hormonů bylo provedeno velké množství výzkumů studujících účinky exogenního somatostatinu na pacienty sECF. Navzdory značnému počtu randomizovaných kontrolovaných studií je obtížné objasnit významné závěry, což je dáno malou velikostí vzorků a nejednotným designem studií . Oktreotid, dlouhodobější analog somatostatinu, byl rovněž zkoumán jako doplněk ECF se slibnými výsledky. Oktreotid 100 mcg třikrát denně může snížit objem výtoku a v některých studiích se ukázalo, že zkracuje dobu do spontánního uzávěru . Zkouška léčby oktreotidem po dobu 72 hodin s pečlivým monitorováním výtoku z píštěle tak může být opodstatněná, zejména v případech, kdy jiná léčba nevedla ke snížení objemu výtoku . Mezi běžné nežádoucí účinky patříhyperglykémie, bolesti hlavy a cholelitiáza.
Ačkoli je z údajů zřejmé, že píštěle s nízkým výstupem mají zvýšenou míru spontánního uzavření, je méně jasné, že snížení objemu výstupu zlepší uzavření píštěle. Nicméně snížení objemu výtoku může významně snížit zátěž spojenou se správou píštěle a pozitivně ovlivnit pohodu pacienta.
Péče o rány
Možná jedním z nejnáročnějších a na zdroje náročnějších aspektů správy ECF je lokální kontrola výtoku. Successenterické můžeme rychle rozbít kůži a způsobit podráždění, kteréje obtížné léčit. Proto je nejdůležitější vhodná péče o kůži pomocí bariérových krémů, bariér proti vlhkosti, sáčkových přístrojů a odsávacích zařízení . Zejména píštěle s vysokým výkonem často vyžadují složitou síť drénů, sáčků a odsávaček, aby bylo možné dostatečně kontrolovat výtok. Vysoce specializované týmy pro péči o rány aenterostomální terapeuti jsou neocenitelní jak pro léčbu ran, tak pro pohodlí pacientů .
S všudypřítomným používáním podtlakové terapie (NPT) pro léčbu ran a otevřených břich, není překvapivé, že se NPT stala součástí chirurgického arzenálu pro řešeníECF. V dosud nejrozsáhlejší sérii Wainstein a kol. uvedli své zkušenosti s 91 pacienty s píštělemi s vysokým výdejem léčenými pomocí negativního tlaku v rozmezí -350 až -600 mmHg. Kromě výrazného snížení výtoku z průměrných 1400 cm3/den na 138 cm3/den bylo u 46 % pacientů dosaženo spontánního uzávěru. v roce 2016 Misky et al. publikovali metaanalýzu zkoumající použití NPT u ECF. Na základě deseti retrospektivních studií s celkem 151pacienty tito autoři zjistili, že medián míry spontánního uzávěru byl 65 % (v rozmezí 7-100 %) s mediánem doby do uzávěru 58 dní. Tito badatelé rovněž uvedli, že výskyt nové píštěle činil 4,4 % – což je známá komplikace, která některé lékaře přiměla k zamyšlení.Ačkoli je zjevně nutné další zkoumání, aby se zjistilo, zda NPT může definitivně zlepšit míru uzavření ECF nebo zkrátit dobu do spontánního uzavření, pozitivní přínos těchto obvazů by neměl být přehlížen. Tato technologie může přinejmenším usnadnit management ECF tím, že kontroluje výtok, chrání kůži a snižuje četnost výměny obvazů.
Tabulka 3

| Výzkumní pracovníci | Instituční praxe |
|---|---|
| Hollington | 8 měsíců |
| Evenson | 4 měsíce |
| Rahbour | 12 měsíců |
| Datta | 6 měsíců |
| Lynch | 6 měsíců |
| Li | 6 měsíců |
| Mcintyre | 6 měsíců |
Tabulka 3: Načasování do definitivního řízení.
Tabulka 3
Termín do definitivní léčby.
Výživa
VyhodnoceníVýživový stav pacienta s ECF má zásadní význam. Před příchodem enterálních formulí na bázi peptidůa celkové parenterální výživy (TPN) retrospektivní historické sériezdůrazňují zátěž podvýživy u pacientů s ECF. V sérii157 pacientů z 50. a 60. let 20. století bylo téměř 75 % pacientů sproximálními píštělemi podvyživených. Podobné výsledky uvádíChapman et al., kteří zjistili, že pouze malá část pacientů měla optimální výživu a že po zlepšení výživy klesla úmrtnost související s ECF z 55 % na 12-16 %.
Kompletní nutriční hodnocení by mělo být provedeno u každého pacienta s ECF. Ačkoli Harrisova-Benediktova rovnice poskytuje dobré východisko pro výpočet nutričních požadavků, je všeobecně uznáváno, že pacienti s ECF jsou kataboličtí a hypermetaboličtí.Obecně tito pacienti vyžadují zvýšenou kalorickou podporu s minimálně 25-30 kcal/kg/den v sacharidech a tucích a 1,5 až 2 gramy bílkovin/kg/den .
Výživový stav a pokrok by měly být pravidelně přehodnocovány. Kromě denní hmotnosti by se měly pravidelně sledovat nutriční testy, jako jsou,albumin, prealbum in, transfer a CRP. zejména předoperační albumin se ukázal jako nejsilnější prediktor mortality a morbidity po generální operaci a hypoalbuminemie zůstává významným prediktorem špatných výsledků u pacientů s ECF . Snad nejvíce studovanýmproteinem u ECF je však transferin a jeho hladiny vyšší než 140 byly spojeny se zvýšenou mírou spontánního uzávěru a sníženou mortalitou . Ačkoli dusíková bilance může být užitečným nástrojem, toto standardní měření může být u pacientů s píštělemi s vysokým výdejem obtížné. Ve složitějších případech, které nereagují na standardní péči, lze zvážit další testy, jako je nepřímá kalorimetrie.
Parenterální vs. enterální výživa
Parenterální výživa hrála rozhodující roli v léčbě ECF, přičemž její použití pevně stanovil Dudrick v roce 1969.Ve svém stěžejním článku popisujícím optimální léčbu TPN dospěl Dudrick k závěru, že: Dudrick uvedl, že „při výhradním používání parenterální hyperalimentace se pravidelně dosahuje přírůstku hmotnosti, pozitivní dusíkové bilance, růstu a vývoje“ . Od té doby je TPN všeobecně přijímána jako prostředek k zajištění výživy a zároveň podporuje „střevní klid“ a zjednodušuje hospodaření s odpadními vodami.Zatímco TPN snižuje sekreci trávicího traktu o 30-50 %, čímž snižuje výskyt dehydratace a elektrolytové nerovnováhy, neexistují randomizované studie zabývající se vlivem TPN na anabolickou konverzi, míru spontánního uzávěru nebo úmrtnost. Přesto zůstává TPN oblíbenou dlouhodobou léčebnou metodou, a to i přes závažné komplikace včetně infekce a jaterní dysfunkce.
V poslední době se však stále více prosazuje používání enterální výživy u ECF. Použití enterální výživy má řadu výhod včetně nižších nákladů, menšího počtu infekcí a lepší imunologické funkce ve srovnání s TPN . Navíc i poskytování pouhých 20 % kalorií enterální cestou může pomoci udržet střevní flóru a snížit bakteriální translokaci .
Několik sérií uvádí překvapivý úspěch enterální výživy u pacientů s ECF. V retrospektivní sérii Li et al. bylo 86,4 % z 1168 pacientů účinně zvládnuto pomocí enterální podpory. enterální výživu lze úspěšně použít i v případě píštěle s vysokým výdejem, pokud se kombinuje s elementárními formulemi, antimotilitními látkami a objemovými látkami s vlákninou. V sérii 335 pacientů s píštělí s vysokým výdejem dokázali Levy et al. pomocí enterální výživy úspěšně dosáhnout nezávislosti na TPN u 85 % své kohorty. Je zajímavé,že navzdory enterální výživě a absenci „střevního klidu“ byla mortalita a míra spontánního uzávěru podobná jako u předchozích sérií.
Při vysokém výdeji ECF s distální mukokutánní končetinou může být fistuloklýza důležitým doplňkem standardní enterální výživy. Praxe fistuloklýzy vznikla z praxepodávání chymu u novorozenců a může se týkat buď opětovného podávání výpotku, nebo doplňování další enterální výživy sondou prostřednictvím katétru umístěného v distální končetině ECF. Teubner a kol. poprvé popsalifistuloklýzu jako terapii ECF v roce 2004 v sérii případů dvanácti pacientů s proximálními píštělemi. Od té doby řada kazuistik a malých sérií prokázala nutriční účinnost této techniky . Ve srovnání se srovnatelnou kohortou pacientůpodstupujících TEN bez fistuloklýzy měli pacienti s fistulí s vysokým výdejem léčení fistuloklýzou významně lepší jaterní funkce a nutriční parametry . Fistuloklýza může být zvláště užitečná u pacientů, u kterých se objeví komplikace související s TPN včetně infekcí, problémů s žilním přístupem nebo jaterního selhání. Komplikace se však mohou vyskytnout a mohou zahrnovat obstrukci v případě, že peristaltická aktivita tenkého střeva posune katétr píštěle distálně do tenkého střeva.
Vitamíny a minerály jsou u pacientů s ECF často vyčerpány.Nedostatek vitamínů rozpustných v tucích je běžný, zatímco nedostatek vitamínů rozpustných ve vodě je vzácný, pokud se píštěl nenachází v proximálním jejunu. Kromě toho, protože vitamin B12 se vstřebává pouze v terminálních 50 až 60 cm ilea, může být u mnoha pacientů s ECF nutná injekční aplikace vitaminu B12. Hořčík se u fistulí s vysokým výdejem často ztrácí a měl by být doplněn buď intravenózním síranem hořečnatým, nebo perorálním chloridem hořečnatým pro zlepšení enterální absorpce. V neposlední řadě se doporučuje doplnění vysokých dávek zinku i vitaminuC . Zatímco omega-3 a rybí olej byly studovány v prostředí intenzivní péče s určitým přínosem, tyto doplňky nebyly nikdy hodnoceny u pacientů s ECF a nejsou rutinně používány .
Operativní úvahy
Míra spontánního uzavření ECF se v literatuře pohybuje mezi 15 a75 %. Toto široké rozmezí míry uzávěru pravděpodobně odrážírozdíly v populaci pacientů a institucionální praxi . Pravděpodobnost spontánního uzavření píštělí je výrazně nižší po 4 týdnech, přičemž pouze 10 % píštělí se uzavře po dvou měsících . Vzhledem k tomu, že míra spontánního uzavření ECF je nízká, je chirurgický zákrok často jedinou definitivní strategií řešení.
Rozhodnutí operovat ECF by však nemělo být bráno na lehkou váhu, protože míra recidivy po odstranění ECF se pohybuje od 13 do 34 % . Přestože zásady chirurgického zákroku uECF zahrnují mnoho základních principů všeobecné chirurgie, je čas koperaci pravděpodobně nejdůležitějším faktorem, který je třeba zvážit. Fazio a kol. prokázali význam očekávaného postupu při péči o pacienty s ECF. Pokud k operaci došlo za méně než 6 týdnů od vzniku ECF, mortalita přesahovala 20 %. Při odložení operace o více než 6 týdnů však mortalita klesla na 11 %. navíc časná operace pravděpodobně vede ke zvýšení rizika recidivy. V sérii Lynche a kol. byla u pacientů operovaných mezi 2. a 12. týdnem od vzniku ECF míra recidivy 28 %, zatímco odklad delší než 12 týdnů snížil tuto míru na 15 % . Tabulka 3 ukazujedélku doby, kterou odborní autoři doporučují vyčkat před zvážením operačního zákroku u nehojící se ECF.
Operační léčba by měla být prováděna pouze s plnouinvesticí a pochopením pacienta i chirurga. Uzávěry ECF jsou dlouhé, technicky náročné případy s rizikem významných komplikací. Operace často vyžadují úplnou mobilizaci střeva od Treitzova vazu až po konečník.Vzhledem k tomu, že 36 % recidivujících píštělí je důsledkem poranění vzniklýchpři operaci uzávěru ECF, je třeba věnovat velkou pozornost po celou dobu lýzy srůstů, aby nedošlo k neúmyslnému poranění zdravého střeva. Řešení píštěle by mělo vždy zahrnovat resekci střeva a primární astomózu. Nadměrné šití nebo okrajová resekce píštěle má vždy za následek vyšší recidivu (36 % vs. 16 %) .
Závěr
Enterokutánní píštěl je jednou z nejnáročnějšíchkomplikací, kterým čelí všeobecný chirurg. Využití pečlivého,systematického a na pacienta zaměřeného přístupu pomůže maximalizovat úspěšné klinické výsledky. Navzdory konzistentnosti zásad managementu ECF u všech pacientů je každá píštěl jedinečná a její management je z velké části definován jejím výstupem, stejně jako její lokalizací a komorbiditami pacienta. Zkušenosti jednotlivých chirurgů a institucí podtrhují význam opožděného zásahu. ačkoli chirurgové i pacienti mohou mít silnou touhu přistoupit k chirurgickému uzávěru, pacientům nejlépe poslouží alespoň šestiměsíční neoperativní léčba. Nakonec dlouhodobá péče o pacienty s ECF vyžaduje, multidisciplinární často koordinovanou chirurgy.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Jedenáctileté zkušenosti s enterokutánní píštělí. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Management enterokutánních píštělí: Třicetileté klinické zkušenosti. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: A review of 132 cases: A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Přehled 404 pacientů s gastrointestinálními píštělemi. Vliv parenterální výživy. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of the validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimalizace léčby horních gastrointestinálních píštělí. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Výživa a léčba enterokutánní píštěle. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Klasifikace a patofyziologie enterokutánních píštělí. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Patofyziologie enterokutánních píštělí. World J Surg. 1983;7:446-50.
- Draus JM, Jr, Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterokutánní píštěle: zlepšuje se léčba? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematický management pooperačních enterokutánních píštělí: faktory související s výsledky. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Multivariační model pro stanovení prognostických faktorů u gastrointestinálních píštělí. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the thin bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historické perspektivy v péči o pacienty s enterokutánní píštělí. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutaneous fistula complicating trauma laparotomy: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years‘ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterokutánní píštěle: osvědčené strategie a aktualizace. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Current management of enterocutaneous fistula (Současný management enterokutánní píštěle). Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas [Management střevních píštělí]. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role somatostatinu-14 a jeho analogů v léčbě gastrointestinálních píštělí: klinické údaje. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. Desetiletá zkušenost. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr, Williams GM, Welch CE. Zevní píštěle vycházející z gastrointestinálního traktu. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metabolická a nutriční podpora pacienta s enterokutánní píštělí: třífázový přístup. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Předoperační hladina sérového albuminu jako prediktor operační mortality a morbidity: výsledky studie National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Faktory predikující recidivu a mortalitu po chirurgickém řešení enterokutánní píštěle. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Může intravenózní výživa jako jediný prostředek výživy podpořit růst u dítěte a obnovit úbytek hmotnosti u dospělého? Kladná odpověď. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloklýza může úspěšně nahradit parenterální výživu při nutriční podpoře pacientů s enterokutánní píštělí. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloklýza: kazuistika a přehled literatury. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloklýza zlepšuje jaterní funkce a nutriční stav u pacientů s vysoce výkonnou horní střevní píštělí. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Management enterokutánních píštělí. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Chirurgická léčba enterokutánních píštělí s vysokým výdejem: 24leté zkušenosti. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative surgery for enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Klinický výsledek a faktory predikující recidivu po operaci enterokutánní píštěle. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Management zevních gastrointestinálních píštělí. Ann Surg. 1978;188:460-7.
.