Azidový iont:
Azidový ion (N3- ) je jednou z těch chemických entit, které prostě vypadají divně.

- Tři nitrogeny za sebou? check
- Dva záporné náboje a kladný náboj, pro čistý náboj -1 ? check
- Stabilní? check (pokud se s ním zachází šetrně).
Jak se ukázalo, azidový iont může být mimořádně užitečný pro tvorbu vazeb C-N v nukleofilních substitučních reakcích.
Obsah
- Azidový iont je skvělý nukleofil
- Organické azidy jako „maskované“ aminy
- Exploze na odpalovací zařízení
- Nukleofilní acylsubstituce s azidovými solemi: Acyl azidy
- Zpětné uspořádání acyl azidů:
- Další příklady azidových nukleofilů: Curtiova přeskupení
- Další příklady azidových nukleofilů: Azidový ion je skvělým nukleofilem v SN2 reakcích
- Poznámky
- (pro pokročilé) Odkazy a další literatura
- 1. Azidový ion je skvělým nukleofilem v SN2 reakcích
- 2. Organické azidy, které se vyskytují v prostředí, kde se vyskytují, jsou velmi užitečné. Organické azidy jako „maskované aminy“
- Výbuch na odpalovací rampě
- 4. Nukleofilní acylová substituce s azidovými solemi vytváří acyl azidy
- 5. Nukleofilní acyl substituce. Přepracování acyl azidů: Nejběžnější použití acyl azidů spočívá v tom, že se po zahřátí přeskupí za vzniku isokyanátů v reakci známé jako Curtiova přeskupení.
- Další příklady azidových nukleofilů: Další dvě aplikace azidového iontu jako nukleofilu zahrnují otevírání epoxidů (v podstatě SN2 procesem – všimněte si inverze konfigurace) a také konjugovanou adici na alfa,beta nenasycené ketony:
- Poznámky
- (pro pokročilé) Odkazy a další literatura
1. Azidový ion je skvělým nukleofilem v SN2 reakcích
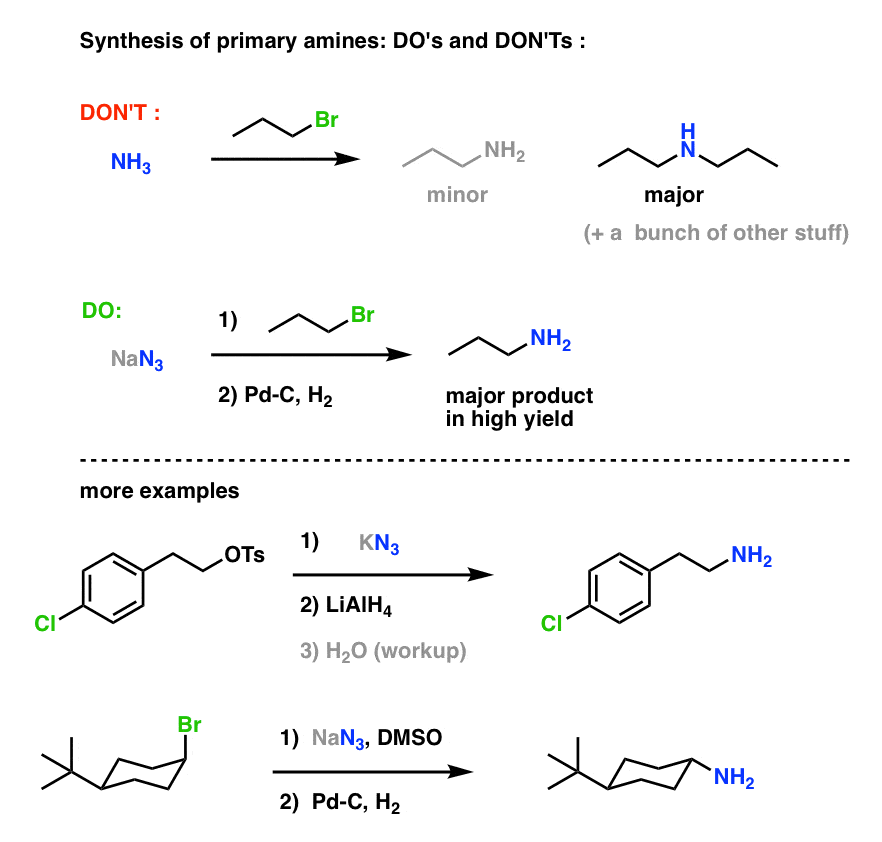
Azidový ion je konjugovanou bází kyseliny hydrazoové, HN3. Přestože je N3 jen slabě bazický (pKa HN3 je pouze 4,6), je mimořádně dobrým nukleofilem – podle jednoho měřítka je nukleofilnější než jakýkoli amin (viz příspěvek: Nukleofilita aminů). Když se nad tím zamyslíte, není těžké pochopit, proč tomu tak je. Se čtyřmi nukleofilními osamělými páry omezenými na velmi malý objem je pravděpodobnost srážky s elektrofilem, která vyústí v reakci, mnohem vyšší než u aminu s objemnými alkylovými skupinami, abychom uvedli jen jeden příklad.
N3- si můžete představit jako štíhlou, průměrnou raketu s dusíkovou špičkou, která dopraví svůj náklad na uhlík rychle, účinně a bez významných vedlejších reakcí.
Při SN2 reakcích jsou primární a sekundární alkylhalogenidy a sulfonáty snadno vytěsňovány N3- , čímž vznikají alkyl azidy:
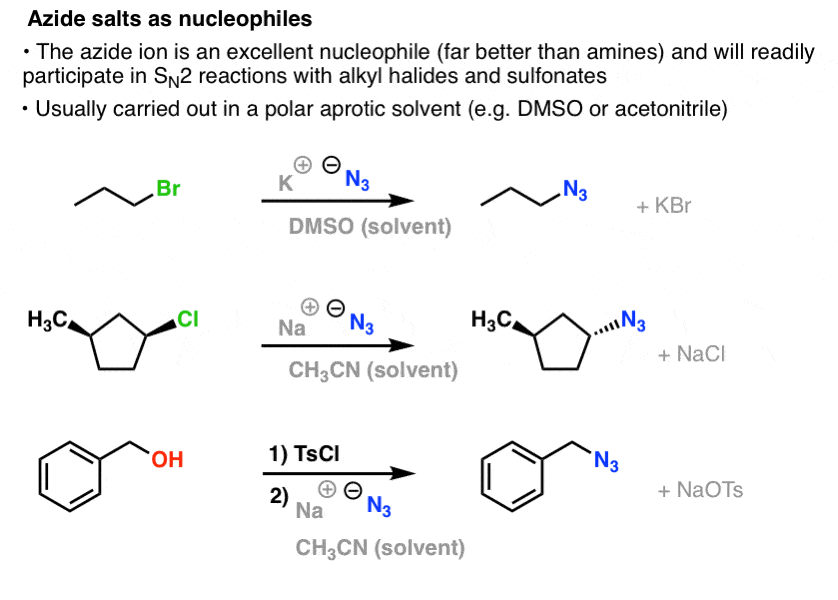
Obvyklým postupem je použití azidové soli, jako je NaN3 nebo KN3 s příslušným alkylhalogenidem v polárním aprotickém rozpouštědle, jako je acetonitril (CH3CN) nebo dimethylsulfoxid (DMSO).
Organické azidové produkty jsou poměrně stabilní, i když vypadají trochu divně. Některé z nich dokonce našly využití jako léčiva (např. AZT, níže vpravo) nebo jako užitečné sondy pro studium chemické biologie. .
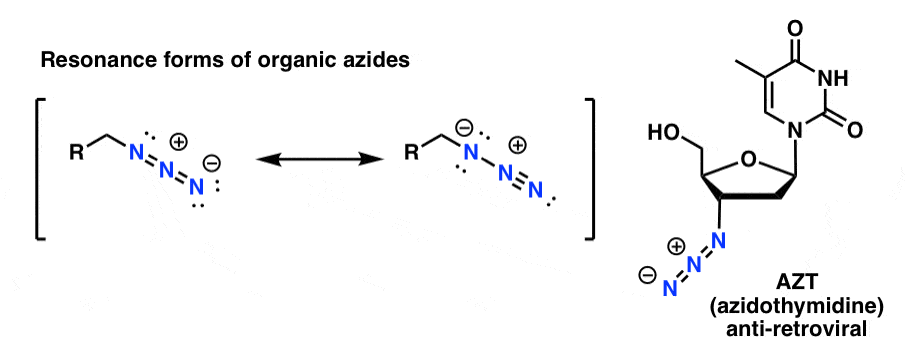
Pro naše účely je nejužitečnější vlastností organických azidů to, že slouží jako „maskované“ aminy.
2. Organické azidy, které se vyskytují v prostředí, kde se vyskytují, jsou velmi užitečné. Organické azidy jako „maskované aminy“
Všimněte si výše uvedené rezonanční formy s trojnou vazbou dusík-dusík. Pokud se na organické azidy působí redukčním činidlem, jako je LiAlH4, nebo dokonce katalytickou hydrogenací (Pd/C , H2), lze je redukovat na primární aminy, přičemž se při tom uvolňuje N2.
To představuje velmi užitečnou cestu k primárním aminům z alkylhalogenidů!
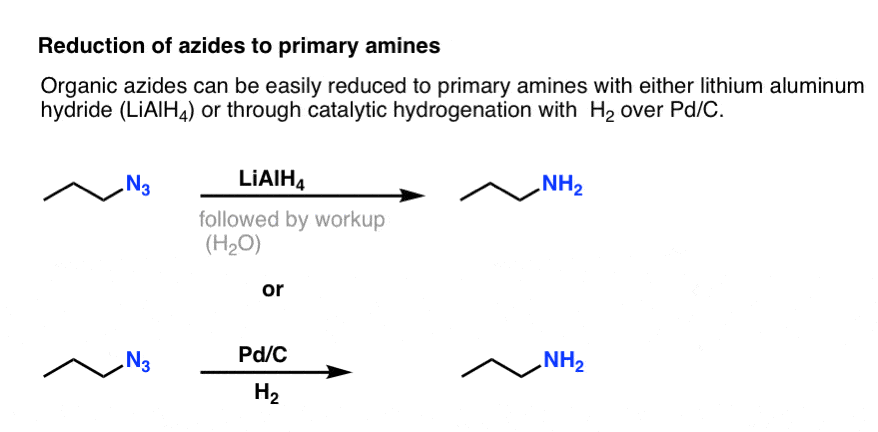
Již dříve jsme zkoumali Gabrielovu syntézu jako cestu k primárním aminům , ale tato cesta je lepší, protože azid lze redukovat na amin za šetrných podmínek (např. hydrogenací). Žádného vysokoteplotního štěpení ftalimidu hydrazinem se nemusíme obávat.
Viděli jsme také, že výroba primárních aminů přímou úpravou alkylhalogenidů NH3 často nevede k požadovanému produktu, protože aminy mají podobnou tendenci jako Cookie-Monster reagovat s alkylhalogenidy vícekrát: protože produkty aminů bývají nukleofilnější než reaktanty, je těžké přimět aminy, aby se zastavily u přežvykování pouze jednoho alkylhalogenidu.
Výbuch na odpalovací rampě
Jestliže je N3 „raketou s dusíkovou špičkou“, jak jsme komentovali výše, stojí za to připomenout, co se stane, když se s raketou nezachází opatrně: je to v podstatě bomba.
NaN3 a KN3 jsou bílé prášky, které lze neomezeně dlouho skladovat při pokojové teplotě a bez problémů je nabírat na stole.
Ale když se zahřejí nebo jsou vystaveny nárazu – vše je v háji. Totéž platí pro vystavení těchto azidových solí působení kyseliny, při kterém vzniká potenciálně výbušný HN3.
A NaN3 a KN3 jsou pěkné azidy! Pokud se smíchají se solemi kovů olova, rtuti, kadmia, zinku nebo stříbra, mohou vzniknout ještě výbušnější azidové sloučeniny. Tyto azidy kovů jsou kontaktní výbušniny, z nichž některé jsou tak citlivé, že vybuchnou, když si někdo prdne o dvacet metrů dál na chodbě. Někteří blázniví chemici je dokonce vyrábějí záměrně, ale my se na tomto blogu nikdy a nikde nebudeme pohybovat v blízkosti poloměru výbuchu tohoto tématu.
NaN3 a KN3 by se měly používat v přiměřeně zředěných koncentracích, za výbuchovým štítem v preparativním měřítku a mimochodem nikdy by se neměly používat s rozpouštědlem CH2Cl2, které může vést k vysoce výbušnému diazidomethanu.
No a jsou chvíle, kdy je náhlý výbuch plynného dusíku užitečný – a potenciálně život zachraňující. Možná jste již strávili část dne v těsné blízkosti azidu sodného, aniž byste si to uvědomili. To proto, že NaN3 je jedním z několika hnacích plynů, které nacházejí uplatnění v airbagu; po spuštění akcelerometrem detonace NaN3 vymrští plyn N2 rychlostí přes 200 km/h a nafoukne vak během 1/25 sekundy.
Jay for azide salts!
via GIPHY
(But don’t be this guy):
via GIPHY
Bottom line: SN2 reakce mezi alkylhalogenidy nebo sulfonáty s azidy jsou pravděpodobně jediným nejlepším způsobem syntézy primárních aminů z alkylhalogenidů. Rozhodně je to lepší než Gabrielova syntéza.
4. Nukleofilní acylová substituce s azidovými solemi vytváří acyl azidy
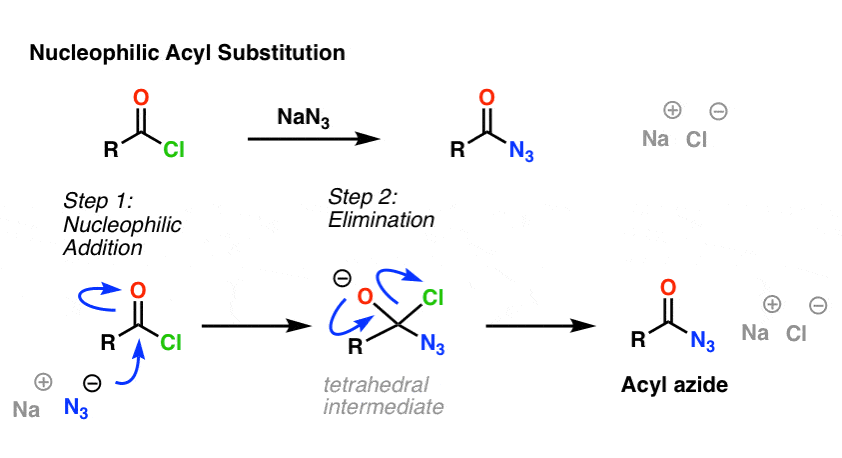
Reakce SN2 není jediným typem substituční reakce, který jsme zkoumali. Existuje také nukleofilní acylová substituce. Karbonyl navázaný na dobrou odstupující skupinu (např. chlorid nebo anhydrid kyseliny) projde substitucí po přidání vhodného nukleofilu.
V prvním kroku mechanismu nukleofil (Nu) napadne karbonylový uhlík, čímž vznikne C-Nu a přeruší se C-O (pi). Tím vzniká tetraedrický meziprodukt. Ve druhém kroku se znovu vytvoří vazba C-O pi a přeruší se vazba uhlík-(odcházející skupina), čímž vznikne produkt nukleofilní acylové substituce.
Uveďme si příklad reakce nukleofilní acylové substituce mezi chloridem kyseliny a iontem N3 za vzniku acyl azidu:
5. Nukleofilní acyl substituce. Přepracování acyl azidů: Nejběžnější použití acyl azidů spočívá v tom, že se po zahřátí přeskupí za vzniku isokyanátů v reakci známé jako Curtiova přeskupení.
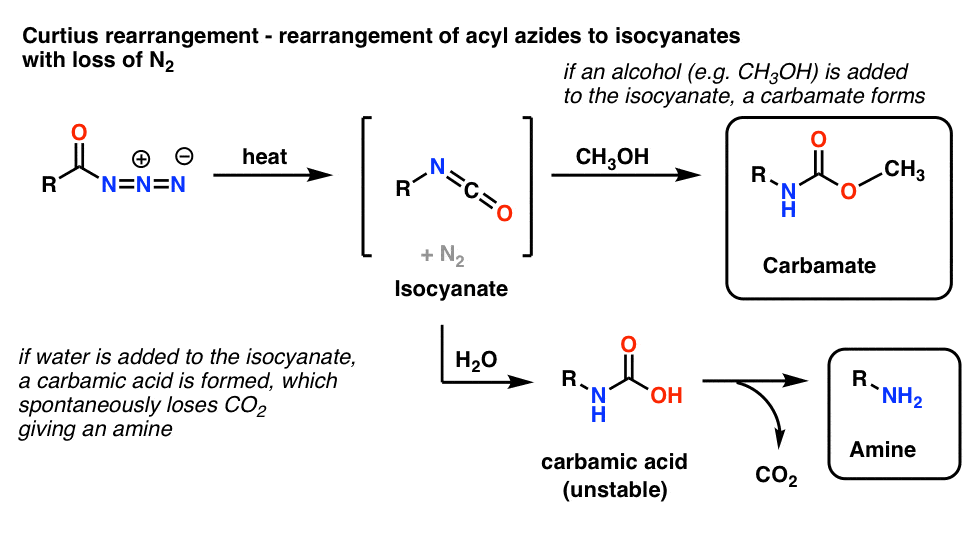
- Pokud se Curtiusova reakce provádí v přítomnosti alkoholu, například methanolu, vzniká karbamát.
- Pokud se místo toho přidá voda, vzniká krátce nestabilní kyselina karbamová, která pak ztrácí oxid uhličitý za vzniku primárního aminu.
Proč by to mohlo být užitečné? Zde je jeden ze způsobů.
Existuje mnoho metod pro výrobu aromatických karboxylových kyselin, ale ne tolik skvělých způsobů, jak vytvořit vazby C-N na aromatických kruzích. Řekněme, že máte kyselinu benzoovou (například kyselinu p-methylbenzoovou), ale potřebujete vytvořit (chráněný) aromatický amin. Curtiův protokol představuje pěkný způsob, jak vytvořit novou vazbu C-N na kruhu, aniž byste se museli uchýlit k nitraci + redukci.
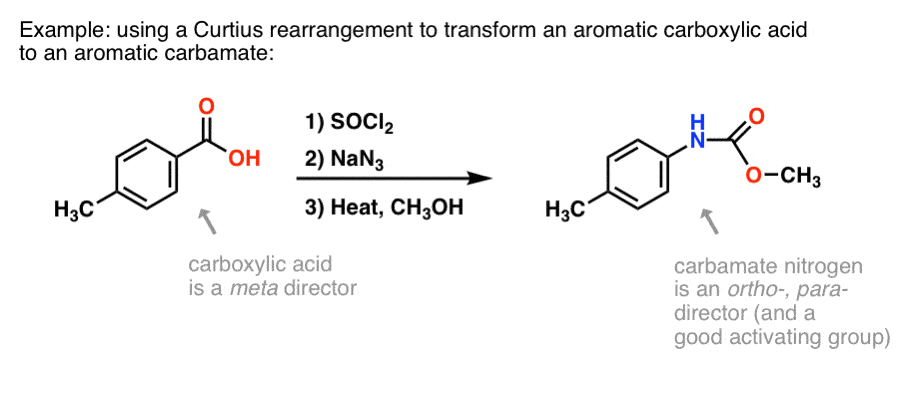
(V tomto směru je to do jisté míry analogický ekvivalent Baeyerovy-Villigerovy oxidace dusíku. )
Další příklady azidových nukleofilů: Další dvě aplikace azidového iontu jako nukleofilu zahrnují otevírání epoxidů (v podstatě SN2 procesem – všimněte si inverze konfigurace) a také konjugovanou adici na alfa,beta nenasycené ketony:
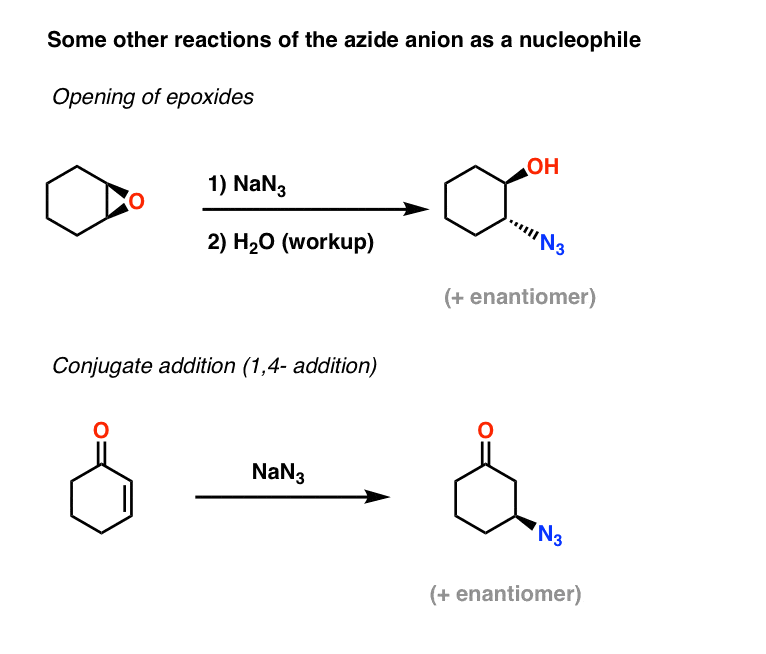
Vzniklé alkyl azidy lze poté redukovat na primární aminy výše popsanými metodami.
Poznámky
Poznámka pod čarou: Azid-alkynové cykloadice, tzv. „Click“ chemie
Zajímavou a užitečnou aplikací organických azidů, která se zatím nedostala do úvodních učebnic organické chemie (ale pravděpodobně se tak stane v blízké budoucnosti), je proces odborně nazývaný „mědí katalyzovaná azido-alkynová cykloadice“, ale častěji se nazývá pouze „alkyn-azidová click reakce“.
Pokud je terminální alkyn zpracován měděným katalyzátorem v přítomnosti organického azidu, dochází k rychlé cykloadici, která vede ke vzniku 1,2,3-triazolu.
Nebudeme zabíhat do podrobností, ale tato reakce tvorby kruhu zahrnuje 6 elektronů pí a je příbuzná Dielsově-Alderově reakci (hnidopichové správně poznamenají, že verze katalyzovaná mědí není technicky vzato sladěný proces, ale nekatalyzovaná verze ano)
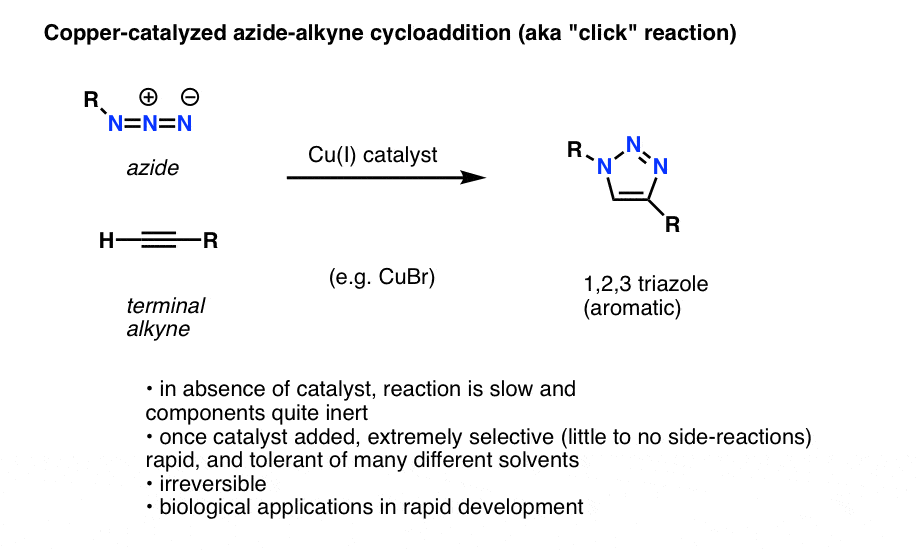
Reakce je pozoruhodná z několika důvodů:
- reaktivní partneři (terminální alkyn a organický azid) jsou za většiny podmínek bez katalyzátoru relativně inertní.
- po přidání mědi probíhá reakce extrémně rychle za mírných podmínek a v různých rozpouštědlech (včetně vody).
- za těchto podmínek je extrémně selektivní,alkynový a azidový partner reagují pouze mezi sebou, nevratně.
- produkt, triazolový kruh, je aromatický a stabilní
Jedním z jejích původců, Barrym Sharplessem, byla nazvána „click“ reakcí, protože je to jedna z nejbližších věcí, které mají chemici k dispozici, reakce, která se podobá plynulému „zaklapnutí“ dvou komplementárních kostek lega.
V poslední době je tato reakce obzvláště užitečná tím, že azidové a alkynové partnery lze instalovat do molekul biologického zájmu a v případě potřeby je „zacvaknout“ dohromady.
Například:
- Položení acetylenu na 5′ pozici cukru a azidu na 3′ pozici bylo použito k vytvoření „zacvaknuté“ DNA, kde triazol nahrazuje organofosfát.
- Je neuvěřitelné, že jedna skupina vytvořila „kliknutou“ DNA, vložila ji do lidských buněk a dokázala ji přepsat pomocí messengerové RNA.
- AZT s obsahem azidu (výše) funguje tak, že zahlcuje transkripční mechanismus. Někteří chytří lidé našli způsob, jak použít azido-alkynovou klikací reakci směrem k rychlému sekvenování genomu, technice známé jako ClickSeq.
Takata používala na počátku 90. let azid sodný, pak přešla na tetrazol a následně na dusičnan amonný.
Z knihy „Sixty Million Car Bombs:
Dusičnan amonný byl podle Uphama, který také zkoumal průmyslové patenty, asi o desetinu levnější než tetrazol. Dusičnan amonný však měl kritickou vadu, která podle něj vedla ostatní výrobce airbagů k tomu, že od něj upustili: Dusičnan amonný má pět fází s různou hustotou, což ztěžuje jeho dlouhodobou stabilitu. Hnací plyn vyrobený z dusičnanu amonného by při změnách teploty bobtnal a smršťoval se a nakonec by se tableta rozpadla na prášek. Voda a vlhkost by tento proces urychlily. Prášek hoří rychleji než tableta, takže vzduchový vak, jehož hnací látka se rozpadla, by se pravděpodobně rozvinul příliš agresivně. Řízený výbuch by byl jen výbuchem. „Všichni se vydali určitou cestou a pouze Takata se vydala jinou cestou,“ říká Jochen Siebert, který sleduje odvětví airbagů od 90. let a nyní je výkonným ředitelem společnosti JSC Automotive Consulting. „Když si přečtete tehdejší konferenční příspěvky, můžete skutečně vidět, že lidé říkali: ‚Ne, to byste neměli. Je to nebezpečné.‘ “
Střepiny z vadných airbagů zabily po celém světě 13 lidí a více než 100 jich zranily.
Dne 25. června 2017, kdy Takata čelila závazkům ve výši více než 11 miliard dolarů, vyhlásila bankrot.
Syntéza primárních aminů „Co dělat a nedělat“ :
(pro pokročilé) Odkazy a další literatura
Azidy jsou užitečné v organické syntéze a upozornění na azidovou chemii je uvedeno v níže uvedených odkazech.
- Nucleophilic reactivity of the azide ion in various solvents
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, Mnichov, Německo) celou svou kariéru přispíval k rozvoji základní fyzikální organické chemie kvantifikací elektrofilnosti a nukleofilnosti a vývojem stupnic pro porovnávání reaktivity různých nukleofilů a elektrofilů. - The SN2 displacements at 2-norbornyl brosylates
Klaus Banert and Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nukleosidy, nukleotidy & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azidy lze použít jako nukleofily v SN2 reakcích. Ref. #3 ukazuje použití azidového iontu při syntéze AZT (azidothymidinu). Konverze 1 na 5 přes 3 v ref. #3 využívá Mitsunobuovu reakci, která umožňuje vytěsnění -OH skupiny nukleofilem s inverzí konfigurace. - Redukce organických azidů na primární aminy hydridem lithno-hlinitým
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Redukce organických azidů na primární aminy je vhodnou metodou pro syntézu primárních aminů, které je jinak obtížné selektivně syntetizovat standardními metodami. - Výbušná citlivost kovových azidů na náraz
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
An investigation of shock sensitivity of NaN3, TlN3, and Pb(N3)2. - The Curtius Reaction
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Starší, ale obsáhlý přehled Curtiovy reakce, který zahrnuje historii objevu této přestavby, rozsah substrátů, omezení, srovnání s jinými podobnými reakcemi a experimentální postupy. - Syntetické metody a reakce. 121. Příprava aroyl azidů katalyzovaná jodidem zinečnatým z aroyl chloridů a trimethylsilyl azidu
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi a George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Vhodný postup přípravy aromatických aryl azidů od nositele Nobelovy ceny prof. Ty pak lze použít pro Curtiovo uspořádání.
Otvírání epoxidů a konjugovaná adice:
- CYKLOHEXEN IMIN (7-AZA-BICYKLOHEPTAN)
Iain D. G. Watson, Nicholas Afagh a Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Tento postup je obzvláště užitečný, protože jde o Staudingerovu reakci pro přeměnu epoxidů na NH-aziridiny (dusíkaté analogy epoxidů). Syntéza může být složitá, ale je zde uvedeno mnoho podrobností, takže ji lze reprodukovat, jak se hodí na postup v Organic Syntheses. - Aminem katalyzovaná adice azidového iontu na α,β-nenasycené karbonylové sloučeniny
David J. Guerin, Thomas E. Horstmann a Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Tato práce je zajímavá tím, že představuje ranou formu nebo organokatalýzy a pravděpodobně probíhá přes meziprodukt iminu nebo iminiového iontu. Bohužel tento termín není v článku nikde použit – tito autoři mohli profesora MacMillana předběhnout!“ - Click Chemistry:
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Cykloadici azidů s alkyny katalyzovanou Cu nazval nositel Nobelovy ceny prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) díky její jednoduchosti, vysokým výtěžkům, rychlé kinetice a kompatibilitě s širokou škálou podmínek a substrátů. Reakce bez Cu jsou rovněž možné, pokud se použijí napjaté alkyny (např. cyklooktyny).
.