Generický název: naftifin-hydrochlorid
Dávkovací forma: gel
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 1. dubna 2020.
- Přehled
- Nežádoucí účinky
- Dávkování
- Odborné
- Těhotenství
- Další
- Indikace a léčba Použití pro Naftin gel
- Dávkování a způsob podání přípravku Naftin Gel
- Dávkovací formy a síly
- Kontraindikace
- Upozornění a opatření
- Lokální nežádoucí účinky
- Nežádoucí účinky
- Zkušenosti z klinických studií
- Postmarketingové zkušenosti
- POUŽITÍ U ZVLÁŠTNÍCH POPULACÍ
- Těhotenství
- Kojení
- Pediatrické použití
- Geriatrické použití
- Naftin gel Popis
- Naftin gel – klinická farmakologie
- Mechanismus účinku
- Farmakodynamika
- Farmakokinetika
- Mikrobiologie
- Neklinická toxikologie
- Karcinogeneze, mutageneze, Poškození plodnosti
- Klinické studie
- Způsob dodání/skladování a zacházení s ním
- Informace pro pacienty
- ZÁKLADNÍ DISPLEJ – 45g tuba karton
- PŘÍPRAVEK NA OPLACHOVÁNÍ – 60 g krabička s tubou
- Další informace o přípravku Naftin (naftifin topical)
- Zdroje pro spotřebitele
- Odborné zdroje
- Ostatní přípravky
- Související léčebné příručky
Indikace a léčba Použití pro Naftin gel
NAFTIN ® gel je allylaminové antimykotikum indikované k léčbě meziprstních tinea pedis způsobených organismy Trichophyton rubrum, Trichophyton mentagrophytes a Epidermophyton floccosum.
Dávkování a způsob podání přípravku Naftin Gel
Nanášejte tenkou vrstvu přípravku NAFTIN ® Gel jednou denně na postižená místa plus přibližně ½ cm okraj zdravé okolní kůže po dobu 2 týdnů.
Pouze k lokálnímu použití. NAFTIN ® Gel není určen k oftalmologickému, perorálnímu ani intravaginálnímu použití.
Dávkovací formy a síly
Gel, 2%. Každý gram obsahuje 20 mg naftifin-hydrochloridu v bezbarvém až žlutém gelu.
Kontraindikace
Žádné.
Upozornění a opatření
Lokální nežádoucí účinky
Pokud se při používání přípravku NAFTIN ® Gel objeví podráždění nebo přecitlivělost, je třeba léčbu přerušit.
Nežádoucí účinky
Zkušenosti z klinických studií
Protože klinické studie probíhají za velmi rozdílných podmínek, nelze výskyt nežádoucích účinků pozorovaných v klinických studiích léčivého přípravku přímo srovnávat s výskytem v klinických studiích jiného léčivého přípravku a nemusí odrážet výskyt pozorovaný v klinické praxi.
Ve dvou randomizovaných, vehikulem kontrolovaných studiích bylo 1143 subjektů léčeno přípravkem NAFTIN ® Gel oproti 571 subjektům léčeným vehikulem. Účastníci studie byli ve věku 12 až 92 let, byli to převážně muži (76 %) a 59 % bělochů, 38 % černochů nebo Afroameričanů a 23 % Hispánců nebo Latinoameričanů. Subjekty dostávaly dávky jednou denně, lokálně, po dobu 2 týdnů tak, aby pokryly postižené oblasti kůže plus ½ palcový okraj okolní zdravé kůže. Nejčastějšími nežádoucími účinky byly reakce v místě aplikace, které se vyskytovaly ve 2 % v rameni s gelem Naftin oproti 1 % v rameni s vehikulem. Většina nežádoucích reakcí byla mírné závažnosti.
V otevřené pediatrické farmakokinetické a bezpečnostní studii dostávalo 22 pediatrických subjektů ve věku 12-17 let s interdigitální tinea pedis NAFTIN® Gel. Výskyt nežádoucích účinků u pediatrické populace byl podobný jako u dospělé populace.
Testování kumulativní dráždivosti odhalilo potenciál přípravku NAFTIN ® Gel způsobovat podráždění. Nebylo prokázáno, že by NAFTIN ® Gel způsoboval kontaktní senzibilizaci, fototoxicitu nebo fotoalergenitu u zdravé kůže.
Postmarketingové zkušenosti
Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich četnost nebo stanovit příčinnou souvislost s expozicí léčivu. Během poregistračního užívání naftifin-hydrochloridu byly zjištěny následující nežádoucí reakce: puchýře, pocit pálení, krusty, suchost, erytém/červenání, zánět, podráždění, macerace, bolest, pruritus/svědění, vyrážka a otok.
POUŽITÍ U ZVLÁŠTNÍCH POPULACÍ
Těhotenství
Souhrn rizik
Nejsou k dispozici žádné údaje o použití přípravku NAFTIN® Gel u těhotných žen, které by umožnily vyhodnotit riziko závažných vrozených vad, potratu nebo nežádoucích účinků na matku nebo plod spojené s užíváním přípravku.
V reprodukčních studiích na zvířatech nebyly pozorovány žádné nežádoucí účinky na vývoj embrya u perorálních dávek podávaných v období organogeneze až do 37násobku maximální doporučené dávky pro člověka (MRHD) u březích potkanů nebo subkutánních dávek podávaných v období organogeneze až do 4násobku MRHD u březích potkanů nebo 7násobku MRHD u březích králíků ( viz údaje).
Všechna těhotenství mají v pozadí riziko vrozených vad, ztrát nebo jiných nežádoucích výsledků. Odhadované pozadí rizika závažných vrozených vad a potratů pro uvedenou populaci není známo. V obecné populaci USA je odhadované riziko pozadí závažných vrozených vad a potratu u klinicky rozpoznaných těhotenství 2 až 4 %, resp. 15 až 20 %.
Údaje
Údaje o zvířatech
Systematické studie embryofetálního vývoje byly provedeny na potkanech a králících. Pro porovnání dávek u zvířat s dávkami u lidí je MRHD stanovena na 4 g 2% gelu denně (1,33 mg/kg/den pro jedince o hmotnosti 60 kg).
Březím samicím potkanů byly v období organogeneze podávány orální dávky 30, 100 a 300 mg/kg/den naftifin-hydrochloridu. Při dávkách do 300 mg/kg/den (37násobek MRHD na základě srovnání mg/m 2) nebyly zaznamenány žádné účinky související s léčbou na embryofetální toxicitu. Podkožní dávky 10 a 30 mg/kg/den naftifin-hydrochloridu byly podávány v období organogeneze březím samicím potkanů. Při dávce 30 mg/kg/den (4násobek MRHD na základě srovnání mg/m 2) nebyly zaznamenány žádné účinky související s léčbou na embryofetální toxicitu. Podkožní dávky 3, 10 a 30 mg/kg/den naftifin-hydrochloridu byly podávány v období organogeneze březím samicím králíků. Při dávce 30 mg/kg/den (7násobek MRHD na základě srovnání mg/m 2) nebyly zaznamenány žádné účinky související s léčbou na embryofetální toxicitu.
Byla provedena studie peri- a postnatálního vývoje u potkanů. Perorální dávky 30, 100 a 300 mg/kg/den naftifin-hydrochloridu byly podávány samicím potkanů od 14. dne gestace do 21. dne laktace. Při dávce 300 mg/kg/den (37násobek MRHD na základě srovnání mg/m 2) byl zaznamenán snížený přírůstek tělesné hmotnosti samic během březosti a potomků během laktace. Při dávce 100 mg/kg/den (12násobek MRHD na základě srovnání mg/m 2) nebyla zaznamenána žádná vývojová toxicita.
Kojení
Souhrn rizik
Nejsou k dispozici žádné informace o přítomnosti naftifin-hydrochloridu v lidském mléce, o účincích přípravku na kojené dítě ani o účincích přípravku na tvorbu mléka po lokální aplikaci přípravku Naftin Gel kojícím ženám. Není známo, zda se naftifin-hydrochlorid vylučuje do lidského mléka. Protože se do lidského mléka vylučuje mnoho léčivých přípravků, je třeba při podávání naftifin-hydrochloridu kojícím ženám postupovat opatrně.
Nedostatek klinických údajů během kojení vylučuje jednoznačné určení rizika přípravku Naftin Gel pro kojence během kojení. Proto je třeba zvážit vývojový a zdravotní přínos kojení spolu s klinickou potřebou matky podávat přípravek Naftin Gel a případné nežádoucí účinky přípravku Naftin Gel nebo základního onemocnění matky na kojené dítě.
Pediatrické použití
Bezpečnost a účinnost přípravku NAFTIN® Gel byla stanovena u věkové skupiny 12 až 18 let s interdigitální tinea pedis.
Použití přípravku NAFTIN® Gel v této věkové skupině je podpořeno důkazy z adekvátních a dobře kontrolovaných studií u dospělých s dalšími údaji o bezpečnosti a PK z otevřené studie, provedené u 22 dospívajících ve věku ≥ 12 let, kteří byli vystaveni přípravku NAFTIN® Gel v dávce přibližně 4 g/den .
Bezpečnost a účinnost u pediatrických pacientů ve věku <12 let nebyla stanovena.
Geriatrické použití
Během klinických studií bylo přípravku NAFTIN® Gel vystaveno 99 subjektů (9 %) ve věku 65 let a více. Bezpečnost a účinnost byly podobné jako u mladších subjektů.
Naftin gel Popis
NAFTIN ® gel je čirý až žlutý gel pouze k lokálnímu použití. Každý gram přípravku NAFTIN ® Gel obsahuje 20 mg naftifin-hydrochloridu, syntetické allylaminové antimykotické sloučeniny.
Chemicky je naftifin HCl (E)-N-Cinnamyl-N-methyl-1-naftalenemethylamin-hydrochlorid.
Molekulární vzorec je C 21H 21N∙HCl s molekulovou hmotností 323,86. Naftifin HCl je syntetická antimykotická sloučenina.
Strukturní vzorec naftifin-hydrochloridu je :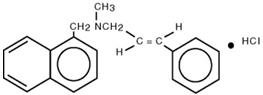
NAFTIN ® Gel obsahuje tyto neúčinné látky: alkohol, benzylalkohol, edetát disodný, hydroxyethylcelulosa, čištěná voda, propylenglykol, polysorbát 20 a trolamin.
Naftin gel – klinická farmakologie
Mechanismus účinku
NAFTIN ® Gel je lokální antimykotikum .
Farmakodynamika
Farmakodynamika přípravku NAFTIN ® Gel nebyla stanovena .
Farmakokinetika
Studie biologické dostupnosti in vitro a in vivo prokázaly, že naftifin proniká do stratum corneum v dostatečné koncentraci, aby inhiboval růst dermatofytů.
Farmakokinetická analýza vzorků plazmy od 32 subjektů s tinea pedis léčených průměrnou dávkou 3,9 g přípravku NAFTIN® Gel aplikovanou jednou denně na obě chodidla po dobu 14 dnů prokázala zvýšenou expozici v průběhu léčby, přičemž geometrický průměr (CV%) AUC 0-24 (plocha pod křivkou plazmatické koncentrace vůči času od času 0 do 24 hodin) činil 10,5 (118) ng∙hr/ml v 1. den a AUC 0-24 70 (59) ng∙hr/ml ve 14. den. Poměr akumulace na základě AUC byl přibližně 6.
Maximální koncentrace (C max) se v průběhu léčby také zvyšovala; geometrický průměr (CV%) C max po podání jedné dávky byl 0,9 (92) ng/ml v den 1; C max v den 14 byla 3,7 (64) ng/ml. Medián T max byl 20,0 hodin (rozmezí: 8, 20 hodin) po jednorázové aplikaci 1. den a 8,0 hodin (rozmezí: 0, 24 hodin) 14. den. Hladinové plazmatické koncentrace se během zkušebního období zvyšovaly a po 11 dnech dosáhly ustáleného stavu. Ve stejné farmakokinetické studii byl podíl dávky vyloučené močí během léčebného období menší nebo roven 0,01 % aplikované dávky.
V druhé studii byla farmakokinetika přípravku NAFTIN® Gel hodnocena u 22 pediatrických subjektů ve věku 12-17 let s tinea pedis. Subjekty byly léčeny průměrnou dávkou 4,1 g přípravku NAFTIN ® Gel aplikovanou na postižené místo jednou denně po dobu 14 dnů. Výsledky ukázaly, že systémová expozice se v průběhu léčby zvyšovala. Geometrický průměr (CV%) AUC0-24 byl 15,9 (212) ng∙hr/ml v 1. den a 60,0 (131) ng∙hr/ml ve 14. den. Geometrický průměr (CV%) Cmax po podání jedné dávky byl 1,40 (154) ng/ml v 1. den a 3,81 (154) ng/ml ve 14. den. Podíl dávky vyloučené močí během léčby byl menší nebo roven 0,003 % aplikované dávky.
Mikrobiologie
Mechanismus účinku
Naftifin je antimykotikum, které patří do třídy allylaminů. Ačkoli přesný mechanismus účinku proti plísním není znám, zdá se, že naftifin-hydrochlorid zasahuje do biosyntézy sterolů inhibicí enzymu skvalen 2, 3-epoxidázy. Inhibice aktivity enzymu tímto allylaminem má za následek snížení množství sterolů, zejména ergosterolu, a odpovídající akumulaci skvalenu v buňkách.
Mechanismus rezistence
Dosud nebyl identifikován mechanismus rezistence vůči naftifinu.
Bylo prokázáno, že nafifin je účinný proti většině izolátů následujících hub, a to jak in vitro, tak při klinických infekcích, jak je popsáno v části INDIKACE A POUŽITÍ:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Neklinická toxikologie
Karcinogeneze, mutageneze, Poškození plodnosti
Ve dvouleté studii dermální karcinogenity byl naftifin-hydrochloridový krém podáván potkanům Sprague-Dawley v lokálních dávkách 1 %, 2 % a 3 % (10, 20 a 30 mg/kg/den naftifin-hydrochloridu). V této studii nebyly zaznamenány žádné nádory související s léčivem až do nejvyšší dávky hodnocené v této studii 30 mg/kg/den (36násobek MRHD na základě srovnání AUC).
Naftifin-hydrochlorid nevykazoval žádný důkaz mutagenního nebo klastogenního potenciálu na základě výsledků dvou testů genotoxicity in vitro (Amesův test a test chromozomových aberací buněk vaječníků čínského křečka) a jednoho testu genotoxicity in vivo (test mikrojader v kostní dřeni myší).
Orální podávání hydrochloridu naftifinu potkanům během páření, březosti, porodu a laktace neprokázalo žádné účinky na růst, plodnost nebo reprodukci, a to v dávkách až 100 mg/kg/den (12násobek MRHD na základě srovnání mg/m 2).
Klinické studie
NAFTIN ® Gel byl hodnocen z hlediska účinnosti ve dvou randomizovaných, dvojitě zaslepených, vehikulem kontrolovaných, multicentrických studiích, které zahrnovaly 1175 subjektů se symptomatickou a kultivačně pozitivní interdigitální tinea pedis. Subjekty byly randomizovány k podávání přípravku NAFTIN® Gel nebo vehikula. Subjekty aplikovaly naftifin hydrochlorid gel 2 % nebo vehikulum na postiženou oblast chodidla jednou denně po dobu 2 týdnů. Byly hodnoceny příznaky a symptomy interdigitální tinea pedis (přítomnost nebo nepřítomnost erytému, pruritu a šupinatění) a 6 týdnů po první léčbě bylo provedeno vyšetření hydroxidem draselným (KOH) a kultivace dermatofytů.
Průměrný věk studované populace byl 45 let; 77 % tvořili muži; 60 % tvořili běloši, 35 % černoši nebo Afroameričané a 26 % hispánci nebo latinoameričané. Na začátku studie byly u subjektů potvrzeny známky a příznaky interdigitální tinea pedis, pozitivní KOH vyšetření a potvrzená kultivace dermatofytů. Primárním cílovým ukazatelem účinnosti byl podíl subjektů s úplným vyléčením po 6 týdnech od zahájení léčby (4 týdny po poslední léčbě). Úplné vyléčení bylo definováno jako klinické vyléčení (nepřítomnost erytému, pruritu a šupinatění) i mykologické vyléčení (negativní KOH a kultivace dermatofytů).
Výsledky účinnosti v 6. týdnu, čtyři týdny po ukončení léčby, jsou uvedeny v tabulce 1 níže.
| Zkouška 1 | Zkouška 2 | |||
|---|---|---|---|---|
| Koncový bod | NAFTIN ® Gel, 2% N=382 n (%) |
Velikost N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Velikost N=213 n (%) |
| * Úplné vyléčení je složený koncový ukazatel mykologického i klinického vyléčení. Klinické vyléčení je definováno jako nepřítomnost erytému, pruritu a šupinatění (stupeň 0). † Účinná léčba je negativní KOH preparát a negativní kultivace dermatofytů, erytém, šupinatění a pruritus stupně 0 nebo 1 (chybí nebo téměř chybí). ‡ Mykologické vyléčení je definováno jako negativní KOH preparát a kultivace dermatofytů. | ||||
| Úplné vyléčení * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Účinnost léčby † | 207 (54 %) | 11 (6 %) | 203 (51 %) | 15 (7 %) |
| Mikrobiologické vyšetření Léčba ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Způsob dodání/skladování a zacházení s ním
Jak se dodává
NAFTIN ® Gel je bezbarvý až žlutý gel dodávaný ve skládacích tubách v následující velikosti:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Skladování
Gel NAFTIN ® skladujte při teplotě 25°C; výkyvy jsou povoleny na 15-30°C .
Informace pro pacienty
- Informujte pacienty, že NAFTIN ® Gel je určen pouze k lokálnímu použití. NAFTIN ® Gel není určen k oftalmologickému, perorálnímu ani intravaginálnímu použití.
- Pacienti by měli být poučeni, aby kontaktovali svého lékaře, pokud se při používání přípravku NAFTIN ® Gel objeví podráždění.
Distributor: Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Všechna práva vyhrazena.
ZÁKLADNÍ DISPLEJ – 45g tuba karton

NDC 54766-772-45
NAFTIN ®
(Naftifin hydrochlorid) gel, 2%
Sebela Pharmaceuticals Inc.
Pouze pro lokální použití
Není určeno pro oční použití, K perorálnímu nebo intravaginálnímu použití
45g
Pouze na lékařský předpis
PŘÍPRAVEK NA OPLACHOVÁNÍ – 60 g krabička s tubou

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Pouze pro lokální použití
Není určeno pro oční použití, Perorální nebo intravaginální použití
60g
Pouze na lékařský předpis
| NAFTIN naftifin hydrochlorid gel |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Etiketář – Sebela Pharmaceuticals Inc. (079104574)
| Zařízení | |||
| Název | Adresa | ID/FEI | Provoz |
| DPT Laboratories, Ltd. | 832224526 | výroba(54766-772), analýza(54766-772), označování(54766-772) | |
Další informace o přípravku Naftin (naftifin topical)
- Nežádoucí účinky
- Během těhotenství nebo kojení
- Dávkování Informace
- Cena &Kupóny
- En Español
- 3 Recenze
- Generická dostupnost
- Třída léků: antimykotika pro lokální použití
Zdroje pro spotřebitele
- Informace pro pacienty
- Naftin topický (rozšířené čtení)
Odborné zdroje
- Předpisová informace
- Naftifin (monografie AHFS)
Ostatní přípravky
- Naftin-MP Topical
Související léčebné příručky
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medicínské prohlášení o vyloučení odpovědnosti
.