V buněčně zprostředkované části adaptivní imunitní odpovědi jsou krátké peptidy vázány na molekuly hlavního histokompatibilního komplexu (MHC) I. a II. třídy a prezentovány na povrchu buněk, kde jsou rozpoznány antigenními receptory T-lymfocytů. Vazba T-buněčného receptoru (TCR), který rozpoznává určitý komplex MHC-peptid, vyvolá diferenciaci naivních lymfocytů na efektorové buňky (cytotoxické a pomocné T-buňky), které ničí infikované hostitelské buňky nebo stimulují tvorbu protilátek, a paměťové buňky, které poskytují ochrannou imunitu proti reinfekci.
Struktura a funkce molekul MHC
Dvě multigenové rodiny nacházející se v genomové oblasti MHC kódují molekuly vážící antigen, které prezentují cizorodé peptidy na povrchu buněk. Ve skutečnosti molekuly MHC prezentují také peptidy vlastního původu. Negativní thymická selekce proti autoreaktivním T-buňkám však brání tomu, aby komplexy MHC-self-peptid vyvolaly imunitní odpověď. Molekuly MHC I. třídy jsou exprimovány na většině jaderných buněk a obvykle obsahují endogenní peptidy pocházející z intracelulárních patogenů replikujících se v cytosolu (např. viry). Cytosolové proteiny jsou degradovány na krátké peptidové fragmenty proteazomem a jsou nejprve transportovány do endoplazmatického retikula (ER) transportéry závislými na ATP TAP1 & 2 k naložení MHCI a poté na buněčný povrch k prezentaci cirkulujícím cytotoxickým buňkám CD8+ T, jejichž funkcí je vyvolat apoptózu a lýzu infikované cílové buňky. (Obrázky jsou převzaty z Murphy et al. (2008), obr. 3.12, 3.25, 5.5, & 5.11.)
Konstitutivní exprese lokusů MHC II. třídy je omezena na antigen prezentující buňky imunitního systému (APC, např. makrofágy, dendritické buňky a B lymfocyty). Molekuly MHCII jsou stabilizovány a je jim zabráněno vázat antigen, když se nacházejí v ER, prostřednictvím asociace s invariantním řetězcem třídy II (Ii nebo CD74), a poté jsou přesměrovány z výchozí sekreční dráhy do endocytické dráhy. Tam se setkávají s peptidy pocházejícími z patogenů replikujících se v intracelulárních vezikulech nebo z extracelulárních patogenů a proteinů, které jsou transportovány do buňky. Stabilní vazba peptidů je katalyzována neklasickým dimerem MHCII DMα/β a umožňuje komplexům peptidů MHCII uniknout z endocytické dráhy a prezentovat se na povrchu buňky. Rozpoznání buňkami CD4+ T aktivuje cílovou hostitelskou buňku ke stimulaci antibakteriálních mechanismů (u makrofágů) nebo ke spuštění produkce protilátek a humorální imunitní odpovědi.
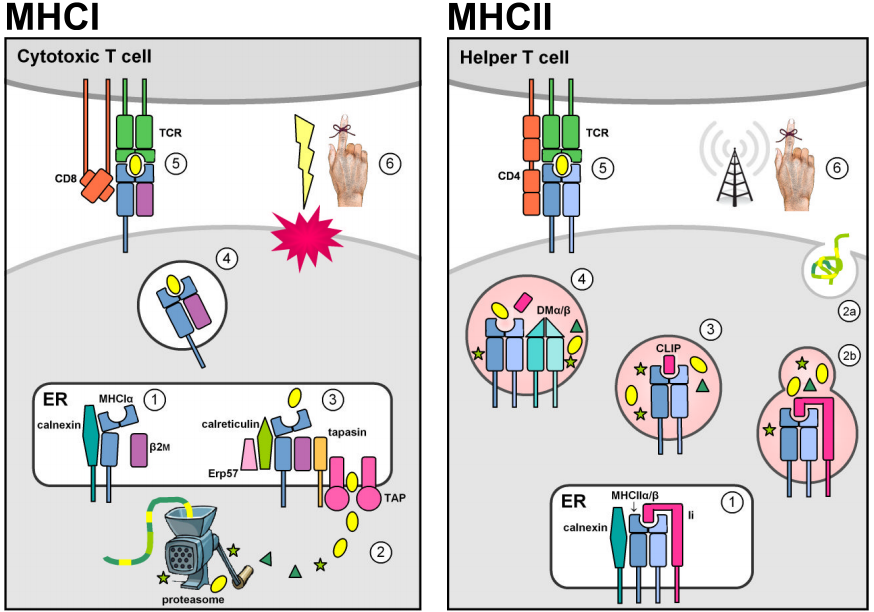
Strukturální podobnost molekul MHCI a MHCII pravděpodobně odráží jejich původ od společného předka. Zralé molekuly MHC jsou integrální membránové glykoproteiny typu I složené z peptidové vazebné rýhy a imunoglobulinům podobných, transmembránových a cytoplazmatických domén. Extracelulární části molekul MHC se skládají ze dvou membránových distálních domén, které společně vytvářejí peptidovou vazebnou dutinu ohraničenou dvěma přerušenými šroubovicemi α spočívajícími na antiparalelním listu β, a dvou membránových proximálních domén podobných imunoglobulinům (Ig-like), které se podílejí na vazbě koreceptorů CD4 a CD8.
Přes tyto strukturní podobnosti jsou proteinové podjednotky kódovány odlišně pro molekuly I. a II. třídy. Molekuly MHCI jsou heterodimery tvořené nekovalentní asociací mezi těžkým řetězcem MHCIα a β2-mikroglobulinem (β2m), který je kódován z velké části neměnným lokusem umístěným mimo genomickou oblast MHC. Těžký řetězec přispívá oběma peptid-vázajícími štěpinami a jednou z domén podobných Ig, zatímco β2m dodává pouze druhou oblast podobnou Ig, která postrádá transmembránovou kotvu. Molekuly MHC II. třídy jsou heterodimery, které vznikají nekovalentním spojením řetězce α a β, z nichž oba přispívají jednotlivými doménami podobnými Ig vázajícími peptidy a ukotvenými v membráně a z nichž každý je transkribován z odlišného lokusu, který se obvykle nachází v oblasti MHC.
Členové rodiny genů MHC se kromě nefunkčních pseudogenů mohou dále dělit na klasické nebo neklasické lokusy. Klasické lokusy MHC Ia jsou široce exprimovány a jsou typicky spojeny s vysokou variabilitou sekvence a pozitivní selekcí působící na substituce na zbytcích peptidové vazebné oblasti (PBR). Neklasické lokusy MHC Ib mají naopak sníženou expresi nebo omezenou tkáňovou distribuci, nižší polymorfismus a mohou mít omezené nebo modifikované funkce. U genů II. třídy se „klasické“ obvykle vztahuje na všechny antigen-prezentující lokusy, zatímco termín „neklasické“ je vyhrazen pro geny, jako je DMα/β, které plní akcesorní role v antigen-prezentační dráze. Ačkoli tato funkční kategorizace členů genové rodiny poskytuje užitečný pracovní slovník, hranice mezi klasickými a neklasickými lokusy není v praxi vždy jasná a některé neklasické lokusy MHCI jsou polymorfní, široce exprimované nebo vážou peptidické ligandy tradičním způsobem klasických genů.
Extrémní polymorfismus na úrovni populace a důkazy o vyvažující selekci naznačují, že k rozpoznání a reakci na rozmanitou sestavu patogenů je pravděpodobně zapotřebí značné alelické variability genů MHC. Navzdory rozsáhlé genové duplikaci u některých druhů však jedinci obvykle exprimují pouze mírný počet klasických MHC lokusů a u některých polyploidních druhů rodu Xenopus je rovněž pozorována reverze k disomické dědičnosti. Předpokládá se, že omezení intraindividuální variability MHC (přinejmenším u vysoce exprimovaných klasických lokusů) odráží funkční kompromis mezi zvýšením alelického repertoáru pro prezentaci většího množství patogenních peptidů a doprovodným snížením repertoáru T-buněk, které by bylo nutné pro udržení autotolerance. Jednotlivé molekuly MHC proto musí být schopny permisivní vazby peptidů, aby adekvátně rozpoznaly širokou škálu cizorodých antigenů. Je však také třeba vytvořit stabilní komplexy MHC-peptid, které budou přetrvávat po dostatečně dlouhou dobu, aby umožnily rozpoznání T-buňkami, a které nebudou vyměňovat peptidy na povrchu buněk, což by mohlo vést k destrukci neinfikovaných buněk. Taková stabilita je obecně spojena s vysokou afinitou, a tedy omezujícími mezimolekulárními interakcemi.
MHC molekuly smiřují tyto konkurenční vazebné požadavky pomocí elegantního strukturního řešení: kontakty mezi vysoce konzervovanými zbytky peptidové vazebné oblasti (PBR) molekuly MHC a atomy hlavního řetězce peptidu stabilizují promiskuitní vazbu většiny peptidových ligandů, zatímco polymorfní zbytky lemující peptidovou vazebnou rýhu vytvářejí nepravidelné kapsy s různou stereochemií, které pojmou peptidové zbytky v závislosti na sekvenci. Omezení daná kapsami pro vazbu postranních řetězců se liší jak mezi alelami, tak mezi kapsami v rámci jedné molekuly MHC. O kapsách, které kladou přísnější vazebné požadavky, se říká, že pojmou peptidové zbytky „primární kotvy“, zatímco „sekundární kotvy“ jsou ve svých vazebných preferencích flexibilnější. Tyto specifity společně určují motiv vazby peptidů konkrétní alely MHC, který propůjčuje selektivitu při prezentaci antigenu
.