Stabilitet af karbokationsintermedier
Vi ved, at det hastighedsbegrænsende trin i en SN1-reaktion er det første trin – dannelsen af dette karbokationsintermediat. Hastigheden af dette trin – og dermed hastigheden af den samlede substitutionsreaktion – afhænger af aktiveringsenergien for den proces, hvor bindingen mellem kulstoffet og den afgående gruppe brydes, og der dannes en karbokation. Ifølge Hammonds postulat (afsnit 6.2B) gælder det, at jo mere stabilt carbocation-mellemproduktet er, jo hurtigere vil dette første bindingsbrydende trin ske. Med andre ord afhænger sandsynligheden for, at en nukleofil substitutionsreaktion forløber efter en dissociativ (SN1) mekanisme, i høj grad af stabiliteten af det carbocationintermediat, der dannes.
Det kritiske spørgsmål bliver nu, hvad der stabiliserer en karbokation?
Så hvis det kræver en elektrontiltrækkende gruppe at stabilisere en negativ ladning, hvad vil så stabilisere en positiv ladning? En elektronafgivende gruppe!
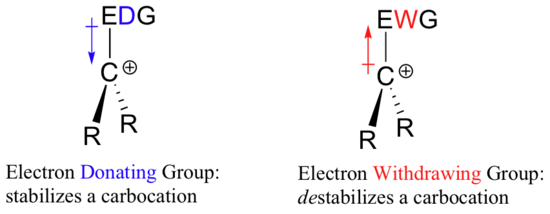
En positivt ladet art som f.eks. en karbokation er meget elektronfattig, og derfor vil alt, der donerer elektrontæthed til centrum for elektronfattigdom, hjælpe med at stabilisere den. Omvendt vil en karbokation blive destabiliseret af en elektrontilbagetrækningsgruppe.
Alkylgrupper – methyl, ethyl og lignende – er svage elektronafgivende grupper og stabiliserer således nærliggende karbokationer. Det betyder, at mere substituerede karbokationer generelt er mere stabile: en tert-butylkarbokation er f.eks. mere stabil end en isopropylkarbokation. Primære carbocationer er meget ustabile og observeres ikke ofte som reaktionsintermediater; methylcarbocationer er endnu mindre stabile.
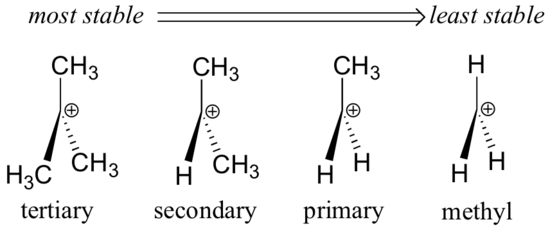
Alkylgrupper er elektrondonorerende og carbocationsstabiliserende, fordi elektronerne omkring de nærliggende kulbrinter trækkes mod den nærliggende positive ladning, hvorved elektronfattigdommen for det positivt ladede kulstof reduceres en smule.
Det er dog ikke korrekt at sige, at carbocationer med højere substitution altid er mere stabile end dem med mindre substitution. Ligesom elektronafgivende grupper kan stabilisere en karbokation, virker elektronhævdende grupper destabiliserende på karbokationer. Karbonylgrupper er elektrontrækkende ved induktive virkninger på grund af polariteten af C=O-dobbeltbindingen. Det er muligt at påvise i laboratoriet (se afsnit 16.1D), at karbokation A nedenfor er mere stabil end karbokation B, selv om A er en primær karbokation, og B er sekundær.
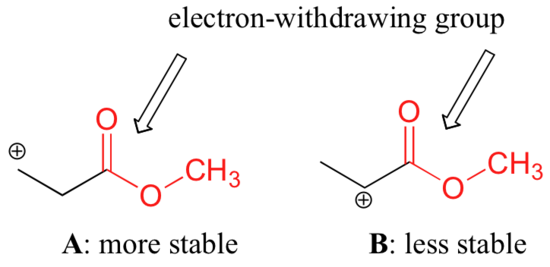
Denne forskel i stabilitet kan forklares ved at betragte esterkarbonylets elektronhævdende induktive virkning. Husk på, at induktive virkninger – uanset om de er elektron- eller donerende – videregives gennem kovalente bindinger, og at styrken af virkningen aftager hurtigt, når antallet af mellemliggende bindinger øges. Med andre ord aftager effekten med afstanden. I art B er den positive ladning tættere på carbonylgruppen, og derfor er den destabiliserende elektron-trækkende effekt stærkere end i art A.
I næste kapitel vil vi se, hvordan den carbocation-destabiliserende effekt af elektron-trækkende fluor-substituenter kan bruges i eksperimenter, der er designet til at besvare spørgsmålet om, hvorvidt en biokemisk nukleofil substitutionsreaktion er SN1 eller SN2.
Stabilisering af en karbokation kan også ske gennem resonansvirkninger, og som vi allerede har diskuteret i syre-base-kapitlet, er resonansvirkninger som regel kraftigere end induktive virkninger. Betragt det enkle tilfælde af en benzylisk carbocation:
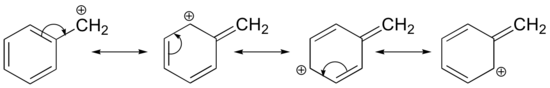
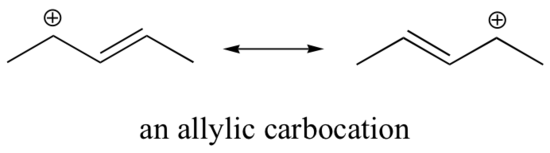
Denne carbocation er forholdsvis stabil. I dette tilfælde er elektrondonation en resonansvirkning. Der kan tegnes yderligere tre resonansstrukturer for denne karbokation, hvor den positive ladning er placeret på et af de tre aromatiske kulbrinter. Den positive ladning er ikke isoleret på det benzyliske kulstof, men er snarere delokaliseret omkring den aromatiske struktur: denne delokalisering af ladningen resulterer i en betydelig stabilisering. Som følge heraf er benzyliske og allyliske carbocationer (hvor det positivt ladede kulstof er konjugeret til en eller flere ikke-aromatiske dobbeltbindinger) betydeligt mere stabile end selv tertiære alkylcarbocationer.
Da heteroatomer som oxygen og nitrogen er mere elektronegative end kulstof, kunne man forvente, at de pr. definition ville være elektrontiltrækkende grupper, der destabiliserer carbocationer. Faktisk er det modsatte ofte tilfældet: hvis oxygen- eller nitrogenatomet er i den rigtige position, er den overordnede effekt carbocationstabilisering. Dette skyldes, at selv om disse heteroatomer ved induktion er elektronhæmmende grupper, er de elektronafgivende grupper ved resonans, og det er denne resonanseffekt, der er kraftigere. (Vi stødte tidligere på den samme idé, da vi overvejede den relative surhed og basiskhed af phenoler og aromatiske aminer i afsnit 7.4). Betragt de to par af karbokationsarter nedenfor:
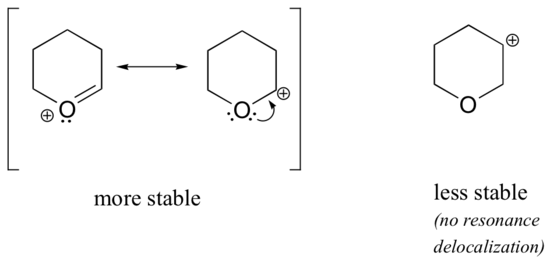
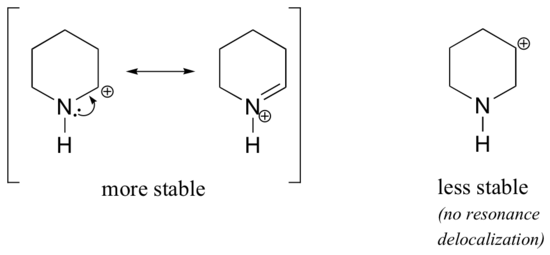
I de mere stabile karbokationer virker heteroatomet som en elektronafgivende gruppe ved resonans: i realiteten er det ensomme par på heteroatomet tilgængeligt til at delokalisere den positive ladning. I de mindre stabile carbocationer er det positivt ladede kulstof mere end én binding væk fra heteroatomet, og der er således ingen resonansvirkninger mulige. Faktisk destabiliserer heteroatomerne i disse karbokationsarter faktisk den positive ladning, fordi de ved induktion trækker elektroner tilbage.
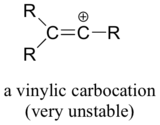
Endeligt er vinylic carbocationer, hvor den positive ladning sidder på et dobbeltbundet kulstof, meget ustabile og derfor usandsynligt, at de dannes som mellemprodukter i en reaktion.
Exempel 7.9.1
I hvilken af nedenstående strukturer forventes carbocationen at være mest stabil? Forklar.
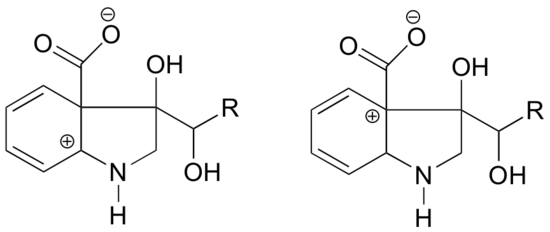
Svar
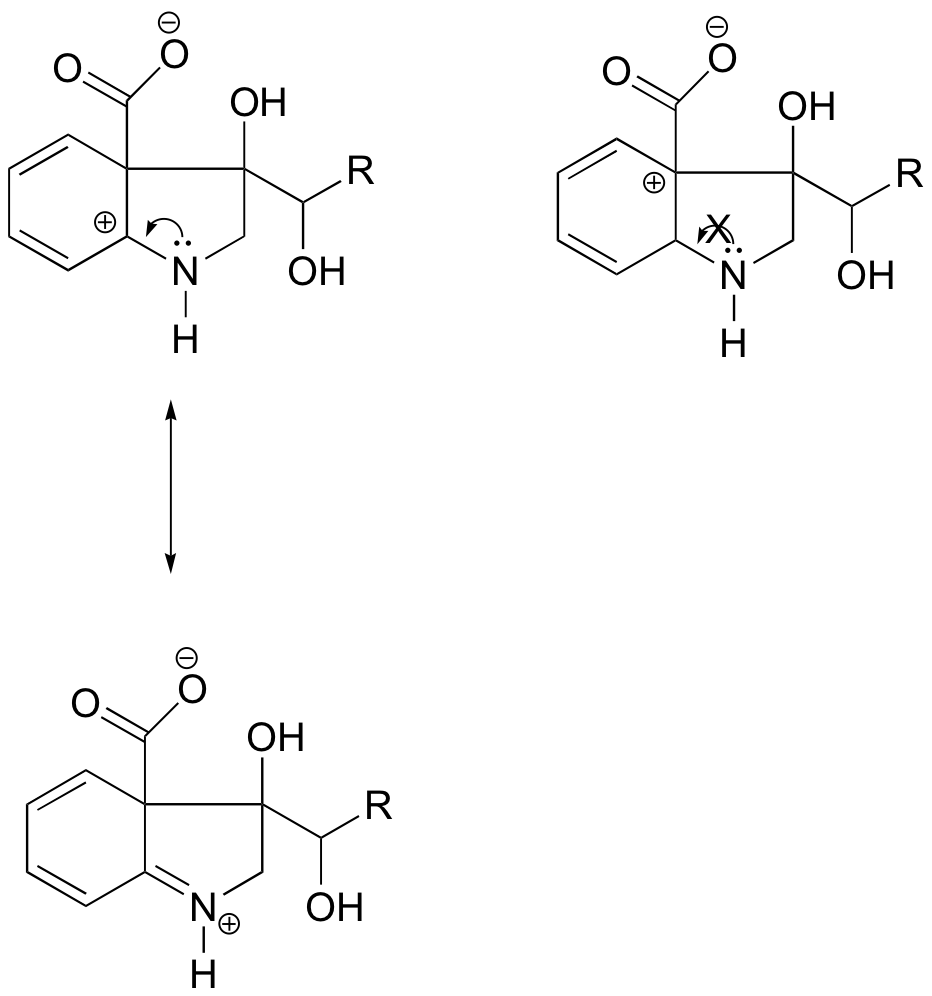
I karbokationen til venstre er den positive ladning placeret i en sådan position i forhold til nitrogenet, at det enlige elektronpar på nitrogenet kan doneres for at fylde den tomme orbital. Dette er ikke muligt for karbokationsarten til højre.
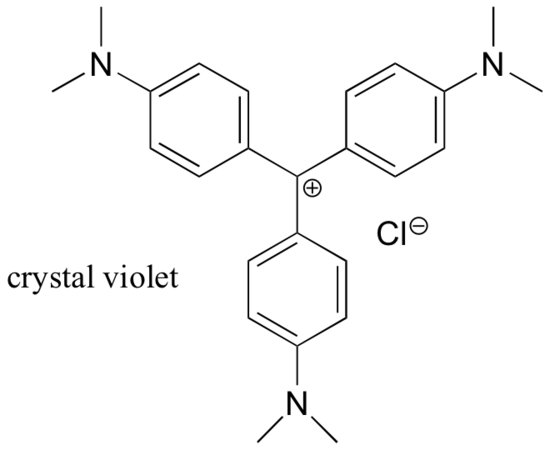
For det meste er karbokationer meget højenergirige, forbigående mellemarter i organiske reaktioner. Der findes dog nogle usædvanlige eksempler på meget stabile carbocationer, der tager form af organiske salte. Krystalviolet er det almindelige navn for chloridsaltet af den carbocation, hvis struktur er vist nedenfor. Bemærk de strukturelle muligheder for omfattende resonansdelokalisering af den positive ladning og tilstedeværelsen af tre elektronafgivende amingrupper.
Exempel 7.9.2
Tegn en resonansstruktur af krystalvioletkationen, hvor den positive ladning er delokaliseret til et af kvælstofatomerne.
Svar 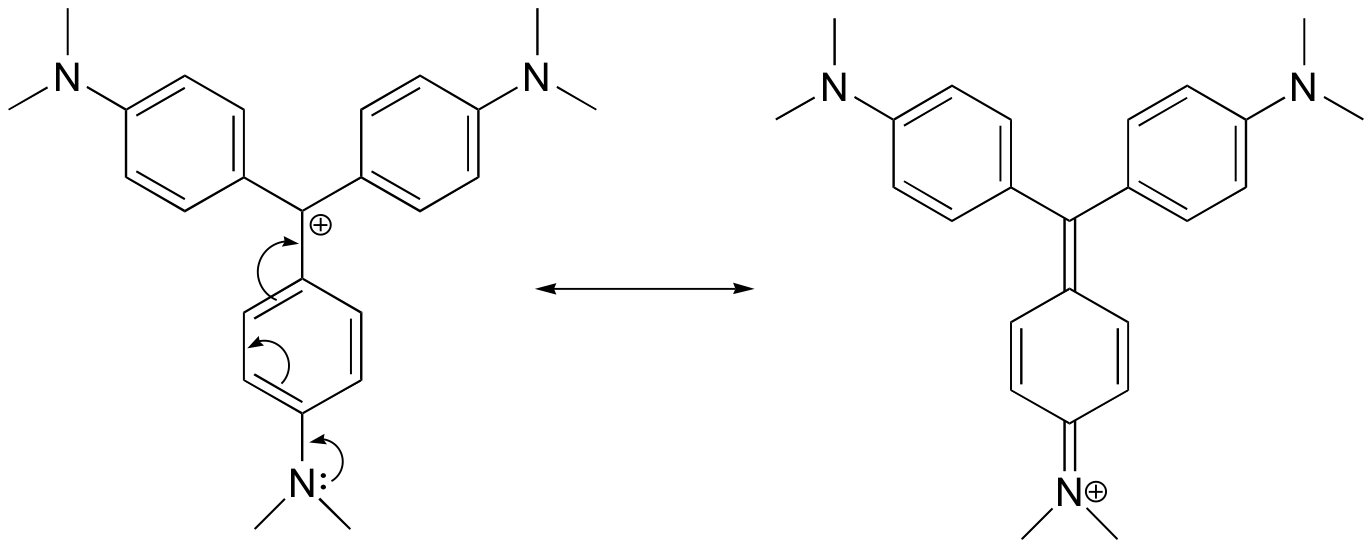
Når man overvejer muligheden for, at en nukleofil substitutionsreaktion forløber via en SN1-vej, er det afgørende at vurdere stabiliteten af det hypotetiske karbokationsintermediat. Hvis dette mellemprodukt ikke er tilstrækkeligt stabilt, må en SN1-mekanisme anses for at være usandsynlig, og reaktionen forløber sandsynligvis via en SN2-mekanisme. I næste kapitel vil vi se flere eksempler på biologisk vigtige SN1-reaktioner, hvor det positivt ladede mellemprodukt er stabiliseret af induktive og resonansvirkninger, der er indbygget i dets egen molekylære struktur.
Eksempel 7.9.3
Angiv, hvilken karbokation i hvert af nedenstående par der er mest stabil, eller om de forventes at være omtrent lige stabile. Forklar din begrundelse.
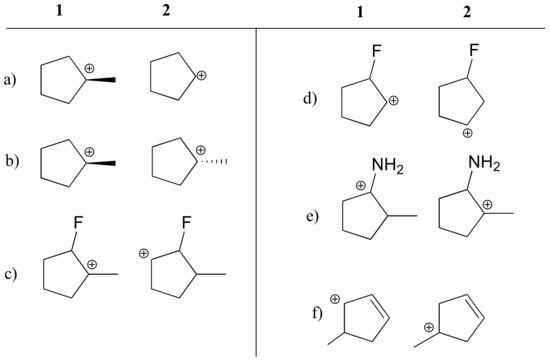
Svar
a) 1 (tertiær vs. sekundær karbokation)
b) lige meget
c) 1 (tertiær vs. sekundær karbokation)
b) lige meget
c) 1 (tertiær vs. sekundær karbokation)
. sekundær karbokation)
d) 2 (positiv ladning er længere væk fra elektron-fradragende fluor)
e) 1 (lone pair på nitrogen kan donere elektroner ved resonans)
f) 1 (allylisk karbokation – positiv ladning kan delokaliseres til et andet kulstof)