En elektrokemisk celle består i sin simpleste form af to elektronledere, der er adskilt af en ionleder og forbundet af en elektronleder.
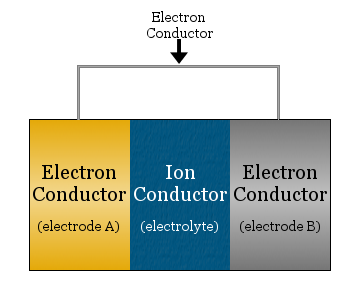
- Den ioniske leder kaldes elektrolytten
- Elektronlederne, der er adskilt af elektrolytten, kaldes elektroder
- Elektronlederen, der bruges til at forbinde elektroderne, er ofte en metaltråd, f.eks. kobberledninger
To typer af celler
Der findes to grundlæggende typer af elektrokemiske celler: galvaniske og elektrolytiske.
Energieomdannelsen opnås ved spontane (ΔG < 0) redoxreaktioner, der producerer en strøm af elektroner.
En strøm af elektroner driver ikke-spontane (ΔG ≥ 0) redoxreaktioner.
Eksempler
- Et batteri, der driver noget, er et eksempel på en galvanisk celle.
- Opladelige batterier er eksempler på begge celletyper: de fungerer som galvaniske celler, når de forsyner en enhed med strøm, og som elektrolytiske celler, når de oplades.
- Eksempler på elektrolytiske celler omfatter også dem, der bruges til at opdele vand i brint og ilt, og dem, der omdanner aluminiummalm til aluminiummetal.
En kilde til termodynamiske data
Ud over de praktiske anvendelser, som f.eks. de ovenfor beskrevne, er elektrokemiske celler en glimrende måde at indsamle termodynamiske data på.F.eks. gør de det muligt at bestemme standard redoxpotentialer, hvorfra standard enthalpi, standard entropi og standard Gibbs fri energi data for reaktioner nemt kan fås.
Spaltning af reaktioner
Elektrokemiske celler kan:
- levere elektricitet, eller
- omdanne metalmalme til metal, eller
- give termodynamiske data,
fordi redoxreaktionerne finder sted separat.
Eksempel:
Eksempel: Daniell-cellen
I elektrokemiske celler finder reaktionerne sted ved separate elektroder – og elektroderne selv kan faktisk være placeret i forskellige beholdere.Tag en af de tidlige galvaniske celler, Daniell-cellen, som eksempel.
Energikilden i Daniell-cellen er den spontane reaktion mellem zinkmetal og kobbersulfat, hvorved der dannes zinksulfat og kobbermetal.
ΔG° = -212.6 kJ mol-1
Når materialerne bringes sammen:
- i direkte kontakt i et kar, omdannes kemisk potentiel energi til termisk energi, og reaktionsbeholderen bliver varmere
- i en elektrokemisk celle omdannes kemisk potentiel energi til elektrisk energi
Daniell-cellen
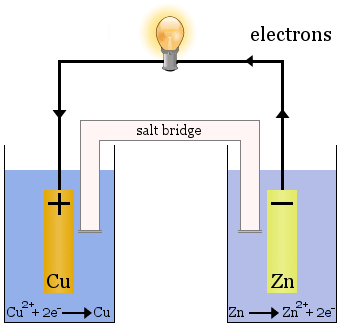
Daniell-cellen består af to halvceller: kobberioner reduceres i den ene, og zink oxideres i den anden.
Når cellen fungerer, fjernes Cu2+ fra den ene celle, og Zn2+ dannes i den anden celle. kobberelektroden begynder at vokse, da den er belagt med nyligt aflejret kobbermetal, og zinkelektroden begynder at formindskes på grund af tabet af zink som ioner til opløsningen.
Saltbroen i ovenstående tilfælde er glasrør fyldt med mættet KNO3-opløsning.Den har fritter i enderne, der forhindrer blanding af opløsningerne i hver af halvcellerne, men den tillader ioner at passere igennem for at fuldføre det elektriske kredsløb og holde hver halvcelle elektrisk neutral.
Den drivende kraft er den samme ΔG° = -212.6 kJ mol-1 , som opnås ved blot at blande reaktanterne i ét kar; ved at adskille de to halvreaktioner skal elektronerne passere gennem ledningen, og vi kan udnytte den elektriske energi.
