- Review artikel
- Enterokutan fistel: Evidensbaseret behandling
- Abstract
- Introduktion
- Tabel 1
- Tabel 1: Klassifikation.
- Tabel 2
- Tabel 2: ECF prognostiske variabler.
- Klassifikation
- Prognostiske faktorer for ECF
- Diagnose
- Figur 1
- Håndtering
- Reanimation
- Kildekontrol
- Effluentbehandling
- Sårbehandling
- Tabel 3
- Tabel 3: Tidsforløb til endelig behandling.
- Næring
- Konklusion
Review artikel
Enterokutan fistel: Evidensbaseret behandling
Ryan P Dumas1*, Sarah A Moore1 og Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Korresponderende forfatter: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Behandlingen af enterokutan fistel (ECF) er en klinisk færdighed, som bør være i enhver almen kirurgs armamentarium. Selv om den endelige behandling ofte er afhængig af kirurgisk lukning, er præoperativ pleje og omhu af afgørende betydning for at sikre et vellykket resultat. Plejen af disse patienter bør fokusere på fire vigtige faser. Den første fase er kendetegnet ved korrekt genkendelse og genoplivning. I den anden fase foretages der en fuldstændig ernæringsvurdering og -plan. Radiografisk evaluering i den tredje fase bidrager til at definere ECF-anatomien. Endelig er fjerde fase kendetegnet ved endelig lukning, hvis fistlen ikke heler spontant.Denne gennemgang vil fokusere på de nøgleaspekter, der definerer hver fase og hjælper den almindelige kirurg med at maksimere chancerne for et positivt resultat.
Introduktion
Udviklingen af en enterokutan fistel (ECF), defineret som en anomal forbindelse mellem tarmlumen og den ydre hud, er en betydelig kilde til morbiditet og mortalitet på trods af fremskridt inden for både kirurgisk og medicinsk behandling. Den samlede incidens af ECF er imidlertid ukendt, idet de fleste data vedrørende ECF stammer fra store institutionelle retrospektive eller kirurgspecifikke serier . Det er bemærkelsesværdigt, at kun 25 % af alle ECF’er er sekundære til inflammatorisk tarmsygdom, divertikelpatologi, traumer, stråling og malignitet . I modsætning hertil er næsten 75 % af alle ECF’er et direkte resultat af enten laparoskopisk eller åben kirurgi, hvor over 50 % af disse fistler skyldes en astomoselækage efter en fjernelse af enenterektomi. De resterende fistler skyldes utilsigtede iatrogene skader som f.eks. enterotomier eller uerkendte termiske skader, der opstår under en operation. Da ECF oftest er et problem, der er skabt af kirurgen, er det med rette kirurgens opgave at forebygge og sikre en passende håndtering, planlægning og endelig behandling.
Morbiditeten og mortaliteten efter ECF er overordentlig høj. Det anslås, at 90 % af patienterne vil opleve en ECF-relateret morbiditet, der spænder fra hudekskoriation til dehydrering og sepsis.Desuden varierer den mortalitet, der kan tilskrives en ECF, fra 5-20 % og er afhængig af en række faktorer, herunder underliggende infektion og fistlens placering . Da den vigtigste dødsårsag hos patienter med ECF er sepsis, er kildekontrol fortsat en af hjørnestenene i behandlingen. I retrospektive serier blev det konstateret, at dødeligheden steg 16 gange i tilfælde af sepsis og 22 gange i tilfælde af ukontrolleret infektion . Som sådan har tidlig og definitiv behandling af uudtømte samlinger i forbindelse med kortvarige antimikrobielle midler potentiale til at forbedre resultaterne betydeligt. I de fleste serier synes dødeligheden også at være korreleret med fisteludgang og fistelplacering. Mortaliteten stiger fra 26 % i fistler med lavt output til 50 % i fistler med højt output på grund af de væske-, elektrolyt- og ernæringsmæssige udfordringer, der er forbundet med ECF-behandling . Mortaliteten korrelerer også med placeringen og falder med mere distale fistler. Mens jejunalfistler har den højeste dødelighed på 29 % og er betydeligt mere udfordrende at håndtere, er dødeligheden af kolonfistler den laveste på 6 % .
Ud over patientens påvirkning, som spænder fra både fysiologisk og psykologisk, lægger håndtering af ECF et enormt pres på sundhedsvæsenets ressourcer. Det anslås, at omkostningerne ved ECF-behandling er langt over 500 000 USD og kræver et tværfagligt team af ernæringseksperter, sårplejesygeplejersker og kirurger for at sikre et godt resultat . Betydningen af behandlingscentre med høj ekspertise bør ikke undervurderes og har vist sig at kunne reducere dødeligheden betydeligt fra 42 % til 20 % .
Tabel 1

| Anatomisk | Proximalt eller distalt | Gastrisk, duodenalt, jejunalt, ilealt, colonic |
| Fysiologisk | Højt, moderat, lavt output | Højt output >500cc/dag Moderat 200-500cc/dag Lavt output < 200cc/dag |
| Etiologi | Iatrogen vs. spontan Traumatisk |
Malignt Stråling Inflammatorisk tarmsygdom Divertikulær |
Tabel 1: Klassifikation.
Tabel 1
Klassifikation.
Tabel 2

| FAVORISERET | UNFRIT |
|---|---|
| Næringsrig | Næringsfattig |
| – Albumin >3.0 | -lavt albumin, lavt transferrin |
| Lang fistelkanal (>2cm) | Kort fistel, flere, komplekse fistler |
| Divertikulær fistel | Stor enteral defekt (>1cm), synlig slimhinde |
| Lavt output | Højt output (>500cc/dag) |
| En enkelt fistel | Prior stråling |
| Intestinal kontinuitet | Flere tidligere operationer |
| Indeksoperation udført på samme center | Ekstern henvisning til en højvolumencenter |
Tabel 2: ECF prognostiske variabler.
Tabel 2
ECF prognostiske variabler.
Klassifikation
Der findes ikke noget universelt eller veletableret klassifikationsskema forECF’er. Fistler klassificeres generelt anatomisk, fysiologisk eller efter sygdomsproces . Fistler kan desuden klassificeres efter mængden af daglig produktion. Det er absolut nødvendigt, at fistelproduktionen dokumenteres nøjagtigt, da mængden kan diktere ændringer i behandlingen. Tabel 1 beskriver tre forskellige klassifikationsparadigmer.
Prognostiske faktorer for ECF
De prognostiske faktorer for ECF er meget velbeskrevet og er i overensstemmelse med standard kirurgisk dogme. Patienter med en proximal fistel med højt output ledsaget af et lavt albumin(. Omvendt klarer patienter uden komorbiditeter, som har fistler, der er resultatet af et kirurgisk indgreb, og som har lavt output, sig bedre med højere spontane lukkerater . Tabel 2 beskriver mange af de variabler, der kan forudsige et succesfuldt resultat.
Vigtigheden af institutionel støtte og tværfaglig ekspertise som en positiv prognostisk faktor kan ikke understreges nok.Flere undersøgelser har bekræftet, at institutionel erfaring og volumen er afgørende faktorer for at mindske morbiditeten og forbedre dødeligheden. For nylig kodificerede den canadiske sammenslutning for enterostomal terapi betydningen af tværfaglig behandling ved at identificere ni vigtige teammedlemmer i deres “ECF Best Practice”-anbefalinger. Denne integrerede teamtilgang, der spænder fra kirurger til farmaceuter og læger, anerkender den ekspertise, som hvert enkelt speciale bidrager med i behandlingen af disse komplekse patienter.
Diagnose
Et ulmende postoperativt forløb, der kompliceres af ileus og udvikling af en postoperativ sårinfektion, er et forvarsel om ECF. Når der er mistanke om en fistel eller er blevet identificeret ved fysisk undersøgelse, er radiologiske undersøgelser nødvendige supplementer, og 97% af alle patienter gennemgår en eller anden form for radiologisk evaluering . Kontrastforstærket CT-scanning er vigtig, da den vurderer tilstedeværelsen af en associeret absces eller en ikke drænet samling. Når kildekontrollen er blevet optimeret, spiller fluoroskopisk fistulografi en vigtig rolle ved fastlæggelse af fistelanatomien. Et fistulogram vil hjælpe med at lokalisere oprindelsen, bestemme længden, vurdere tilstedeværelsen af distalobstruktion og afgøre, om fistlen er i kontinuitet med resten af tarmen . Når diagnosen ECF er blevet bekræftet, bør fokus flyttes til behandlingen.
Figur 1
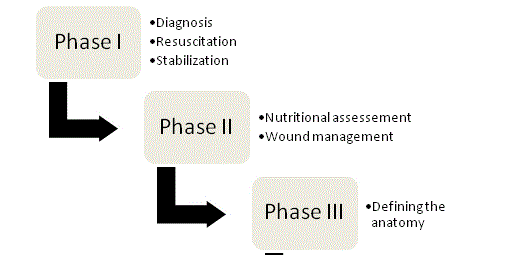
Figur 1
Fire faser i forvaltningen af ECF.
Håndtering
De principper, der ligger til grund for håndtering af ECF, blev for første gang fremhævet af Chapman og kolleger i 1964, og de er til dato stadig hjørnestenene i behandlingen. I deres oprindelige artikel identificerede Chapman et al. fire nøglefaktorer: genoplivning af væske, kildekontrol, udflådestyring og hudbeskyttelse. Betydningen af ernæring er for nylig blevet fremhævet som et femte nøgleelement. Der bør anvendes en organiseret, systematisk tilgang til alle fistelpatienter for at optimere chancerne for et vellykket resultat, og behandlingen kan i sidste ende opdeles i de fire faser (figur 1).
Reanimation
Reanimation af en patient med en nydiagnosticeret ECF følger mange af de samme principper som reanimation af septiske patienter, og principperne i Surviving Sepsis Campaign bør tjene som en ramme. Den indledende behandling bør fokusere på aggressiv væskeoplivning, hurtig vurdering og korrektion af elektrolytforstyrrelser og normalisering af mælkesyregigtning. Patienter med ECF er almindeligvis hyponatriæmiske, hypokaliæmiske og acidotiske på grund af løbende GI-tab.Patienter med fistler med høj output bør have væske-, elektrolyt- og bikarbonattab erstattet intravenøst for at undgå dehydrering og dyb metabolisk ustabilitet i den indledende stabiliseringsperiode. Omhyggelig overvågning af urinproduktion og målrettet udskiftning af fisteludstrømning hver 4. til 8. time vil forhindre vedvarende dehydrering.
Kildekontrol
Når patienten er genoplivet, skal opmærksomheden flyttes til etablering af kildekontrol. Som tidligere nævnt er en kontrastforstærketCT-scanning medvirkende til at identificere uudtømmede samlinger og abscesser. Hos postoperative patienter opnås kildekontrol sandsynligvis mest sandsynligt ved interventionel radiologi. Hvis der er tale om utilgængelige samlinger eller ukontrolleret intraabdominal sepsis, kan det imidlertid være uundgåeligt at foretage en operation. Der bør ikke rutinemæssigt anvendes bredspektret, empirisk intravenøs antibiotika til behandling af ECF, medmindre der er tegn på intraabdominale samlinger eller sårinfektion med en tilknyttet cellulitis. Når det er muligt, bør antibiotika målrettes mod specifikke kulturdata og begrænses til nomore end 2 uger.
Effluentbehandling
Håndteringen af succesudflåd kan have en betydelig indvirkning på volumenstatus, elektrolytbalance, ernæring og hudintegritet.Supplerende medicinsk behandling af ECF effluent har traditionelt fokuseret på to hovedområder: syreneutralisering og volumenreduktion. brugen af protonpumpehæmmere kan opfylde begge mål, og dosis bør titreres, indtil effluentens pH er større end 6, og outputvolumen er mindre end 1L/dag . Selv om psyllium kan være yderst nyttigt til at fylde udflåddet op og øge transittiden, er antimotilitets- og antisekretoriske midler, herunder loperamid, atropinediphenoxylat, kodein, opiumtinktur og endda metadon, hovedhjørnestenen i volumenreduktionen. I betragtning af somatostatins rolle som universel mave-tarm-hormonhæmmer er der blevet forsket meget i virkningerne af eksogent somatostatin på patienter medECF. På trods af et betydeligt antal randomiserede kontrollerede forsøg er det vanskeligt at drage væsentlige konklusioner på grund af en lille stikprøvestørrelse og et inkonsekvent undersøgelsesdesign. Octreotid, en længerevarende somatostatinanalog, er også blevet undersøgt som et tillæg til ECF med lovende resultater. Octreotide 100 mcg tre gange dagligt kan reducere udflådsmængden og har i nogle undersøgelser vist sig at forkorte tiden til spontan lukning . Som sådan kan et forsøg med octreotidbehandling i 72 timer med tæt fisteludgangsovervågning være berettiget, især i tilfælde, hvor andre behandlinger ikke har formået at reducere udgangsvolumen . Almindelige bivirkninger omfatterhyperglykæmi, hovedpine og cholelithiasis.
Mens dataene er klare, at fistler med lavt output har en øget rate af spontan lukning, er det mindre klart, at en reduktion af outputvolumenet vil forbedre fistellukningen. Ikke desto mindre kan en nedsættelse af outputmængden i væsentlig grad lette byrden ved fistelbehandling og have en positiv indvirkning på patientens velbefindende.
Sårbehandling
Måske er et af de mere udfordrende og ressourcekrævende aspekter af ECF-behandling den lokale kontrol af udflåd. Succesenteriske vi kan hurtigt nedbryde huden og forårsage irritation, som er vanskelig at behandle. Derfor er en passende hudbehandling med barrierecremer, fugtbarrierer, sækkemidler og sugeapparater af afgørende betydning. Især fistler med højt output kræver ofte et indviklet netværk af dræn, poser og sugeapparater for at kontrollere udflåddet tilstrækkeligt. Højt specialiserede sårplejehold og enterostomaterapeuter er uvurderlige for både sårbehandling og patientens komfort.
Med den allestedsnærværende brug af undertryksbehandling (NPT) til behandling af sår og åbne maver er det ikke overraskende, at NPT er blevet en del af det kirurgiske armamentarium til behandling afECF. I den hidtil største serie rapporterede Wainstein et al. om deres erfaringer med 91 patienter med fistler med højt output, der blev behandlet med et negativt tryk på mellem -350 og -600 mmHg. Ud over en betydelig reduktion af udstrømningsmængden fra et gennemsnit på 1400 cc/dag til 138 cc/dag blev der opnået spontan lukning hos 46 % af patienterne.I 2016 offentliggjorde Misky et al. en metaanalyse, der undersøgte brugen af NPT i ECF. Ved hjælp af ti retrospektive undersøgelser med i alt 151 patienter fandt disse forfattere, at medianraten for spontan lukning var 65 % (varierende fra 7 %-100 %) med en mediantid til lukning på 58 dage. Disse forskere rapporterede også en ny fistelrate på 4,4 % – en kendt komplikation, som har givet nogle behandlere betænkeligheder.Selv om der helt klart er behov for yderligere undersøgelser for at fastslå, om NPT definitivt kan forbedre lukningsprocenten for ECF eller reducere tiden til spontan lukning, bør man ikke overse de positive fordele ved disse forbindinger. I det mindste kan denne teknologi gøre forvaltningen af ECF lettere ved at kontrollere udflåd, beskytte huden og mindske hyppigheden af forbindingsskift.
Tabel 3

| Investigatører | Institutionel praksis |
|---|---|
| Hollington | 8 måneder |
| Evenson | 4 måneder |
| Rahbour | 12 måneder |
| Datta | 6 måneder |
| Lynch | 6 måneder |
| Li | 6 måneder |
| Mcintyre | 6 måneder |
Tabel 3: Tidsforløb til endelig behandling.
Tabel 3
Tidspunkt for endelig behandling.
Næring
VurderingNæringsstatus for en ECF-patient er af afgørende betydning. Før fremkomsten af peptidbaserede enterale formler og total parenteral ernæring (TPN) belyser retrospektive historiske serier byrden af underernæring hos ECF-patienter. I en serie på 157 patienter i 1950’erne og 1960’erne var næsten 75 % af patienterne med proksimale fistler underernærede. Lignende resultater blev rapporteret af Chapman et al., som fandt, at kun et lille mindretal af patienterne havde optimal ernæring, og at når ernæringen blev forbedret, faldt den ECF-relaterede dødelighed fra 55 % til 12-16 %.
Der bør foretages en fuldstændig ernæringsvurdering af alle patienter med ECF. Selv om Harris-Benedict-ligningen er et godt udgangspunkt for beregning af ernæringsbehovet, er det almindeligt accepteret, at ECF-patienter er kataboliske og hypermetaboliske.Generelt har disse patienter brug for øget kalorieunderstøttelse med mindst 25-30 kcal/kg/dag i kulhydrater og fedt og 1,5 til 2 gram protein/kg/dag.
Næringsstatus og fremskridt bør revurderes med jævne mellemrum. Ud over den daglige vægt bør der følges regelmæssige ernæringslaboratorier som f.eks. albumin, præalbumin, overførsel og CRP.Især har det vist sig, at præoperativt albumin er den stærkeste forudsigelse af dødelighed og morbiditet efter almen kirurgi, og hypoalbuminæmi er fortsat en væsentlig forudsigelse af dårlige resultater hos ECF-patienter . Det måske mest undersøgte protein i ECF er imidlertid transferrin, og niveauer på over 140 er blevet forbundet med øget spontan lukning og reduceret dødelighed . Selv om kvælstofbalancen kan være et nyttigt redskab, kan denne standardmåling være vanskelig hos patienter med fistler med højt output. Yderligere tests som f.eks. indirekte kalorimetri kan overvejes i mere komplekse tilfælde, der ikke reagerer på standardbehandling.
Parenteral vs. enteral ernæring
Parenteral ernæring har spillet en afgørende rolle i behandlingen af ECF, idet brugen af den blev fast etableret af Dudrick i 1969.I sin sentinelartikel, der beskrev den optimale behandling af TPN, konkluderede Dudrick, at: “Ved udelukkende at anvende parenteral hyperalimentation opnås regelmæssigt vægtøgning, positiv kvælstofbalance, vækst og udvikling” . Siden da er TPN blevet vedtaget universelt som et middel til at tilvejebringe ernæring, samtidig med at man fremmer “tarmropause” og forenkler håndteringen af udflåd.Mens TPN reducerer GI-sekret med 30-50 % og dermed reducerer forekomsten af dehydrering og elektrolytforstyrrelser, er der ingen randomiserede undersøgelser, der behandler virkningen af TPN på anabolsk omdannelse, spontan lukning eller dødelighed. Ikke desto mindre er TPN fortsat en populær langtidsbehandlingsform på trods af alvorlige komplikationer, herunder infektion og leverdysfunktion.
På det seneste er brugen af enteral ernæring i ECF imidlertid blevet mere og mere udbredt. Anvendelsen af enteral ernæring har en række fordele, herunder færre omkostninger, færre infektioner og forbedret immunologisk funktion sammenlignet med TPN . Desuden kan selv en tilførsel af så lidt som 20 % af kalorierne ad enteral vej bidrage til at opretholde tarmfloraen og mindske bakterietranslokationen .
Flere serier har rapporteret om overraskende succes med enteral ernæring hos ECF-patienter. I en retrospektiv serie af Li et al. blev 86,4 % af 1168 patienter håndteret effektivt med enteral støtte.Enteral ernæring kan endda med succes anvendes i forbindelse med fistler med højt output, når den kombineres med elementære formler, antimotilitetsmidler og fiberfyldningsmidler. I en serie på 335 patienter med høj outputfistler kunne Levy et al. med succes opnå TPNuafhængighed hos 85 % af deres kohorte ved hjælp af enteral ernæring. Det er interessant, at på trods af enteral ernæring og manglen på “tarmhvile”, var mortaliteten og antallet af spontane lukninger lig med tidligere serier.
I forbindelse med en ECF med høj output med en distal mucocutane lem kan fistuloklyse være et vigtigt supplement til standard enteral ernæring. Praksis med fistuloklyse stammer fra praksis med at fodre med chymus hos nyfødte og kan enten henvise til genfodring af succes eller supplering af yderligere enteral sondeernæring via et kateter placeret i den distale del af en ECF. Teubner et al. beskrev første gang fistuloklyse som en behandling af ECF i 2004 i en caseserie af 12 patienter med proximale fistler. Siden da har en række caserapporter og små serier vist denne tekniks ernæringsmæssige effektivitet. Sammenlignet med en matchet kohorte af patienter, der modtog TEN uden fistuloklyse, havde patienter med højproduktionsfistler, der blev behandlet med fistuloklyse, signifikant forbedrede leverfunktions- og ernæringsparametre . Fistuloklyse kan være særlig nyttig hos patienter, der udvikler TPN-relaterede komplikationer, herunder infektioner, problemer med venøs adgang eller leversvigt. Komplikationer kan imidlertid forekomme og kan omfatte obstruktion, hvis den peristaltiske aktivitet i tyndtarmen fører fistelkateteret distalt ind i tyndtarmen.
Vitaminer og mineraler er ofte udtømt hos ECF-patienter.Mangel på fedtopløselige vitaminer er almindeligt, mens mangel på vandopløselige vitaminer er sjældent, medmindre fistlen er i den nære jejunum. Da B12-vitamin kun optages i de sidste 50-60 cm af ileum, kan det desuden være nødvendigt med injicerbar B12-vitamin hos mange ECF-patienter. Magnesium går ofte til spilde i fistler med højt output og bør suppleres med enten intravenøst magnesiumsulfat eller oral magnesiumklorid for at forbedre den enterale absorption. Endelig er det blevet anbefalet at tilføre både zink og C-vitamin i høje doser. Omega-3 og fiskeolie er blevet undersøgt på intensivafdelinger med en vis fordel, men disse kosttilskud er aldrig blevet evalueret hos ECF-patienter og anvendes ikke rutinemæssigt.
Operative overvejelser
Raten for spontan lukning af ECF varierer mellem 15 og 75 % i litteraturen. Denne brede vifte af lukningsprocenter afspejler sandsynligvis forskelle i patientpopulationer og institutionelle praksismønstre . Fistler er betydeligt mindre tilbøjelige til at lukke spontant efter 4 uger, og kun 10 % af fistlerne lukker efter to måneder . Fordi antallet af spontane lukninger af ECF er lavt, er kirurgisk indgreb ofte den eneste endelige behandlingsstrategi.
Den beslutning om at operere en ECF bør imidlertid ikke tages for let, da recidivraten efter ECF-lukning varierer fra 13 til 34% . Selv om principperne for kirurgisk indgreb i forbindelse med ECF omfatter mange af de centrale principper for almen kirurgi, er tiden til operation måske den vigtigste faktor at tage hensyn til. Fazioet al. påviste betydningen af forventningsfuld behandling af ECF-patienter. Når operationen fandt sted mindre end 6 uger fra tidspunktet for dannelsen af ECF, var dødeligheden over 20 %. Ved at udskyde operationen mere end 6 uger faldt dødeligheden imidlertid til 11 %.Desuden medfører en tidlig operation muligvis en øget risiko for recidiv. I en serie af Lynch et al. havde patienter, der blev opereret mellem 2 og 12 uger efter ECF-dannelsen, en recidivrate på 28%, mens en forsinkelse på mere end 12 uger reducerede denne rate til 15% . Tabel 3 viser, hvor lang tid ekspertforfattere foreslår at vente, før man overvejer et operativt indgreb i forbindelse med en ikke-helende ECF.
Operativ behandling bør kun foretages med fuld investering og forståelse fra både patientens og kirurgens side. ECF-lukninger er lange, teknisk udfordrende tilfælde med risiko for betydelige komplikationer. Operationer kræver ofte fuldstændig mobilisering af tarmen fra Treitz’ ligament til rektum.I betragtning af at 36 % af tilbagevendende fistler er resultatet af skader, der er opstået under ECF-lukningsoperationen, bør man være meget omhyggelig under hele lysis af adhæsioner for at undgå utilsigtet skade på den sunde tarm. Behandlingen af den fistuløse tarm bør altid omfatte en tarmresektion og en primær astomose. Over syning eller kantresektion af fistlen resulterer uvægerligt i en højere recidivrate (36% vs. 16%) .
Konklusion
Enterokutane fistler er en af de mest udfordrende komplikationer, som den almene kirurg står over for. Anvendelse af en omhyggelig, systematisk og patientcentreret tilgang vil bidrage til at maksimere de vellykkede kliniske resultater. På trods af konsistensen af principperne for ECF-behandling på tværs af patienterne er hver fistel unik, og dens behandling defineres i høj grad af dens output samt dens placering og patientens co-morbiditeter. Selv om både kirurger og patienter kan have et stærkt ønske om at fortsætte med kirurgisk lukning, er patienterne bedst tjent med mindst 6 måneders ikkeoperativ behandling. I sidste ende kræver langtidspleje af ECF-patienter multidisciplinær behandling, som ofte koordineres af kirurgen.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. En 11-årig erfaring med enterokutane fistler. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Behandling af enterokutane fistler: 30 års klinisk erfaring. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Behandling af enterokutane fistler: En gennemgang af 132 tilfælde. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Gennemgang af 404 patienter med gastrointestinale fistler. Virkning af parenteral ernæring. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Syv års erfaring med enterokutane fistler med univariat og multivariat analyse af faktorer forbundet med heling: udvikling af et valideret scoringssystem. Colorectal Dis. 2013;15;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimering af behandlingen af øvre gastrointestinale fistler. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Ernæring og behandling af enterokutane fistler. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Klassifikation og patofysiologi af enterokutane fistler. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Patofysiologi af enterokutane fistler. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterokutane fistler: forbedres behandlingen? Kirurgi. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematisk behandling af postoperative enterokutane fistler: faktorer relateret til resultater. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. En multivariat model til bestemmelse af prognostiske faktorer i gastrointestinale fistler. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historiske perspektiver i behandlingen af patienter med enterokutane fistler. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterokutan fistel som komplikation til traume-laparotomi: En stor ressourcebyrde. Am Surg. 2009;75;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteriske fistler: principper for håndtering. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterokutane fistler: Beviste strategier og opdateringer. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37;37:173-84.
- Evenson AR, Fischer JE. Aktuel behandling af enterokutane fistler. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Behandling af tarmfistler. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: International guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Rolle af somatostatin-14 og dets analoger i behandlingen af gastrointestinale fistler: kliniske data. Gut. 2001;49;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Behandling af enterokutane fistler med højt output med en vakuumkomprimeringsanordning. En tiårig erfaring. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Eksterne fistler, der opstår fra mave-tarmkanalen. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metabolisk og ernæringsmæssig støtte til enterokutane fistelpatienter: en trefaset tilgang. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Præoperativt serumalbuminniveau som en prædiktor for operativ mortalitet og morbiditet: resultater fra National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Faktorer, der forudsiger tilbagefald og dødelighed efter kirurgisk reparation af enterokutane fistler. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Kan intravenøs ernæring som eneste ernæringsmiddel støtte væksten hos et barn og genoprette vægttab hos en voksen? Et bekræftende svar. Ann Surg. 1969;169;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral ernæring hos kritisk syge patienter: en opdateret systematisk gennemgang og metaanalyse af randomiserede kontrollerede forsøg. Crit Care. 2016;20;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloklyse kan med succes erstatte parenteral ernæring i forbindelse med ernæringsstøtte til patienter med enterokutan fistel. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloklyse forbedrer leverfunktionen og ernæringstilstanden hos patienter med højudgående øvre enterisk fistel. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Håndtering af enterokutane fistler. Surg Clin North Am. 2011;91;91:481-91.
- Haffejee AA. Kirurgisk behandling af enterokutane fistler med højt output: en 24-årig erfaring. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operativ kirurgi for enterokutane fistler. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Klinisk resultat og faktorer, der forudsiger tilbagefald efter enterokutan fistelkirurgi. Ann Surg. 2004;240;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Håndtering af eksterne gastrointestinale fistler. Ann Surg. 1978;188:460-7.