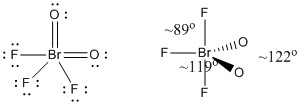Intermediate uorganisk kemi
University of Rhode Island
Høst 2013
Eksamen 1
1. Skriv elektronkonfigurationen (ved hjælp af sjældne gasnotationer for lukkede skaller) og grundtilstandens term-symbol for følgende: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Kun 3d-elektronen bidrager til termsymbolet: L = 2 og S = ½ giver 2D
b) Sc+
3d2
L = 3 og S = 1 giver 3F
c) Sc2+
3d1
L = 2 og S = ½ giver 3F
c) Sc2+
3d1
L = 2 og S = ½ giver 2D
d) Sc3+
L = 0 og S = 0, hvilket giver 1S
d) Sc-
4s23d2
L = 3 og S = 1, hvilket giver 3F
2. Skriv Lewis-punktstrukturen, angiv de formelle ladninger på alle atomer, forudsig den molekylære geometri, estimat af alle bindingsvinkler og angiv den sandsynlige hybridorbital for følgende: a) BrO2-; b) BrO3-; c) BrO2F3.
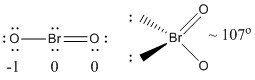
a) BrO2-
Lewisstruktur:
Formelle ladninger er angivet på Lewis-strukturen
Struktur: bøjet planar med en bindingsvinkel på ~107°
Hybridorbital på Br: sp3
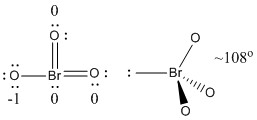
b) BrO3-
Lewis-struktur: BrO3-
Lewis-struktur:
Formelle ladninger er angivet på Lewisstrukturen
Struktur: pyramidal med bindingsvinkler O-Br-O ~108°
Hybridorbital på Br: sp3
c) BrO2F3
Lewisstruktur:
Lewisstruktur:
Hybridorbital på Br: sp3
Formelle ladninger er angivet på Lewisstrukturen
Struktur: trigonal bipyramidal med bindingsvinkler vist i figuren
Hybridorbital på Br: dsp3
3. Et atomets absolut hårdhed er defineret som η = ½(IP – EA), IP er ioniseringspotentialet og EA er elektronaffiniteten. Forudsig de periodiske tendenser for η, og begrunder din forudsigelse.
For næsten alle atomer er IP >> EA, så η vil følge de periodiske tendenser for IP: stigende, når man bevæger sig til højre i det periodiske system (efter Z*), og svagt faldende, når man bevæger sig nedad i det periodiske system, efterhånden som atomradius stiger.
4. Cr2 har en elektronkonfiguration σ2π4δ4δ4δ*2. Hvad er bindingsrækkefølgen, og hvor mange uparrede spins er forudsagt? Ville du forvente, at Cr2 vil absorbere lys i det synlige område af spektret? Hvorfor eller hvorfor ikke?
Bindingsordenen = ½(2 + 4 + 4 + 4 – 2) = 4 med 2 uparrede spins (da der er 2 δ-orbitaler, må der også være 2 δ*-orbitaler, som hver har én elektron baseret på Hunds regler). Den sideløbende overlapning af d-orbitaler til dannelse af δ-orbitaler er dårlig, så opdelingen mellem δ- og δ*-orbitalerne vil være lille. Dette tyder på, at den energi, der kræves for at flytte en elektron fra HOMO’en til LUMO’en, også er lille, hvilket forudsiger en absorption i den synlige del af spektret.