ATP, NAD OG FAD
ATP
Cellerne bruger et molekyle kaldet Adenosin Triphosphat (eller ATP) som energikilde (se figur 2). Fosfaterne i dette molekyle kan levere energi til substrater i vores celler. Der findes enzymer i vores celler, som kan fjerne et fosfat fra ATP og binde det til et andet molekyle – sædvanligvis et protein (se figur 3). Når dette sker, siger vi, at proteinet er blevet fosforyleret. Tænk på det tredje fosfat som værende en lille sæk med energi. Når det overføres til et protein, kan denne energi bruges til at gøre noget. I figur 3 ændrer proteinet f.eks. sin form, når det bliver fosforyleret. Når proteiner ændrer form, kalder vi det ofte en konformationsændring i proteinstrukturen. Der er mange proteiner i kroppen, der bruger et fosfat fra ATP til at fremkalde en konformationsændring. Denne ændring af proteinets form giver i sidste ende mulighed for ting som muskelkontraktion, cellemobilitet, membrantransport og enzymvirkning. Celler og liv eksisterer kun, hvis der er en konstant og jævn forsyning af ATP til rådighed.
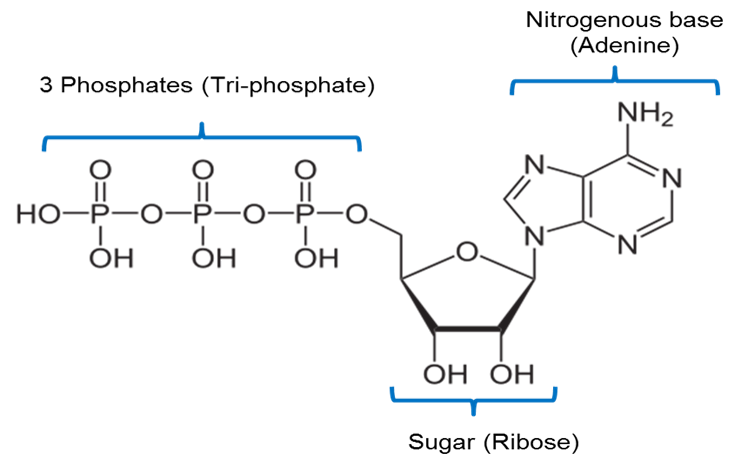
Billede skabt af JS at BYU Idaho F2013.
Billedet ovenfor er en gengivelse af den kemiske struktur af ATP. ATP indeholder en nitrogenbas kaldet adenin, der er forbundet med et 5-kulstofsukker kaldet ribose og 3 fosfatgrupper.
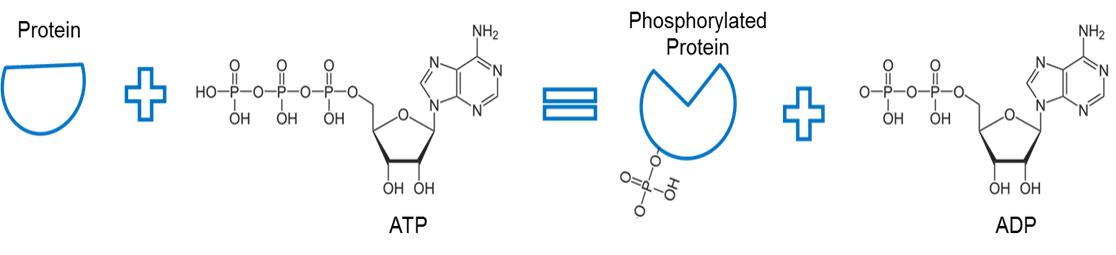
Billede skabt af JS at BYU Idaho F2013.
ATP bruges til at fosforylerer et protein. Et enzym, kaldet en kinase (ikke vist), fjerner et fosfat fra ATP og muliggør en binding mellem fosfatet og et andet protein. Bindingen af et fosfat til et protein på denne måde kaldes fosforylering. Fosfatbindingen med proteinet har højere energi. Bemærk, at fosforylering bruger denne energi til at forårsage en konformationsændring af proteinets form.
NAD og FAD
Nicotinamid Adenin Dinucleotide (NAD) og Flavin Adenin Dinucleotide (FAD) er coenzymer, der er involveret i reversible oxidations- og reduktionsreaktioner. Det anføres ofte, at disse forbindelser er elektronbærere, fordi de accepterer elektroner (bliver reduceret) under kataboliske trin i nedbrydningen af organiske molekyler som f.eks. kulhydrater og lipider. Derefter kan disse reducerede coenzymer donere disse elektroner til en anden biokemisk reaktion, der normalt er involveret i en proces, der er anabolsk (som f.eks. syntese af ATP).
NAD+ / NADH
Nicotinamid Adenin Dinucleotide i oxideret tilstand kaldes NAD+, efter at være blevet reduceret (eller acceptere elektroner), kaldes det NADH. Se figur 4 for en molekylær illustration. Vitamin Niacin (også kaldet B3) anvendes til at udlede denne forbindelse. Niacin giver den organiske ringstruktur, der direkte deltager i overførslen af et hydrogenatom og 2 elektroner. NAD+ findes ofte sammen med et “dehydrogenase”-enzym. En dehydrogenasereaktion fjerner to hydrogenatomer; et som hydrid (:H-) (et hydrid er et hydrogenatom med 2 elektroner) og et som hydrogenkation (H+) (og naturligvis har et hydrogenkation ingen elektroner). Hydridet binder sig til NAD+ og danner en reduceret forbindelse af Nictinamid Adenin Dinucleotide (NADH). Det andet hydrogenatom (H+) frigives til opløsningen se figur 4.
Når du undersøger reaktionerne for metabolisme, skal du kigge efter reaktioner, der giver NADH. NADH vil være vigtigt, da det vil levere de hydrogener og elektroner, som det opsamler, til biokemiske processer, der kan bruge elektronerne og hydrogenerne til at fremstille ATP.
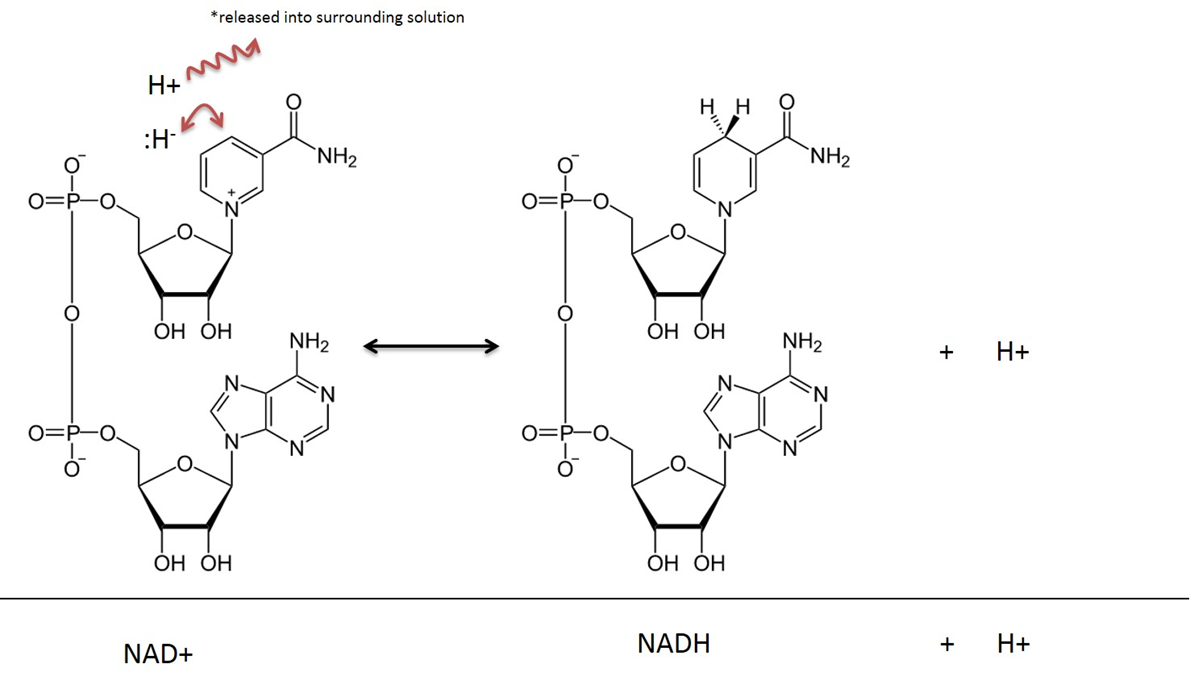
Billede skabt af JS at BYU Idaho F2013.
I metaboliske reaktioner, der involverer NAD, fjernes to hydrogenatomer og to elektroner fra et substrat og overføres til NAD+. NAD+ accepterer en hydridion (et hydrogen med 2 elektroner) og bliver til nikotinamid-adenin-dinukleotid i reduceret form (NADH). Den hydrogenkation, der også er fanget i reaktionen, frigives til den omgivende opløsning. Husk, at denne reaktion er reversibel.
I forklaringen af reaktioner, der forekommer i stofskiftet, er det almindeligt at se bort fra det H+, der frigives i opløsningen, og i denne tekst vil resultatet af NAD-reduktionen blive afbildet som blot NADH og ikke som NADH + H+.
FAD / FADH2
Flavinadenindinukleotid i sin oxiderede tilstand kaldes FAD. Efter at være blevet reduceret kaldes det FADH2. Se figur 5 for en molekylær illustration. Vitaminet riboflavin (eller B2) anvendes til at udlede denne forbindelse. Riboflavin tilvejebringer de ringstrukturer, der vil deltage direkte i overførslen af to hydrogenatomer (hver med én elektron denne gang). I lighed med NAD arbejder FAD i forbindelse med et “dehydrogenase”-enzym. Reaktionen fjerner to hydrogenatomer; hver en proton med en elektron. Begge brintatomer bindes til FAD. Denne reaktion frigiver ikke et H+ til opløsningen, som reduktionen af NAD gør.
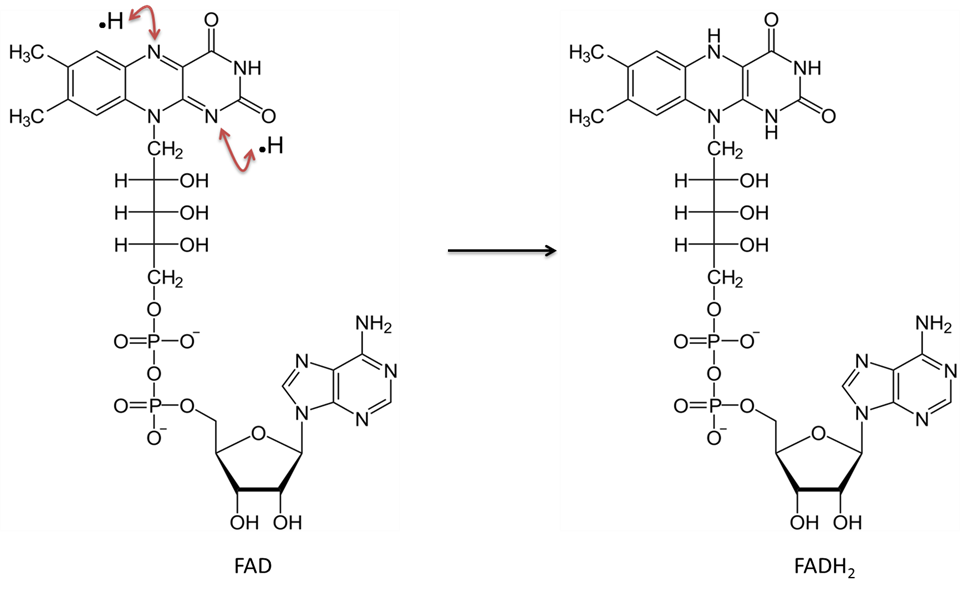
Billede skabt af JS på BYU Idaho F2013.
Flavin adenin dinukleotid i den oxiderede form (FAD) accepterer to hydrogenatomer (hver med en elektron) og bliver til FADH2.
Når du undersøger reaktionerne for stofskiftet, skal du kigge efter en reaktion, der giver FADH2. I lighed med NADH vil FADH2 være vigtig, da det vil levere hydrogener og elektroner til biokemiske processer, der kan bruge elektronerne og hydrogenerne til at fremstille ATP.
**Du kan bruge knapperne nedenfor til at gå til næste eller forrige læsning i dette modul**

