I den cellemedierede del af det adaptive immunrespons bindes korte peptider af MHC-klasse I- og klasse II-molekyler (Major Histocompatibility Complex) og præsenteres på celleoverfladen, hvor de genkendes af T-lymfocytternes antigenreceptorer. Binding af en T-celle-receptor (TCR), der genkender et bestemt MHC-peptidkompleks, får naive lymfocytter til at differentiere sig til effektorceller (cytotoksiske og hjælper-T-celler), der ødelægger inficerede værtsceller eller stimulerer antistofproduktionen, og hukommelsesceller, der giver beskyttende immunitet mod reinfektion.
Struktur og funktion af MHC-molekyler
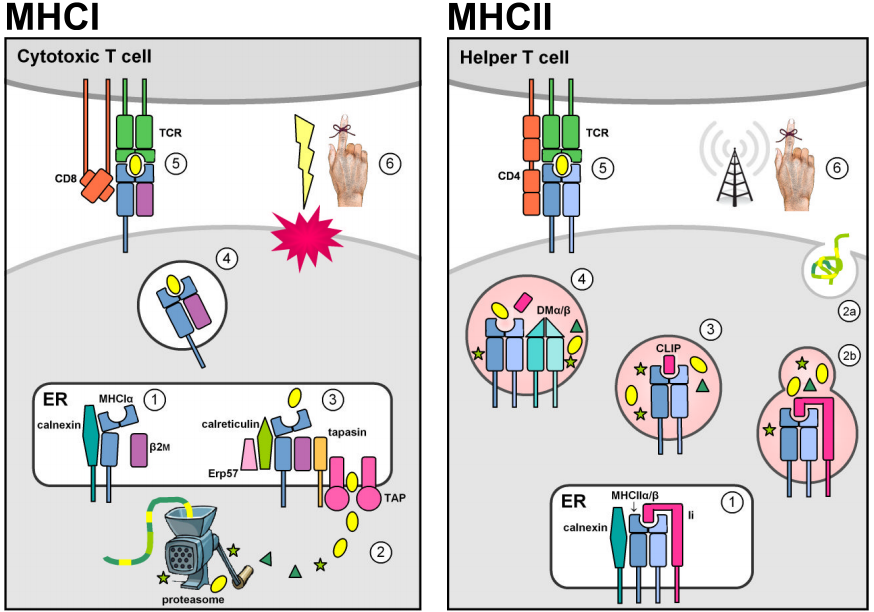
To multigenfamilier, der er placeret i MHC-genomregionen, koder for antigenbindende molekyler, der præsenterer fremmede peptider på celleoverfladen. I virkeligheden præsenterer MHC-molekyler også selvfremstillede peptider. Negativ thymisk selektion mod autoreaktive T-celler forhindrer imidlertid MHC-selv-peptidkomplekser i at fremkalde et immunrespons. MHC-klasse I-molekyler udtrykkes på de fleste kerneceller og indeholder typisk endogene peptider, der stammer fra intracellulære patogener, der replikerer i cytosolen (f.eks. virus). Cytosolproteiner nedbrydes til korte peptidfragmenter af proteasomet og transporteres først ind i det endoplasmatiske retikulum (ER) af de ATP-afhængige transportører TAP1 & 2 til MHCI-belastning og derefter til celleoverfladen til præsentation for cirkulerende cytotoksiske CD8+ T-celler, hvis funktion er at fremkalde apoptose og lysis af den inficerede målcelle. (Figurerne er tilpasset fra Murphy et al. (2008) Fig. 3.12, 3.25, 5.5, & 5.11.)
Konstitutiv ekspression af MHC klasse II loci er begrænset til antigenpræsenterende celler i immunsystemet (APC’er, f.eks. makrofager, dendritiske celler og B-lymfocytter). MHCII-molekyler stabiliseres og forhindres i at binde antigener, mens de befinder sig i ER’et, gennem associering med den invariante klasse II-kæde (Ii, eller CD74), og omdirigeres derefter fra den sekretoriske standardvej til den endocytiske vej. Her møder de peptider, der stammer fra patogener, som replikerer i intracellulære vesikler eller fra ekstracellulære patogener og proteiner, der transporteres ind i cellen. Stabil peptidbinding katalyseres af den ikke-klassiske MHCII DMα/β-dimer og gør det muligt for MHCII-peptidkomplekser at slippe ud af den endocytiske vej for at blive præsenteret på celleoverfladen. Genkendelse af CD4+ T-celler aktiverer målværtscellen for at stimulere antibakterielle mekanismer (i makrofager) eller for at udløse antistofproduktion og det humorale immunrespons.
Strukturelle ligheder mellem MHCI- og MHCII-molekyler afspejler sandsynligvis deres afstamning fra en fælles forfader. Modne MHC-molekyler er integrale membranglykoproteiner af type I, der består af en peptidbindende rille og immunoglobulinlignende, transmembran- og cytoplasmiske domæner. De ekstracellulære dele af MHC-molekyler består af to membrandistale domæner, der tilsammen danner et peptidbindende hulrum, der er afgrænset af to afbrudte α-helixer, der hviler på toppen af et antiparallelt β-ark, og to membranproximale immunoglobulinlignende (Ig-lignende) domæner, der deltager i CD4- og CD8-coreceptorbinding.
Trods disse strukturelle ligheder er proteinunderenhederne kodet forskelligt for klasse I- og II-molekyler. MHCI-molekyler er heterodimere, der dannes ved ikke-kovalent association mellem en MHCIα tung kæde og β2-mikroglobulin (β2m), som er kodet af et stort set invariant locus, der ligger uden for MHC-genomregionen. Den tunge kæde bidrager med både den peptidbindende kløft og et af de Ig-lignende domæner, mens β2m kun bidrager med et andet Ig-lignende område, som mangler et transmembrananker. MHC-klasse II-molekyler er heterodimere, der dannes ved ikke-kovalent sammenslutning af en α- og β-kæde, som begge bidrager med enkelte peptidbindende og membranforankrede Ig-lignende domæner, og som hver især transskriberes fra et særskilt locus, der typisk findes inden for MHC-regionen.
MHC-genfamiliens medlemmer kan yderligere underopdeles i klassiske eller ikke-klassiske loci, foruden ikke-funktionelle pseudogener. Klassiske MHC Ia loci er bredt udtrykt og er typisk forbundet med høj sekvensvariabilitet og positiv selektion, der virker på substitutioner ved peptidbindingsregionens (PBR) rester. Ikke-klassiske MHC Ib-loci har i stedet reduceret ekspression eller begrænset vævsfordeling, lavere polymorphisme og kan have begrænsede eller modificerede funktioner. For klasse II-gener henviser “klassisk” typisk til alle antigenpræsenterende loci, mens udtrykket “ikke-klassisk” er forbeholdt gener som DMα/β, der tjener accessoriske roller i antigenpræsentationsvejen. Selv om denne funktionelle kategorisering af genfamiliens medlemmer giver et nyttigt arbejdsordforråd, er grænsen mellem klassiske og ikke-klassiske loci ikke altid klar i praksis, og nogle ikke-klassiske MHCI-loci er polymorfe, bredt udtrykte eller binder peptidiske ligander på traditionel vis til klassiske gener.
Ekstrem polymorfisme på populationsniveau og tegn på balancerende selektion tyder på, at der sandsynligvis er behov for en betydelig allelisk variation af MHC-gener for at kunne genkende og reagere på en forskelligartet samling af patogener. På trods af omfattende genduplikation i nogle arter udtrykker individer imidlertid typisk kun et moderat antal klassiske MHC-loci, og tilbagevenden til disomisk nedarvning er også observeret i nogle polyploide Xenopus-arter. Begrænsninger i den intra-individuelle MHC-variation (i det mindste for stærkt udtrykte klassiske loci) menes at afspejle en funktionel afvejning mellem at øge det alleliske repertoire for at præsentere et større udvalg af patogene peptider og den ledsagende reduktion i T-celle-repertoiret, som ville være nødvendig for at opretholde selvtolerance. De enkelte MHC-molekyler skal derfor være i stand til at binde peptider på en permissiv måde for at kunne genkende et bredt spektrum af fremmede antigener på passende vis. Der er imidlertid også behov for at generere stabile MHC-peptidkomplekser, som vil bestå i tilstrækkelig lang tid til at muliggøre T-cellegenkendelse, og som ikke vil udveksle peptider på celleoverfladen, hvilket kunne resultere i ødelæggelse af uinficerede celler. En sådan stabilitet er generelt forbundet med intermolekylære interaktioner med høj affinitet og dermed restriktive intermolekylære interaktioner.
MHC-molekyler forener disse konkurrerende bindingskrav ved hjælp af en elegant strukturel løsning: Kontakter mellem stærkt bevarede rester i MHC-molekylets peptidbindingsregion (PBR) og hovedkædeatomer i peptidet stabiliserer den promiskuøse binding af de fleste peptidligander, mens polymorfe rester, der beklæder den peptidbindende rille, skaber uregelmæssige lommer med forskellig stereokemi, der kan rumme peptidrester på en sekvensafhængig måde. Begrænsninger, der pålægges af sidekædebindende lommer, varierer både mellem alleler og mellem lommer inden for et enkelt MHC-molekyle. Lommer, der pålægger mere strenge bindingskrav, siges at rumme “primære anker”-peptidrester, mens “sekundære ankre” er mere fleksible i deres bindingspræferencer. Tilsammen bestemmer disse specificiteter det peptidbindende motiv for en bestemt MHC-allel, som giver selektivitet ved antigenpræsentation.