Generisk navn: naftifine hydrochloride
Doseringsform: gel
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. april 2020.
- Overblik
- Bivirkninger
- Dosering
- Professionel
- Graviditet
- Mere
- Indikationer og Anvendelse for Naftin Gel
- Naftin Gel Dosering og administration
- Doseringsformer og styrker
- Kontraindikationer
- Varsler og forholdsregler
- Lokale bivirkninger
- Bivirkninger
- Erfaringer fra kliniske forsøg
- Erfaringer efter markedsføring
- Brug hos særlige befolkningsgrupper
- Graviditet
- Aldring
- Pædiatrisk brug
- Geriatrisk brug
- Naftin Gel Beskrivelse
- Naftin ® Gel – Klinisk farmakologi
- Virkningsmekanisme
- Farmakodynamik
- Farmakokinetik
- Mikrobiologi
- Nonklinisk toksikologi
- Carcinogenese, Mutagenese, Forringet fertilitet
- Kliniske undersøgelser
- Hvordan leveres/opbevares og håndtering
- Patientrådgivning
- PRINCIPAL DISPLAY PANEL – 45g Tube Carton
- PRINCIPAL DISPLAY PANEL – 60 g Tube Carton
- Mere om Naftin (naftifine topisk)
- Forbrugerressourcer
- Ressourcer til fagfolk
- Andre formuleringer
- Relaterede behandlingsvejledninger
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
- Informér patienterne om, at NAFTIN ® Gel er kun til lokal brug. NAFTIN ® Gel er ikke beregnet til oftalmisk, oral eller intravaginal brug.
- Patienterne skal henvises til at kontakte deres læge, hvis der opstår irritation ved brug af NAFTIN ® Gel.
- Bivirkninger
- Under graviditet eller amning
- Dosering Information
- Priser & Kuponer
- En Español
- 3 Anmeldelser
- Generisk tilgængelighed
- Lægemiddelklasse: Aktuel svampedræbende midler
- Patientinformation
- Naftin Topical (Avanceret læsning)
- Oplysningsinformation
- Naftifin (AHFS Monografi)
- Naftin-MP Topical
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Indikationer og Anvendelse for Naftin Gel
NAFTIN ® Gel er et allylaminantifungalt svampemiddel, der er indiceret til behandling af interdigital tinea pedis forårsaget af organismen Trichophyton rubrum, Trichophyton mentagrophytes og Epidermophyton floccosum.
Naftin Gel Dosering og administration
Anvend et tyndt lag NAFTIN ® Gel en gang dagligt på de angrebne områder plus en ca. ½ tomme margen af sund, omgivende hud i 2 uger.
Kun til lokal brug. NAFTIN ® Gel er ikke til oftalmisk, oral eller intravaginal brug.
Doseringsformer og styrker
Gel, 2%. Hvert gram indeholder 20 mg naftifinhydrochlorid i en farveløs til gul gel.
Kontraindikationer
Ingen.
Varsler og forholdsregler
Lokale bivirkninger
Hvis der udvikles irritation eller følsomhed ved brug af NAFTIN ® Gel, skal behandlingen afbrydes.
Bivirkninger
Erfaringer fra kliniske forsøg
Da kliniske forsøg udføres under meget varierende forhold, kan bivirkningsrater observeret i kliniske forsøg med et lægemiddel ikke direkte sammenlignes med rater i kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de rater, der observeres i klinisk praksis.
I to randomiserede, vehicle-kontrollerede forsøg blev 1143 forsøgspersoner behandlet med NAFTIN ® Gel mod 571 forsøgspersoner behandlet med vehicle. Forsøgspersonerne var 12 til 92 år gamle, var primært mænd (76 %) og var 59 % kaukasiske, 38 % sorte eller afroamerikanere og 23 % latinamerikanere eller latinamerikanere. Forsøgspersonerne fik doser en gang dagligt, topisk, i 2 uger for at dække de angrebne hudområder plus en ½-tommers margen af den omkringliggende sunde hud. De mest almindelige bivirkninger var reaktioner på applikationsstedet, som forekom med en hyppighed på 2 % i Naftin Gel-armen mod 1 % i vehicle-armen. De fleste bivirkninger var milde i sværhedsgrad.
I et åbent pædiatrisk farmakokinetik- og sikkerhedsforsøg fik 22 pædiatriske forsøgspersoner i alderen 12-17 år med interdigital tinea pedis Naftin ® Gel. Forekomsten af bivirkninger i den pædiatriske population svarede til den, der blev observeret i den voksne population.
Cumulative irritationstest viste, at NAFTIN ® Gel kan forårsage irritation. Der var ingen tegn på, at NAFTIN ® Gel forårsager kontaktsensibilisering, fototoksicitet eller fotoallergicitet i sund hud.
Erfaringer efter markedsføring
Da disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at foretage et pålideligt skøn over deres hyppighed eller etablere en årsagssammenhæng med lægemiddeleksponeringen. Følgende bivirkninger er blevet identificeret under anvendelse af naftifinhydrochlorid efter godkendelsen: blister, brændende fornemmelse, skorpedannelse, tørhed, erytem/rødme, inflammation, irritation, maceration, smerte, pruritus/kløe, udslæt og hævelse.
Brug hos særlige befolkningsgrupper
Graviditet
Risikoresumé
Der er ingen tilgængelige data om NAFTIN® Gel-brug hos gravide kvinder til at vurdere en lægemiddelassocieret risiko for større fødselsdefekter, abort eller negative moderlige eller føtale resultater.
I reproduktionsundersøgelser på dyr blev der ikke set nogen skadelige virkninger på fosterudviklingen ved orale doser administreret i organogeneseperioden op til 37 gange den maksimale anbefalede humane dosis (MRHD) hos drægtige rotter eller subkutane doser administreret i organogeneseperioden op til 4 gange MRHD hos drægtige rotter eller 7 gange MRHD hos drægtige kaniner ( se Data).
Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre uønskede udfald. Den anslåede baggrundsrisiko for større fødselsdefekter og aborter for den angivne population er ukendt. I den generelle befolkning i USA er den estimerede baggrundsrisiko for større fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 til 4 % og 15 til 20 %.
Data
Data for dyr
Der er udført undersøgelser af systemisk embryofetal udvikling i rotter og kaniner. Til sammenligning af dyre- og humandoser er MRHD fastsat til 4 g 2% gel pr. dag (1,33 mg/kg/dag for et individ på 60 kg).
Orale doser på 30, 100 og 300 mg/kg/dag naftifinhydrochlorid blev administreret i perioden for organogenese til drægtige hunrotter. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på embryofetal toksicitet ved doser op til 300 mg/kg/dag (37 gange MRHD baseret på mg/m 2 sammenligning). Subkutane doser på 10 og 30 mg/kg/dag naftifinhydrochlorid blev indgivet i organogeneseperioden til drægtige hunrotter. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på embryofetal toksicitet ved 30 mg/kg/dag (4 gange MRHD baseret på en mg/m 2 sammenligning). Subkutane doser på 3, 10 og 30 mg/kg/dag naftifinhydrochlorid blev indgivet i organogeneseperioden til drægtige hunkaniner. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på embryofetal toksicitet ved 30 mg/kg/dag (7 gange MRHD baseret på mg/m 2 sammenligning).
Der blev udført en undersøgelse af peri- og postnatal udvikling hos rotter. Orale doser på 30, 100 og 300 mg/kg/dag naftifinhydrochlorid blev administreret til hunrotter fra gestationsdag 14 til amningsdag 21. Der blev konstateret nedsat tilvækst i kropsvægt hos hunnerne under drægtigheden og hos afkommet under laktationen ved 300 mg/kg/dag (37 gange MRHD baseret på sammenligning af mg/m 2). Der blev ikke konstateret udviklingstoksicitet ved 100 mg/kg/dag (12 gange MRHD baseret på mg/m 2 sammenligning).
Aldring
Risikoresumé
Der foreligger ingen oplysninger om tilstedeværelsen af naftifinhydrochlorid i modermælk, lægemidlets virkninger på det ammende barn eller lægemidlets virkninger på mælkeproduktionen efter topisk anvendelse af Naftin Gel til kvinder, der ammer. Det vides ikke, om naftifinhydrochlorid udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når naftifinhydrochlorid administreres til en ammende kvinde.
Den manglende kliniske data under amning udelukker en klar bestemmelse af risikoen Naftin Gel for et spædbarn under amning. Derfor skal de udviklingsmæssige og sundhedsmæssige fordele ved amning overvejes sammen med moderens kliniske behov for Naftin Gel og eventuelle potentielle negative virkninger på det ammede spædbarn fra Naftin Gel eller fra den underliggende moderlige tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af NAFTIN® Gel er blevet fastslået i aldersgruppen 12 til 18 år med interdigital tinea pedis.
Anvendelse af NAFTIN® Gel i denne aldersgruppe understøttes af dokumentation fra tilstrækkelige og velkontrollerede forsøg hos voksne med yderligere sikkerheds- og PK-data fra et åbent forsøg, udført hos 22 unge ≥12 år, som blev udsat for NAFTIN® Gel i en dosis på ca. 4 g/dag .
Sikkerheden og effektiviteten hos pædiatriske patienter <12 år er ikke blevet fastlagt.
Geriatrisk brug
I løbet af de kliniske forsøg blev 99 forsøgspersoner (9 %) på 65 år og derover eksponeret for NAFTIN ® Gel. Sikkerhed og effektivitet svarede til dem, der blev rapporteret af yngre forsøgspersoner.
Naftin Gel Beskrivelse
NAFTIN ® Gel er en klar til gul gel udelukkende til topisk brug. Hvert gram NAFTIN ® Gel indeholder 20 mg naftifinhydrochlorid, en syntetisk svampedræbende allylaminforbindelse.
Kemisk set er naftifin HCl (E)-N-Cinnamyl-N-methyl-1-napthalenemethylaminhydrochlorid.
Molekylformlen er C 21H 21N∙HCl med en molekylvægt på 323,86.
Strukturformlen for naftifinhydrochlorid er :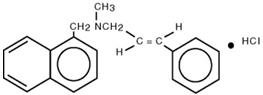
NAFTIN ® Gel indeholder følgende inaktive ingredienser: alkohol, benzylalkohol, edetatdinnatrium, hydroxyethylcellulose, renset vand, propylenglycol, polysorbat 20 og trolamin.
Naftin ® Gel – Klinisk farmakologi
Virkningsmekanisme
NAFTIN ® Gel er et topisk svampedræbende lægemiddel .
Farmakodynamik
Farmakodynamikken for NAFTIN ® Gel er ikke fastlagt.
Farmakokinetik
In vitro og in vivo biotilgængelighedsundersøgelser har vist, at naftifin trænger ind i stratum corneum i tilstrækkelig koncentration til at hæmme væksten af dermatofytter.
Farmakokinetisk analyse af plasmaprøver fra 32 personer med tinea pedis, der blev behandlet med en gennemsnitlig dosis på 3,9 gram NAFTIN ® Gel påført en gang dagligt på begge fødder i 14 dage, viste en øget eksponering i løbet af behandlingsperioden med et geometrisk gennemsnit (CV%) AUC 0-24 (areal under plasmakoncentrations- mod-tidskurven fra tid 0 til 24 timer) på 10,5 (118) ng∙hr/mL på dag 1 og en AUC 0-24 på 70 (59) ng∙hr/mL på dag 14. Akkumulationsforholdet baseret på AUC var ca. 6.
Maximumkoncentrationen (C max) steg også i løbet af behandlingsperioden; geometrisk gennemsnit (CV%) C max efter en enkelt dosis var 0,9 (92) ng/mL på dag 1; C max på dag 14 var 3,7 (64) ng/mL. Median T max var 20,0 timer (interval: 8, 20 timer) efter en enkelt anvendelse på dag 1 og 8,0 timer (interval: 0, 24 timer) på dag 14. Troughplasmakoncentrationer steg i løbet af forsøgsperioden og nåede steady state efter 11 dage. I det samme farmakokinetiske forsøg var den del af dosis, der blev udskilt i urinen i behandlingsperioden, mindre end eller lig med 0,01 % af den anvendte dosis.
I et andet forsøg blev farmakokinetikken af NAFTIN ® Gel evalueret hos 22 pædiatriske forsøgspersoner på 12-17 år med tinea pedis. Forsøgspersonerne blev behandlet med en gennemsnitlig dosis på 4,1 gram NAFTIN ® Gel påført på det angrebne område en gang dagligt i 14 dage. Resultaterne viste, at den systemiske eksponering steg i løbet af behandlingsperioden. Geometrisk gennemsnit (CV%) AUC0-24 var 15,9 (212) ng∙hr/mL på dag 1 og 60,0 (131) ng∙hr/mL på dag 14. Geometrisk gennemsnit (CV%) Cmax efter en enkelt dosis var 1,40 (154) ng/mL på dag 1 og 3,81 (154) ng/mL på dag 14. Fraktionen af dosis, der blev udskilt i urinen i løbet af behandlingsperioden, var mindre end eller lig med 0,003 % af den anvendte dosis.
Mikrobiologi
Virkningsmekanisme
Naftifin er et svampedræbende middel, der tilhører allylamin-klassen. Selv om den nøjagtige virkningsmekanisme mod svampe ikke er kendt, synes naftifinhydrochlorid at gribe ind i sterolbiosyntesen ved at hæmme enzymet squalen 2, 3-epoxidase. Hæmningen af enzymaktiviteten med dette allylamin resulterer i nedsatte mængder af steroler, især ergosterol, og en tilsvarende ophobning af squalen i cellerne.
Mekanisme for resistens
Der er endnu ikke identificeret en mekanisme for resistens over for naftifin.
Naftifin har vist sig at være aktivt mod de fleste isolater af følgende svampe, både in vitro og i kliniske infektioner, som beskrevet i afsnittet INDIKATIONER OG ANVENDELSE:
Nonklinisk toksikologi
Carcinogenese, Mutagenese, Forringet fertilitet
I en 2-årig dermal carcinogenicitetsundersøgelse blev naftifinhydrochloridcreme administreret til Sprague-Dawley rotter i topiske doser på 1%, 2% og 3% (10, 20 og 30 mg/kg/dag naftifinhydrochlorid). Der blev ikke konstateret nogen lægemiddelrelaterede tumorer i denne undersøgelse op til den højeste dosis, der blev evalueret i denne undersøgelse på 30 mg/kg/dag (36 gange MRHD baseret på AUC-sammenligning).
Naftifinhydrochlorid viste ingen tegn på mutagent eller klastogent potentiale baseret på resultaterne af to in vitro genotoksicitetstest (Ames-assay og kromosomaberrationstest af kinesiske hamster-ovariecellekromosomer) og en in vivo genotoksicitetstest (mikronukleus-assay af knoglemarv af mus).
Oral indgift af naftifinhydrochlorid til rotter under parring, drægtighed, fødsel og laktation viste ingen virkninger på vækst, fertilitet eller reproduktion ved doser på op til 100 mg/kg/dag (12 gange MRHD baseret på mg/m 2 sammenligning).
Kliniske undersøgelser
NAFTIN ® Gel er blevet evalueret for effektivitet i to randomiserede, dobbeltblindede, vehicle-kontrollerede multicenterforsøg, der omfattede 1175 forsøgspersoner med symptomatisk og dermatofyte kultur-positiv interdigital tinea pedis. Forsøgspersonerne blev randomiseret til at modtage NAFTIN ® Gel eller et præparat. Forsøgspersonerne påførte naftifinhydrochloridgel 2 % eller vehikel på det berørte område af foden en gang dagligt i 2 uger. Tegn og symptomer på interdigital tinea pedis (tilstedeværelse eller fravær af erytem, pruritus og skældannelse) blev vurderet, og kaliumhydroxid (KOH)-undersøgelse og dermatofytkultur blev udført 6 uger efter den første behandling.
Middelalderen for undersøgelsespopulationen var 45 år; 77 % var mænd; og 60 % var kaukasiere, 35 % var sorte eller afroamerikanere og 26 % var latinamerikanere eller latinamerikanere. Ved baseline blev det bekræftet, at forsøgspersonerne havde tegn og symptomer på interdigital tinea pedis, positiv KOH-undersøgelse og bekræftet dermatofytkultur. Det primære effektmål var andelen af forsøgspersoner med en fuldstændig helbredelse 6 uger efter behandlingsstart (4 uger efter den sidste behandling). Komplet helbredelse blev defineret som både en klinisk helbredelse (fravær af erytem, pruritus og skældannelse) og mykologisk helbredelse (negativ KOH- og dermatofytkultur).
Effektivitetsresultaterne ved uge 6, fire uger efter behandlingens afslutning, er præsenteret i tabel 1 nedenfor.
| Forsøg 1 | Forsøg 2 | |||
|---|---|---|---|---|
| Endpunkt | NAFTIN ® Gel, 2% N=382 n (%) |
Køretøj N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Vehicle N=213 n (%) |
| * Fuldstændig helbredelse er et sammensat endepunkt af både mykologisk helbredelse og klinisk helbredelse. Klinisk helbredelse er defineret som fravær af erytem, pruritus og skældannelse (grad 0). † Effektiv behandling er et negativt KOH-præparat og en negativ dermatofytekultur, erytem, skældannelse og pruritus af grad 0 eller 1 (fraværende eller næsten fraværende). ‡ Mykologisk helbredelse er defineret som negativ KOH- og dermatofytekultur. | ||||
| Komplet helbredelse * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Behandlingseffektivitet † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Mycologisk Cure ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Hvordan leveres/opbevares og håndtering
Hvordan leveres
NAFTIN ® Gel er en farveløs til gul gel, der leveres i sammenklappelige rør i følgende størrelse:
45g – NDC 547189>45g – NDC 54766-772-45
60g – NDC 54766-772-60
Lagring
Lagre NAFTIN ® Gel ved 25°C (77°F); afvigelser er tilladt til 15-30°C (59-86°F) .
Patientrådgivning
Distribueret af Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Alle rettigheder forbeholdes.
PRINCIPAL DISPLAY PANEL – 45g Tube Carton

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Kun til topisk brug
ikke til oftalmisk brug, Oral eller intravaginal brug
45g
Rx Only
PRINCIPAL DISPLAY PANEL – 60 g Tube Carton

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Kun til topisk brug
ikke til oftalmisk brug, Oral eller intravaginal brug
60g
Rx Only
| NAFTIN naftifinhydrochloridgel |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Mærketager – Sebela Pharmaceuticals Inc. (079104574)
| Etablering | ||||
| Navn | Adresse | ID/FEI | ID/FEI | Operationer |
| DPT Laboratories, Ltd. | 832224526 | fremstilling(54766-772), analyse(54766-772), mærkning(54766-772) | ||
Mere om Naftin (naftifine topisk)
Forbrugerressourcer
Ressourcer til fagfolk
Andre formuleringer
Relaterede behandlingsvejledninger
Medicinsk ansvarsfraskrivelse