Azidion: Struktur, egenskaber og substitutionsreaktioner
Azid-ionen (N3- ) er en af de kemiske enheder, der bare ser mærkelig ud.

- Tre nitrogener på række? tjek
- To negative ladninger og en positiv ladning, til en nettoladning på -1 ? tjek
- Stabil? tjek (så længe den behandles skånsomt).
Det viser sig, at azidionen kan være yderst nyttig til at danne C-N-bindinger i nukleofile substitutionsreaktioner.
Indholdsfortegnelse
- Azidionen er en stor nukleofil
- Organiske azider som “maskerede” aminer
- Eksploderer på affyringsrampen
- Nukleofil acylsubstitution med azidsalte: Acyl Azider
- Rearrangement af Acyl Azider: Curtius-omlægning
- Flere eksempler på azid-nukleofile stoffer: Epoxidåbning og konjugeret addition
- Noter
- (Avanceret) Referencer og yderligere læsning
- 1. Azidionen er en stor nukleofil i SN2-reaktioner
- 2. Organiske azider som “maskerede aminer”
- Eksploderer på affyringsrampen
- 4. Nukleofil acylsubstitution med azidsalte giver acylazider
- 5. Omlægning af acylazider: Curtius-omlægning
- Flere eksempler på azidnukleofile: Epoxidåbning og konjugeret addition
- Noter
- (Avanceret) Referencer og videre læsning
1. Azidionen er en stor nukleofil i SN2-reaktioner
Azidionen er den konjugerede base for hydrazoesyre, HN3. På trods af at den kun er svagt basisk (HN3’s pKa er kun 4,6) er N3 en ekstremt god nukleofil – ifølge en måling er den mere nukleofil end enhver amin (se indlæg: Aminers nukleofilihed). Det er ikke svært at rationalisere hvorfor dette kan være, når man stopper op og tænker over det. Med fire nukleofile ensomme par begrænset til et meget lille volumen er sandsynligheden for en kollision med en elektrofil, der resulterer i en reaktion, meget større, end den ville være for en amin med voluminøse alkylgrupper, for blot at tage et eksempel.
Du kan tænke på N3- som et magert, middelmådigt missil med kvælstofspidser, der leverer sin nyttelast på kulstof hurtigt, effektivt og uden væsentlige bivirkninger.
I SN2-reaktioner fortrænges primære og sekundære alkylhalogenider og sulfonater let af N3- , hvilket resulterer i alkylazider:
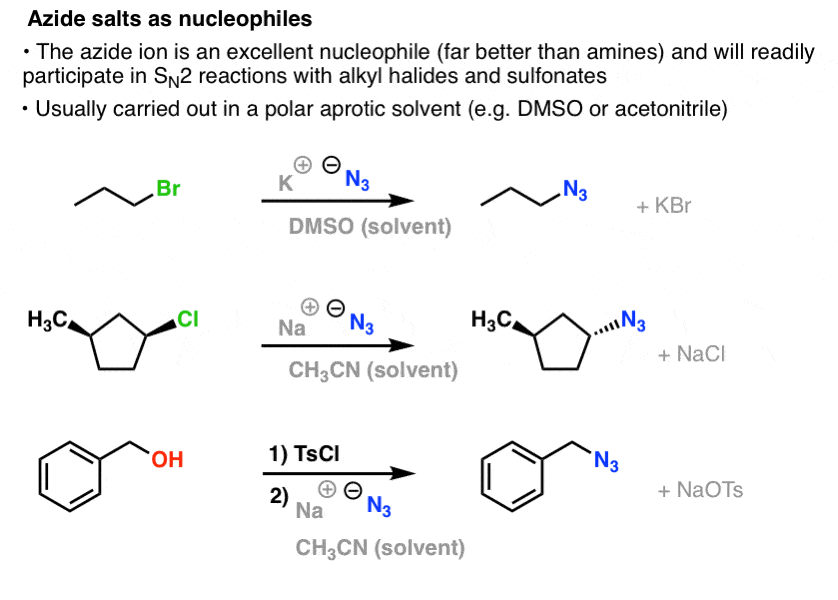
Den sædvanlige fremgangsmåde er at bruge et azidsalt som NaN3 eller KN3 med det passende alkylhalogenid i et polært aprotisk opløsningsmiddel som acetonitril (CH3CN) eller dimethylsulfoxid (DMSO).
De organiske azidprodukter er rimeligt stabile, selv om de ser lidt mærkelige ud. Nogle har endda fundet anvendelse som lægemidler (f.eks. AZT, nedenfor til højre) eller som nyttige sonder til undersøgelse af kemisk biologi. .
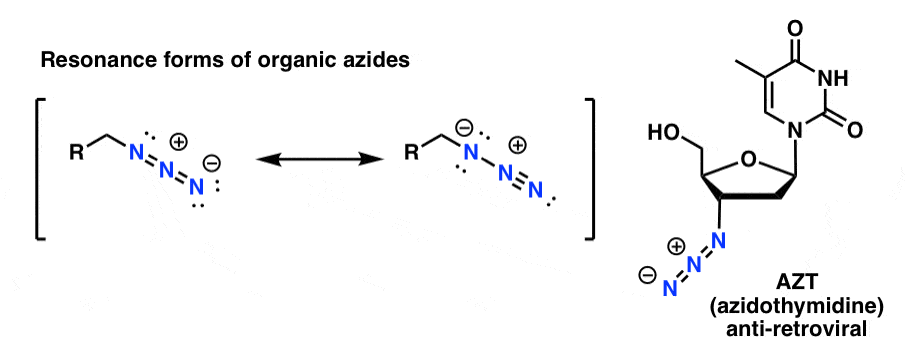
For vores formål er den mest nyttige egenskab ved organiske azider, at de tjener som “maskerede” aminer.
2. Organiske azider som “maskerede aminer”
Bemærk resonansformen ovenfor med en nitrogen-nitrogen-dobbeltbinding. Hvis de behandles med et reduktionsmiddel, såsom LiAlH4 eller endog katalytisk hydrogenering (Pd/C , H2), kan organiske azider reduceres til primære aminer, idet der frigives N2 i processen.
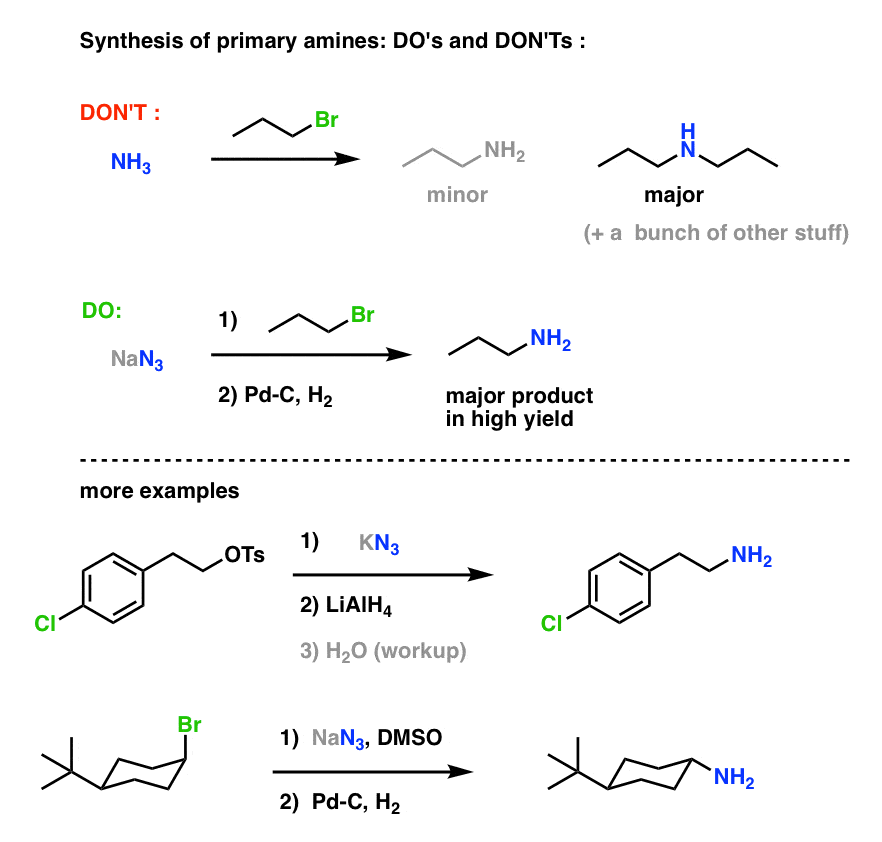
Dette giver en meget nyttig rute til primære aminer fra alkylhalogenider!
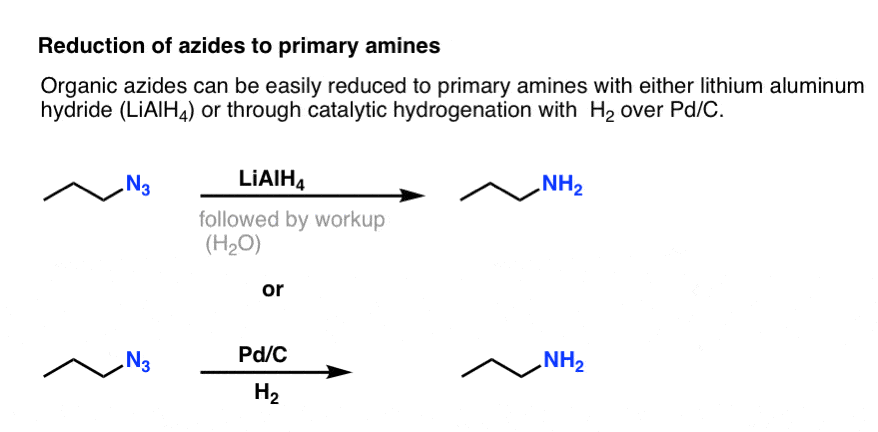
Vi har tidligere udforsket Gabriel-syntesen som en rute til primære aminer , men denne rute er overlegen, fordi azidet kan reduceres til aminen under skånsomme forhold (f.eks. hydrogenering). Ingen af den der højtemperaturspaltning af phthalimidet med hydrazin at bekymre sig om.
Vi så også, at fremstilling af primære aminer ved direkte behandling af alkylhalogenider med NH3 ofte ikke resulterer i det ønskede produkt, fordi af aminer har en Cookie-Monster-lignende tendens til at reagere flere gange med alkylhalogenider: Da aminprodukterne har tendens til at være mere nukleofile end reaktanterne, er det svært at få aminerne til at stoppe med at gnaske kun én alkylhalogenid.
Eksploderer på affyringsrampen
Hvis N3 er et “kvælstofspidset missil”, som vi kommenterede ovenfor, er det værd at minde om, hvad der sker, når et missil ikke håndteres med omhu: det er i bund og grund en bombe.
NaN3 og KN3 er hvide pulvere, der kan opbevares i det uendelige ved stuetemperatur og skovles ud på bænken uden problemer.
Men når de opvarmes eller udsættes for stød – så er alt tabt. Det samme gælder, hvis disse azidsalte udsættes for syre, som danner potentielt eksplosivt HN3.
Og NaN3 og KN3 er de pæne azider! Hvis de blandes med metalsalte af bly, kviksølv, cadmium, zink eller sølv, kan der dannes endnu mere eksplosive azidforbindelser. Disse metalazider er kontakteksplosiver, hvoraf nogle er så følsomme, at de detonerer, hvis nogen prutter seks meter nede ad gangen. Nogle skøre kemikere fremstiller endda disse ting med vilje, men vi kommer ikke til at bevæge os i nærheden af den eksplosionsradius for det emne på denne blog, aldrig nogensinde.
NaN3 og KN3 bør anvendes i rimeligt fortyndede koncentrationer, bag et sprængningsskjold i præparativ skala, og i øvrigt aldrig anvendes med CH2Cl2-opløsningsmiddel, som kan resultere i meget eksplosivt diazidomethan.
Nu er der tidspunkter, hvor en pludselig eksplosion af nitrogengas er nyttig – og potentielt livreddende. Du har måske allerede tilbragt en del af din dag i nærheden af natriumazid uden at være klar over det. Det skyldes, at NaN3 er et af flere drivmidler, der anvendes i airbags; når detonationen af NaN3 udløses af et accelerometer, udstøder den N2-gas med over 200 mph og puster posen op på 1/25 af et sekund.
Hej til azidsalte!
via GIPHY
(Men lad være med at være denne fyr):
via GIPHY
Bottom line: SN2-reaktioner mellem alkylhalogenider eller sulfonater med azider er sandsynligvis den bedste enkeltmåde til at syntetisere primære aminer fra alkylhalogenider. Det slår i hvert fald Gabriel-syntesen.
4. Nukleofil acylsubstitution med azidsalte giver acylazider
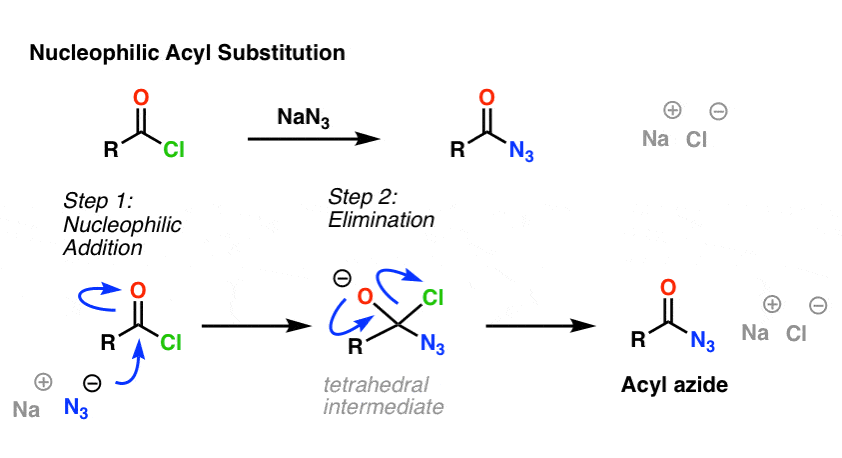
SN2-reaktionen er ikke den eneste type substitutionsreaktion, som vi har undersøgt. Der er også nukleofil acylsubstitution. En carbonyl, der er knyttet til en god afgangsgruppe (f.eks. et syrechlorid eller et anhydrid), vil undergå substitution, når der tilsættes en passende nukleofil.
I mekanismens første trin angriber nukleofilen (Nu) carbonylkulstoffet, idet den danner C-Nu og bryder C-O (pi). Dette giver anledning til et tetraedrisk mellemprodukt. I andet trin gen dannes C-O pi-bindingen, og kulstof-(afgangsgruppe)-bindingen brydes, hvilket resulterer i det nukleofile acylsubstitutionsprodukt.
Her er et eksempel på en nukleofil acylsubstitutionsreaktion mellem et syrechlorid og N3-ionen for at give et acylazid:
5. Omlægning af acylazider: Curtius-omlægning
Den mest almindelige anvendelse af acylazider er, at de ved opvarmning omarrangeres til isocyanater i en reaktion, der er kendt som Curtius-omlægningen.
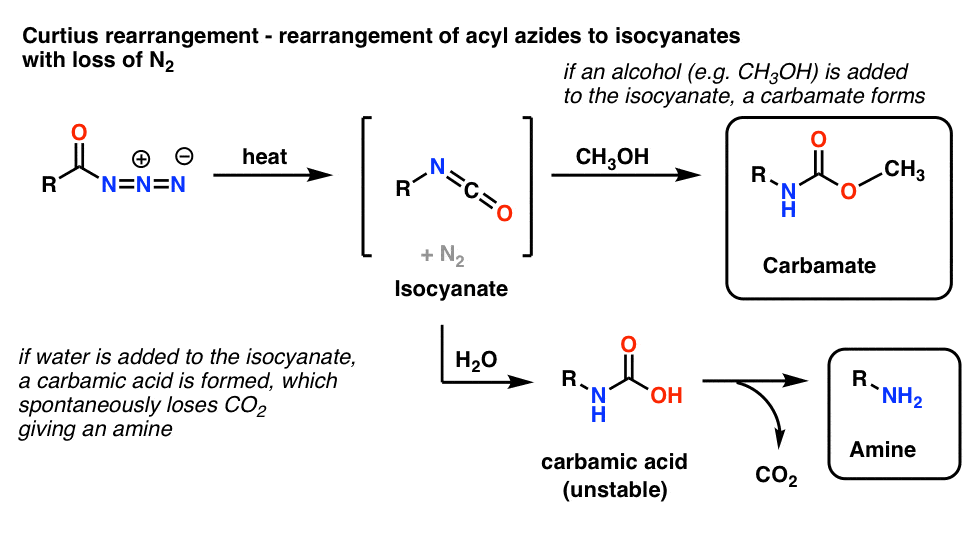
- Hvis Curtius-omdannelsen udføres i tilstedeværelse af en alkohol som f.eks. methanol, dannes et carbamat.
- Hvis der i stedet tilsættes vand, dannes kortvarigt en ustabil carbaminsyre, som derefter taber kuldioxid og giver en primær amin.
Hvorfor kan dette være nyttigt? Her er en måde.
Der findes mange metoder til at fremstille aromatiske carboxylsyrer, men ikke så mange gode metoder til at danne C-N-bindinger på aromatiske ringe. Lad os sige, at du har en benzoesyre (f.eks. p-methylbenzoesyre), men har brug for at danne en (beskyttet) aromatisk amin. Curtius-protokollen repræsenterer en fin måde at danne en ny C-N-binding på ringen uden at skulle ty til nitrering + reduktion.
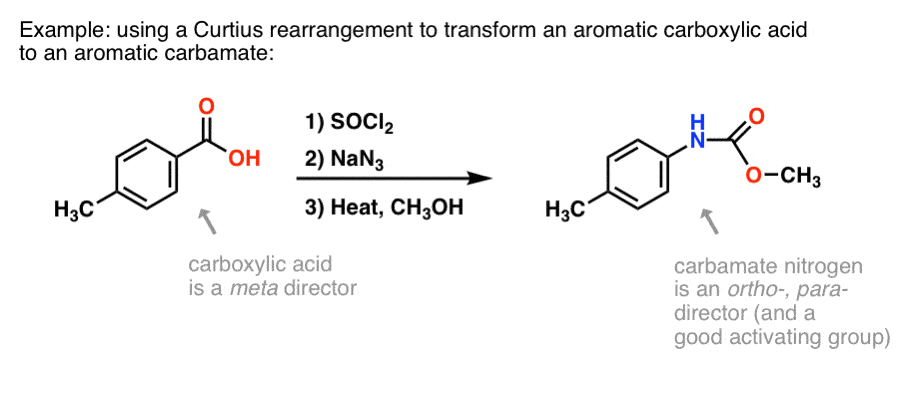
(På denne måde er det lidt analogt med en nitrogen-ækvivalent til Baeyer-Villiger-oxidationen. )
Flere eksempler på azidnukleofile: Epoxidåbning og konjugeret addition
To andre anvendelser af azidionen som nukleofil omfatter åbning af epoxider (i hvad der i det væsentlige er en SN2-proces – bemærk inversionen af konfiguration) og også konjugeret addition på alfa,beta-umættede ketoner:
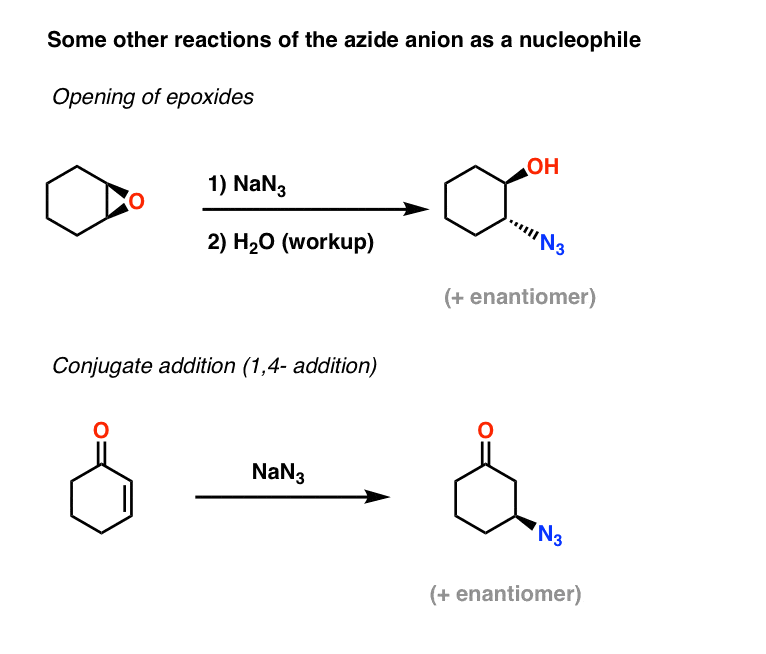
De resulterende alkylazider kan derefter reduceres til primære aminer ved hjælp af de metoder, der er beskrevet ovenfor.
Noter
Fodnote: Azid-Alkyne Cycloadditions, a.k.a. “Click”-kemi
En interessant og nyttig anvendelse af organiske azider, som endnu ikke har fundet vej ind i de indledende lærebøger i organisk kemi (men som sandsynligvis vil gøre det i den nærmeste fremtid), er en proces, der teknisk set kaldes “kobberkatalyseret azid-alkyne-cycloaddition”, men som mere almindeligt blot kaldes “alkyne-azid-klikreaktion”.
Når et terminal alkyn behandles med en kobberkatalysator i nærværelse af et organisk azid, opstår der hurtigt en cycloaddition, som fører til dannelse af en 1,2,3-triazol.
Vi vil ikke gå dybt ind i detaljerne, men denne ringdannende reaktion involverer 6 pi-elektroner og er en fætter til Diels-Alder-reaktionen (nidkære vil med rette bemærke, at den kobberkatalyserede version teknisk set ikke er en samordnet proces, men det er den ikke-katalyserede version)
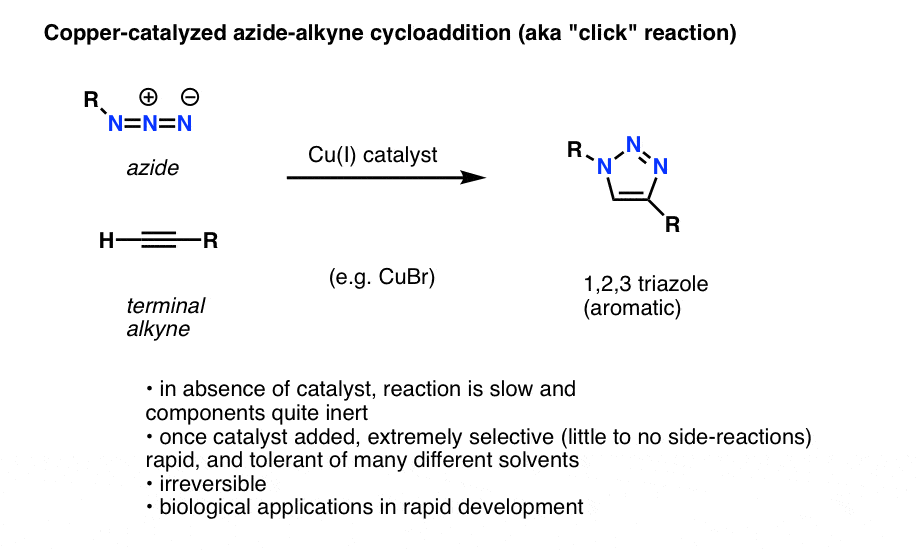
Reaktionen er bemærkelsesværdig af et par grunde:
- de reaktive partnere (terminal alkyn og organisk azid) er relativt inaktive i fravær af en katalysator under de fleste betingelser.
- Når kobber er tilsat, sker reaktionen ekstremt hurtigt under milde forhold og i en række opløsningsmidler (herunder vand).
- Det er ekstremt selektivt under disse forhold,alkyne- og azidpartnerne reagerer kun med hinanden, irreversibelt.
- produktet, en triazolring, er aromatisk og stabil
Den er blevet kaldt en “klik”-reaktion af en af dens ophavsmænd, Barry Sharpless, fordi den er noget af det tætteste kemikere har på en reaktion, der ligner det glidende “sammenklik” af to komplementære legoklodser.
Det, der har gjort denne reaktion særligt nyttig på det seneste, er, at azid- og alkynepartnere kan installeres i molekyler af biologisk interesse og “klikkes” sammen, når det ønskes.
For eksempel:
- Det er blevet brugt til at lave “klikkede” DNA’er, hvor triazolen erstatter organofosfatet ved at sætte en acetylen i 5′-positionen af et sukker og en azid i 3′-positionen.
- Utroligt nok har en gruppe fremstillet “clicked” DNA, sat det ind i menneskelige celler og formået at få det transskriberet af messenger RNA.
- Azid-holdigt AZT (ovenfor) virker ved at sætte transkriptionsmaskineriet i stå. Nogle kloge folk har fundet en måde at anvende azid-alkyne-klikreaktionen til hurtig sekventering af genomer, en teknik, der er kendt som ClickSeq.
Takata brugte natriumazid i begyndelsen af 1990’erne, og gik derefter over til tetrazol og derefter ammoniumnitrat.
Fra “Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis”.
Ammoniumnitrat var omkring en tiendedel af prisen for tetrazol, ifølge Upham, der også gennemgik industriens patenter. Men ammoniumnitrat havde en kritisk fejl, som ifølge ham fik andre producenter af airbags til at opgive det: Ammoniumnitrat har fem faser af varierende tæthed, hvilket gør det svært at holde det stabilt over tid. Et drivmiddel fremstillet med ammoniumnitrat ville svulme op og krympe ved temperaturændringer, og til sidst ville tabletten blive opløst til pulver. Vand og fugtighed ville fremskynde processen. Pulver brænder hurtigere end en tablet, så en airbag, hvis drivmiddel var smuldret, ville sandsynligvis blive udløst for aggressivt. Den kontrollerede eksplosion ville kun blive en eksplosion. “Alle gik en bestemt vej, og kun Takata gik en anden vej”, siger Jochen Siebert, der har fulgt airbagindustrien siden 1990’erne og nu er administrerende direktør for JSC Automotive Consulting. “Hvis man læser konferencepapirerne fra dengang, kan man faktisk se, at folk sagde: ‘Nej, det bør I ikke gøre’. Det er farligt”. “
Sprængstof fra de defekte airbags har dræbt 13 mennesker på verdensplan og såret mere end 100.
Den 25. juni 2017, da Takata stod over for forpligtelser på over 11 milliarder dollars, indgav virksomheden en konkursbegæring.
Primær aminsyntese “Do’s and Don’ts” :
(Avanceret) Referencer og videre læsning
Azider er nyttige i organisk syntese, og en fremhævning af azidkemi er givet i nedenstående referencer.
- Nukleofil reaktivitet af azidionen i forskellige opløsningsmidler
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, München, Tyskland) har brugt sin karriere på at bidrage til den grundlæggende fysiske organiske kemi ved at kvantificere elektrofilicitet og nukleofilicitet og udvikle skalaer til sammenligning af reaktiviteten af forskellige nukleofile og elektrofile stoffer. - The SN2 displacements at 2-norbornyl brosylates
Klaus Banert and Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosides, Nucleotides & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azider kan anvendes som nukleofile i SN2-reaktioner. Ref. #3 viser brugen af azidion ved syntesen af AZT (azidothymidin). Omdannelsen af 1 til 5 via 3 i ref. #3 anvender Mitsunobu-reaktionen, som muliggør forskydning af en -OH-gruppe med en nukleofil med inversion af konfiguration. - Reduktion af organiske azider til primære aminer med lithiumaluminiumhydrid
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Reduktion af organiske azider til primære aminer er en bekvem metode til syntese af primære aminer, som ellers er vanskelige at syntetisere selektivt med standardmetoder. - Metalazidernes eksplosive følsomhed over for stød
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
An investigation of the shock sensitivity of NaN3, TlN3, and Pb(N3)2. - The Curtius Reaction
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
En gammel, men omfattende gennemgang af Curtius-reaktionen, som omfatter historien om opdagelsen af denne omlægning, substratets omfang, begrænsninger, sammenligning med andre lignende reaktioner og eksperimentelle procedurer. - Syntetiske metoder og reaktioner. 121. Zinkjodid-katalyseret fremstilling af aroylazider fra aroylchlorider og trimethylsilylazid
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi og George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
En bekvem fremgangsmåde til fremstilling af aromatiske arylazider fra nobelprismodtageren professor George A. Olah. Disse kan derefter bruges til Curtius-omlægninger.
Epoxidåbning og konjugeret addition:
- CYCLOHEXENIMIN (7-AZA-BICYCLOHEPTAN)
Iain D. G. Watson, Nicholas Afagh og Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Dette er en særlig nyttig procedure, da det er en Staudinger-reaktion til omdannelse af epoxider til NH-aziridiner (kvælstofanalogen af epoxider). Syntesen kan være vanskelig, men der er her givet en masse detaljer, så den kan reproduceres, som passer til en procedure i Organic Syntheses. - Amin-katalyseret addition af azidion til α,β-umættede carbonylforbindelser
David J. Guerin, Thomas E. Horstmann og Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Dette papir er interessant, da det repræsenterer en tidlig form eller organokatalyse og sandsynligvis foregår gennem et imin- eller iminiumionintermediat. Desværre anvendes udtrykket ikke noget sted i artiklen – disse forfattere kunne have slået professor MacMillan til stregen! - Click Chemistry: Diverse kemiske funktioner ud fra nogle få gode reaktioner
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Den Cu-katalyserede cycloaddition af azider med alkyner er blevet kaldt en “klik”-reaktion af nobelprismodtageren prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) på grund af dens enkelhed, høje udbytte, hurtige kinetik og kompatibilitet med en bred vifte af betingelser og substrater. Cu-fri reaktioner er også mulige, hvis der anvendes spændte alkyner (f.eks. cyclooctynes).