Lokaliseret vs. delokaliseret
Den skelnen mellem “lokaliseret” og “delokaliseret” eksisterer kun, når vi beskriver elektronernes bevægelse ved hjælp af Lewis’ bindingsteori.
I henhold til denne teori opfører lokaliserede elektroner sig normalt. Et lokaliseret lone pair forbliver tæt på et atom. Et lokaliseret bindingspar bevæger sig mellem to atomer.
Resonanshybrider indeholder nødvendigvis nogle “unormale” elektroner. Et ensomt par kan synes at have nogle bindingsegenskaber; i stedet for at holde sig i nærheden af ét atom, besøger det to atomer. Et bindingspar kan synes at bevæge sig mellem to forskellige par af atomer. Disse elektroner træder uden for de grænser, som Lewis’ teori har sat for dem, og vi anser dem for at være delokaliserede.
Den nemmeste måde at opdage delokaliserede elektroner på er ved at sammenligne elektronernes placering i to resonansformer. Hvis et par optræder et sted i den ene form og et andet sted i den anden form, er parret delokaliseret.
Du kan se delokaliseret adfærd i resonansformerne I og II nedenfor. Begge former indeholder to delokaliserede elektronpar. Kan du finde dem? Hvilken slags elektronpar er delokaliseret i hver struktur?
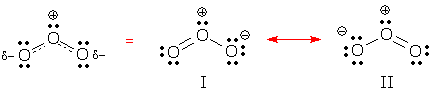
(Svar: Disse former indeholder et delokaliseret bindingspar og et delokaliseret lone-par.)
Delokaliserede bindinger og delokaliserede ladninger
Etiketten “delokaliseret” gælder også for bindinger og ladninger.
En delokaliseret binding er en binding, der forekommer i nogle resonansformer, men ikke i andre. Resonansform I indeholder 2 lokaliserede bindinger og 1 delokaliseret binding.
En delokaliseret ladning er en formel ladning, der optræder på et atom i nogle resonansformer og på andre atomer i andre former. Ozons negative ladning er delokaliseret over de to ende O, mens den positive ladning er lokaliseret på det centrale O.