Stabilität von Carbokation-Zwischenprodukten
Wir wissen, dass der geschwindigkeitsbegrenzende Schritt einer SN1-Reaktion der erste Schritt ist – die Bildung dieses Carbokation-Zwischenprodukts. Die Geschwindigkeit dieses Schritts – und damit die Geschwindigkeit der gesamten Substitutionsreaktion – hängt von der Aktivierungsenergie für den Prozess ab, bei dem die Bindung zwischen dem Kohlenstoff und der Abgangsgruppe bricht und sich ein Carbokation bildet. Nach dem Hammond-Postulat (Abschnitt 6.2B) gilt: Je stabiler das Carbokation-Zwischenprodukt ist, desto schneller wird dieser erste Schritt des Bindungsbruchs ablaufen. Mit anderen Worten: Die Wahrscheinlichkeit, dass eine nucleophile Substitutionsreaktion durch einen dissoziativen (SN1) Mechanismus abläuft, hängt in hohem Maße von der Stabilität des sich bildenden Carbokation-Zwischenprodukts ab.
Die entscheidende Frage ist nun, was stabilisiert ein Carbokation?
Wenn also eine elektronenziehende Gruppe nötig ist, um eine negative Ladung zu stabilisieren, was stabilisiert dann eine positive Ladung? Eine elektronenabgebende Gruppe!
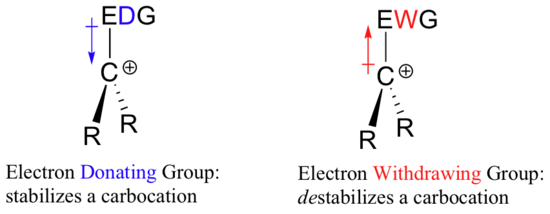
Eine positiv geladene Spezies wie ein Carbokation ist sehr elektronenarm, und daher wird alles, was dem Zentrum der Elektronenarmut Elektronendichte spendet, dazu beitragen, es zu stabilisieren. Umgekehrt wird ein Carbokation durch eine elektronenanziehende Gruppe destabilisiert.
Alkylgruppen – Methyl, Ethyl und dergleichen – sind schwache elektronenspendende Gruppen und stabilisieren daher Carbokationen in der Nähe. Das bedeutet, dass stärker substituierte Carbokationen im Allgemeinen stabiler sind: ein tert-Butyl-Carbokation ist zum Beispiel stabiler als ein Isopropyl-Carbokation. Primäre Carbokationen sind sehr instabil und werden nicht oft als Reaktionszwischenprodukte beobachtet; Methylcarbokationen sind sogar noch weniger stabil.
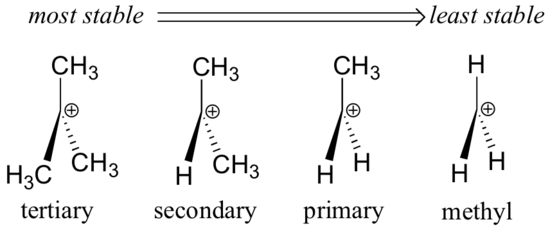
Alkylgruppen sind elektronenspendend und carbokationsstabilisierend, weil die Elektronen um die benachbarten Kohlenstoffe in Richtung der nahe gelegenen positiven Ladung gezogen werden, wodurch die Elektronenarmut des positiv geladenen Kohlenstoffs etwas verringert wird.
Es ist jedoch nicht richtig zu sagen, dass Carbokationen mit höherer Substitution immer stabiler sind als solche mit geringerer Substitution. Genauso wie elektronenabgebende Gruppen ein Carbokation stabilisieren können, wirken elektronenziehende Gruppen destabilisierend auf Carbokationen. Carbonylgruppen sind aufgrund der Polarität der C=O-Doppelbindung durch induktive Effekte elektronenziehend. Es ist möglich, im Labor zu zeigen (siehe Abschnitt 16.1D), dass das nachstehende Carbokation A stabiler ist als das Carbokation B, obwohl A ein primäres und B ein sekundäres Carbokation ist.
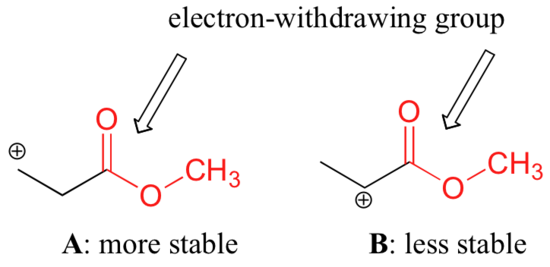
Der Unterschied in der Stabilität lässt sich erklären, wenn man die elektronenziehende induktive Wirkung des Estercarbonyls betrachtet. Es sei daran erinnert, dass induktive Effekte – ob elektronenziehend oder -gebend – über kovalente Bindungen vermittelt werden und dass die Stärke des Effekts mit zunehmender Anzahl von Zwischenbindungen rasch abnimmt. Mit anderen Worten: Die Wirkung nimmt mit der Entfernung ab. In Spezies B liegt die positive Ladung näher an der Carbonylgruppe, so dass der destabilisierende elektronenziehende Effekt stärker ist als in Spezies A.
Im nächsten Kapitel werden wir sehen, wie der Carbokation-destabilisierende Effekt von elektronenziehenden Fluorsubstituenten in Experimenten genutzt werden kann, um die Frage zu klären, ob es sich bei einer biochemischen nukleophilen Substitutionsreaktion um SN1 oder SN2 handelt.
Die Stabilisierung eines Carbokations kann auch durch Resonanzeffekte erfolgen, und wie wir bereits im Kapitel über Säuren und Basen erörtert haben, sind Resonanzeffekte in der Regel stärker als induktive Effekte. Betrachten wir den einfachen Fall eines benzylischen Carbokations:
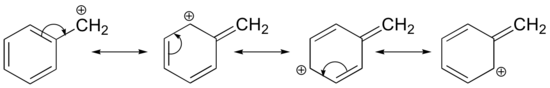
Dieses Carbokation ist vergleichsweise stabil. In diesem Fall ist die Elektronenspende ein Resonanzeffekt. Für dieses Carbokation können drei weitere Resonanzstrukturen gezeichnet werden, bei denen sich die positive Ladung an einem der drei aromatischen Kohlenstoffe befindet. Die positive Ladung ist nicht auf dem benzylischen Kohlenstoff isoliert, sondern um die aromatische Struktur herum delokalisiert: Diese Delokalisierung der Ladung führt zu einer erheblichen Stabilisierung. Infolgedessen sind benzylische und allylische Carbokationen (bei denen der positiv geladene Kohlenstoff mit einer oder mehreren nicht-aromatischen Doppelbindungen konjugiert ist) wesentlich stabiler als selbst tertiäre Alkylcarbokationen.
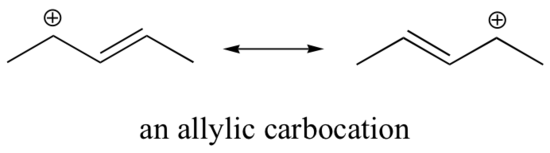
Da Heteroatome wie Sauerstoff und Stickstoff elektronegativer sind als Kohlenstoff, könnte man erwarten, dass sie per Definition elektronenziehende Gruppen sind, die Carbokationen destabilisieren. Tatsächlich ist oft das Gegenteil der Fall: Wenn sich das Sauerstoff- oder Stickstoffatom an der richtigen Stelle befindet, wird das Carbokation insgesamt stabilisiert. Das liegt daran, dass diese Heteroatome zwar durch Induktion Elektronen abziehen, aber durch Resonanz Elektronen spenden, und dieser Resonanzeffekt ist der stärkere. (Dieser Gedanke wurde bereits bei der Betrachtung der relativen Acidität und Basizität von Phenolen und aromatischen Aminen in Abschnitt 7.4 aufgegriffen). Betrachten wir die beiden nachstehenden Carbokationspaare:
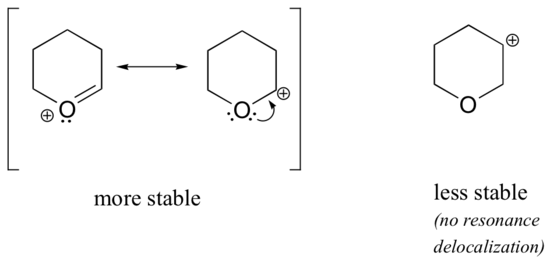
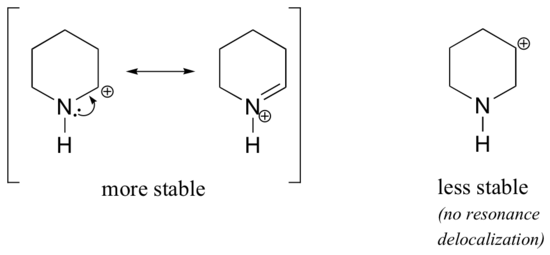
In den stabileren Carbokationen wirkt das Heteroatom durch Resonanz als elektronenspendende Gruppe: Das einsame Paar am Heteroatom steht nämlich zur Delokalisierung der positiven Ladung zur Verfügung. In den weniger stabilen Carbokationen ist der positiv geladene Kohlenstoff mehr als eine Bindung vom Heteroatom entfernt, so dass keine Resonanzeffekte möglich sind. Tatsächlich destabilisieren die Heteroatome in diesen Carbokationen die positive Ladung, da sie durch Induktion Elektronen abziehen.
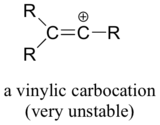
Schließlich sind Vinylcarbokationen, bei denen sich die positive Ladung an einem doppelt gebundenen Kohlenstoff befindet, sehr instabil und bilden daher wahrscheinlich keine Zwischenstufen in einer Reaktion.
Beispiel 7.9.1
In welcher der folgenden Strukturen ist das Carbokation voraussichtlich stabiler? Erläutern Sie.
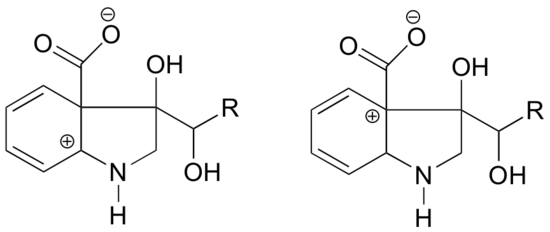
Antwort
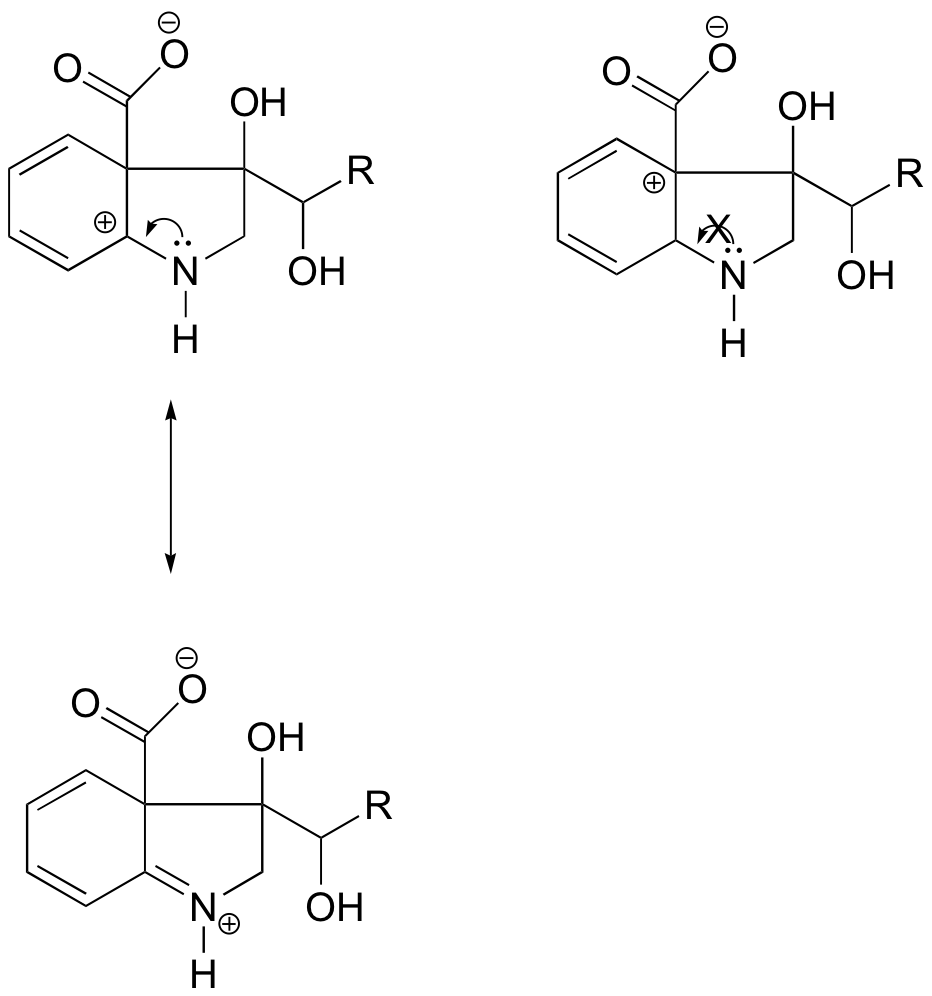
Bei dem Carbokation auf der linken Seite befindet sich die positive Ladung in einer Position relativ zum Stickstoff, so dass das einsame Elektronenpaar des Stickstoffs abgegeben werden kann, um das leere Orbital zu füllen. Bei der Carbokationsspezies auf der rechten Seite ist dies nicht möglich.
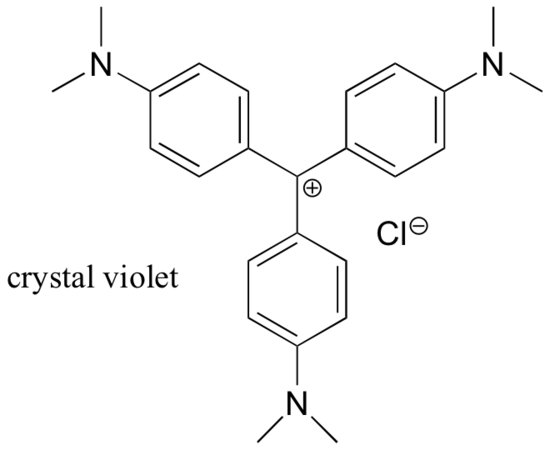
In den meisten Fällen sind Carbokationen sehr energiereiche, vorübergehende Zwischenspezies in organischen Reaktionen. Es gibt jedoch einige ungewöhnliche Beispiele für sehr stabile Carbokationen, die die Form von organischen Salzen annehmen. Kristallviolett ist der gebräuchliche Name für das Chloridsalz des Carbokations, dessen Struktur unten dargestellt ist. Beachten Sie die strukturellen Möglichkeiten für eine ausgedehnte Resonanzdelokalisierung der positiven Ladung und das Vorhandensein von drei elektronenabgebenden Amingruppen.
Beispiel 7.9.2
Zeichnen Sie eine Resonanzstruktur des Kristallviolett-Kations, in der die positive Ladung zu einem der Stickstoffatome delokalisiert ist.
Antwort 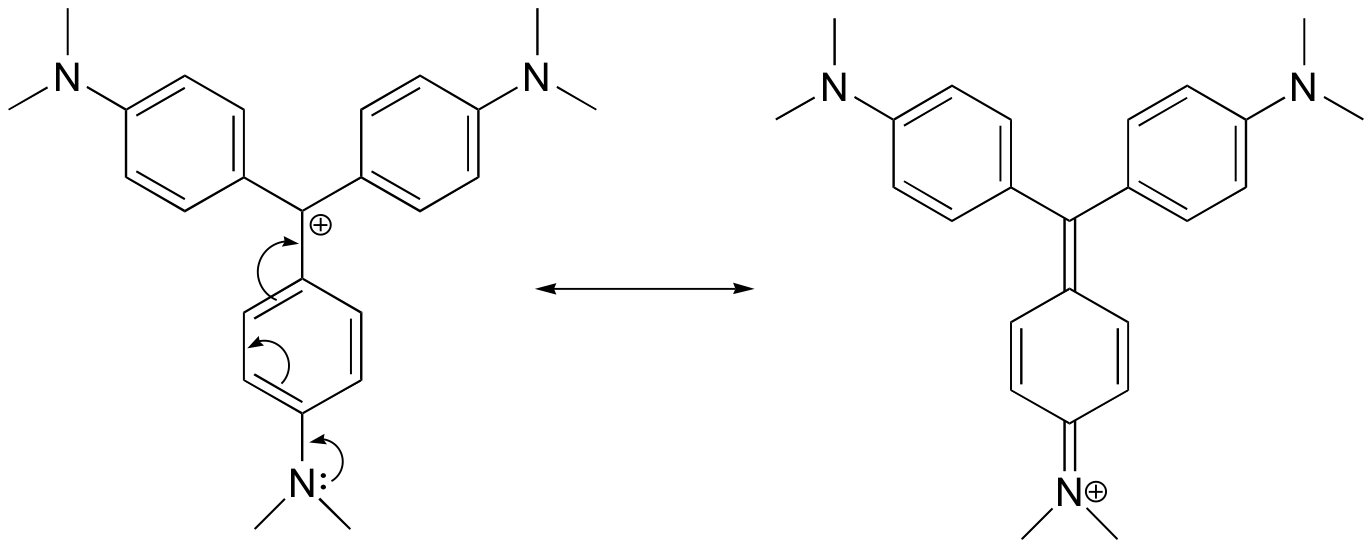
Wenn man die Möglichkeit in Betracht zieht, dass eine nukleophile Substitutionsreaktion über einen SN1-Weg verläuft, ist es entscheidend, die Stabilität des hypothetischen Carbokation-Zwischenprodukts zu bewerten. Wenn dieses Zwischenprodukt nicht stabil genug ist, muss ein SN1-Mechanismus als unwahrscheinlich angesehen werden, und die Reaktion läuft wahrscheinlich über einen SN2-Mechanismus ab. Im nächsten Kapitel werden wir mehrere Beispiele für biologisch wichtige SN1-Reaktionen sehen, bei denen das positiv geladene Zwischenprodukt durch induktive und Resonanzeffekte stabilisiert wird, die seiner eigenen Molekülstruktur innewohnen.
Beispiel 7.9.3
Bestimmen Sie, welches Carbokation in jedem der folgenden Paare stabiler ist, oder ob sie voraussichtlich ungefähr gleich sind. Erläutern Sie Ihre Überlegungen.
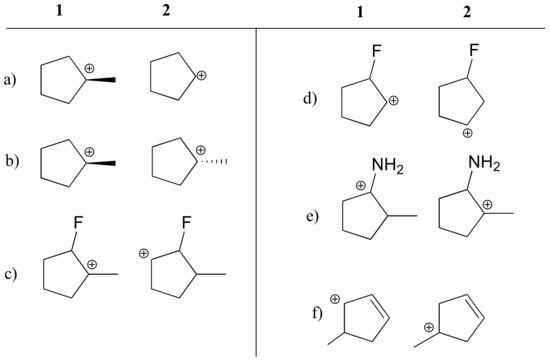
Antwort
a) 1 (tertiäres vs. sekundäres Carbokation)
b) gleich
c) 1 (tertiäres vs. sekundäres Carbokation)
d) 2 (positive Ladung ist weiter vom elektronenziehenden Fluor entfernt)
e) 1 (einsames Paar am Stickstoff kann durch Resonanz Elektronen abgeben)
f) 1 (allylisches Carbokation – positive Ladung kann auf ein zweites Kohlenstoffatom delokalisiert werden)