9.1 Terminologie für pflanzliche Öle und tierische Fette
Fett ist ein allgemeiner Begriff für Lipide, eine Klasse von Verbindungen in der Biochemie. Man kennt sie als fettige, feste Stoffe, die in tierischen Geweben und in einigen Pflanzen vorkommen – Öle, die bei Raumtemperatur fest sind.
Pflanzenöl ist das aus pflanzlichen Quellen gewonnene Fett. Man kann zwar auch aus anderen Teilen einer Pflanze Öl gewinnen, aber die Samen sind die Hauptquelle für Pflanzenöl. Pflanzenöle werden in der Regel zum Kochen und für industrielle Zwecke verwendet. Im Vergleich zu Wasser haben Öle und Fette einen viel höheren Siedepunkt. Es gibt jedoch einige Pflanzenöle, die nicht für den menschlichen Verzehr geeignet sind, da die Öle aus diesen Samenarten zusätzlich verarbeitet werden müssen, um unangenehme Geschmacksstoffe oder sogar giftige Chemikalien zu entfernen. Dazu gehören Raps- und Baumwollsamenöl.
Tierische Fette stammen von verschiedenen Tieren. Talg ist Rinderfett und Schmalz ist Schweinefett. Es gibt auch Hühnerfett, Blubber (von Walen), Lebertran und Ghee (ein Butterfett). Tierische Fette enthalten in der Regel mehr freie Fettsäuren als pflanzliche Öle.
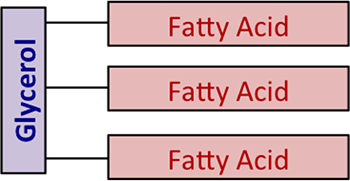
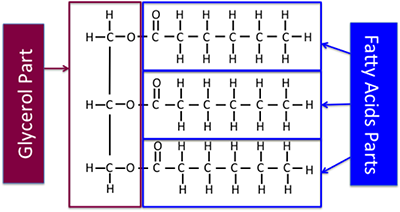
Chemisch werden Fette und Öle auch „Triglyceride“ genannt. Sie sind Ester des Glycerins mit einer unterschiedlichen Mischung von Fettsäuren. Abbildung 9.1 zeigt ein allgemeines Diagramm der Struktur, ohne chemische Formeln zu verwenden.
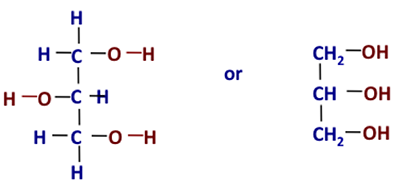
Was also ist Glycerin? Es ist auch als Glycerin/Glycerin bekannt. Andere Namen für Glycerin sind: 1,2,3-Propantriol, 1,2,3-Trihydroxypropan, Glycerit und Glycylalkohol. Es ist eine farblose, geruchlose, hygroskopische (d. h. Wasser anziehende) und süß schmeckende viskose Flüssigkeit. Abbildung 9.2 zeigt die chemische Struktur in zwei verschiedenen Formen.
So, jetzt müssen wir definieren, was die Fettsäuren sind. Im Wesentlichen sind Fettsäuren langkettige Kohlenwasserstoffe mit einer Carbonsäure. Abbildung 9.3a zeigt die allgemeine chemische Struktur einer Fettsäure mit der darauf befindlichen Carbonsäure.

Abbildung 9.3b zeigt verschiedene chemische Strukturen von Fettsäuren. Die chemischen Strukturen sind als chemische Linienstrukturen dargestellt, wobei jeder Punkt auf den Verbindungen ein Kohlenstoffatom darstellt und die korrekte Anzahl der Wasserstoffatome davon abhängt, ob es sich um eine Einfach- oder Doppelbindung handelt. Fettsäuren können gesättigt (mit Wasserstoffbrücken) oder ungesättigt (mit einigen Doppelbindungen zwischen den Kohlenstoffatomen) sein. Aufgrund des Stoffwechsels der Ölsaaten enthalten die natürlich gebildeten Fettsäuren eine gerade Anzahl von Kohlenstoffatomen. In der organischen Chemie haben Kohlenstoffatome vier Elektronenpaare, die sie mit einem anderen Kohlenstoff-, Wasserstoff- oder Sauerstoffatom teilen können. Freie Fettsäuren sind nicht an Glycerin oder andere Moleküle gebunden. Sie können durch den Abbau oder die Hydrolyse eines Triglycerids entstehen.
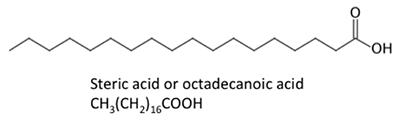
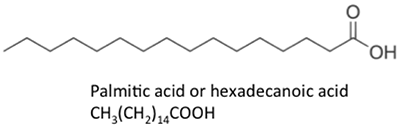
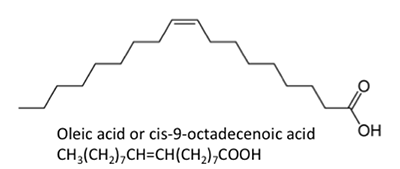
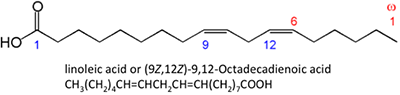
Die dargestellten Fettsäuren haben leicht unterschiedliche Eigenschaften. Palmitinsäure ist in Palmöl enthalten. Abbildung 9.4 zeigt das Verhältnis der einzelnen Fettsäuren zu ihrer Größe und Sättigung. Palmitinsäure und Sterinsäure sind gesättigte Fettsäuren, während Ölsäure und Linolsäure ungesättigt sind und unterschiedliche Mengen an Doppelbindungen aufweisen. Abbildung 9.4 zeigt die unterschiedlichen Mengen an Kohlenstoffatomen im Vergleich zur Anzahl der Doppelbindungen in der Verbindung.
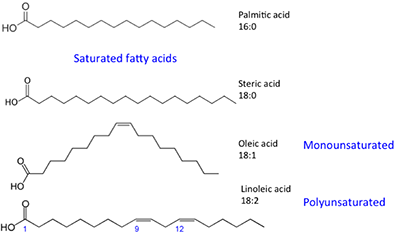
Abbildung 9.5a zeigt den Teil des Triglycerids, der eine Fettsäure ist, und den Teil, der Glycerin ist, dieses Mal einschließlich der chemischen Strukturen. Bei der hier gezeigten chemischen Struktur handelt es sich um ein gesättigtes Triglycerid.
So, wir haben besprochen, was Fette und Öle sind. Was ist nun Biodiesel? Wie lautet zumindest eine Definition? Es ist ein Dieselkraftstoff, der aus Biomasse gewonnen wurde. Es gibt jedoch verschiedene Arten von Biodiesel. Die bekannteste Art von Biodiesel ist ein Kraftstoff, der aus Monoalkylestern (in der Regel Methyl- oder Ethylester) langkettiger Fettsäuren besteht, die aus Pflanzenölen oder tierischen Fetten gewonnen werden – dies entspricht der ASTM D6551. Ein ASTM ist ein Dokument, das die Normen für bestimmte Arten von Chemikalien, insbesondere für industrielle Materialien, enthält. Dies ist eine wortreiche Definition, die uns nicht wirklich zeigt, was es chemisch ist.
Wenn wir also von einer Alkylgruppe sprechen, ist es ein einwertiger Rest, der nur Kohlenstoff- und Wasserstoffatome in einer Kohlenwasserstoffkette enthält, mit der allgemeinen Atomformel CnH2n+1. Beispiele sind:
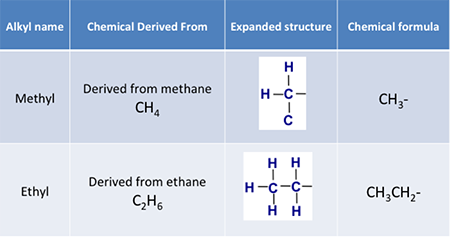
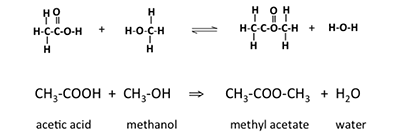
Ein weiterer Begriff, den wir kennen müssen, ist Ester. Ester sind organische Verbindungen, bei denen eine Alkylgruppe ein Wasserstoffatom in einer Carbonsäure ersetzt. Handelt es sich bei der Säure beispielsweise um Essigsäure und bei der Alkylgruppe um eine Methylgruppe, wird der resultierende Ester Methylacetat genannt. Bei der Reaktion von Essigsäure mit Methanol entstehen Methylacetat und Wasser; die Reaktion ist in Abbildung 9.6 dargestellt. Ein auf diese Weise gebildeter Ester ist eine Kondensationsreaktion; sie wird auch als Veresterung bezeichnet. Diese Ester werden auch als Carboxylatester bezeichnet.
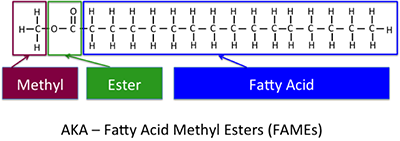
Dies ist die grundlegende Reaktion, die zur Bildung von Biodiesel beiträgt. Abbildung 9.7 zeigt die verschiedenen Teile der chemischen Struktur des Biodiesels, des Fettsäuremethylesters oder Fettsäuremethylesters (FAME).
So, an dieser Stelle sollten wir sicherstellen, dass wir wissen, worüber wir gesprochen haben. Biodiesel ist ein Methyl- (oder Ethyl-) Ester einer Fettsäure. Er wird aus Pflanzenöl hergestellt, aber es ist kein Pflanzenöl. Wenn es sich um 100%igen Biodiesel handelt, wird er als B100 bezeichnet – es handelt sich um ein Pflanzenöl, das zu Biodiesel umgeestert wurde. Es muss die ASTM-Biodieselnormen erfüllen, um Garantien zu erhalten, als Biodiesel verkauft zu werden und für Steuervergünstigungen in Frage zu kommen. Meistens wird er mit Dieselkraftstoff auf Erdölbasis gemischt. Bei B2 besteht er zu 2 % aus Biodiesel und zu 98 % aus Dieselkraftstoff auf Erdölbasis. Andere Mischungen sind: B5 (5% Biodiesel), B20 (20% Biodiesel) und B100 (100% Biodiesel). Warum Mischungen verwendet werden, wird im folgenden Abschnitt erläutert. Um es klar zu sagen: Manchmal wird Pflanzenöl in Dieselmotoren verwendet, aber es kann Leistungsprobleme verursachen und die Motoren mit der Zeit verschlechtern. Manchmal werden Pflanzenöl und Alkohol in Emulsionen gemischt, aber das ist immer noch kein Biodiesel, da es andere Eigenschaften als Biodiesel hat.
Wenn also reines Pflanzenöl (SVO) in einem Dieselmotor läuft, warum sollte man es nicht verwenden? Pflanzenöl ist wesentlich zähflüssiger (klebrig ist ein nichttechnischer Begriff) und hat schlechtere Verbrennungseigenschaften. Es kann zu Kohlenstoffablagerungen, schlechter Schmierung im Motor und Motorverschleiß führen und hat Probleme beim Kaltstart. Pflanzenöle enthalten natürliche Schleimstoffe, die zu Verstopfungen in Filtern und Einspritzdüsen führen können. Und bei einem Dieselmotor wird der Einspritzzeitpunkt verschoben, was zu Klopfgeräuschen führen kann. Es gibt Möglichkeiten, diese Probleme zu entschärfen, z. B: 1) Beimischung von Dieselkraftstoff auf Erdölbasis (in der Regel < 20%), 2) Vorwärmen des Öls, 3) Herstellung von Mikroemulsionen mit Alkoholen, 4) „Cracken“ des Pflanzenöls und 5) Umwandlung von SVO in Biodiesel durch Umesterung. Es gibt auch noch andere Methoden, aber im Moment konzentrieren wir uns auf Biodiesel aus Umesterung. Tabelle 9.1 zeigt drei Eigenschaften von Dieselkraftstoff Nr. 2, Biodiesel und Pflanzenöl. Wie Sie sehen können, liegt die Hauptveränderung in der Viskosität. Dieselkraftstoff Nr. 2 und Biodiesel haben eine ähnliche Viskosität, aber Pflanzenöle haben eine höhere Viskosität und können bei kaltem Wetter große Probleme verursachen. Dies ist der Hauptgrund für die Umwandlung von SVO in Biodiesel.
| Kraftstoff | Energiegehalt (Btu/gal) |
Cetanzahl | Viskosität (centistokes) |
|---|---|---|---|
| No. 2 Diesel | 140.000 | 48 | 3 |
| Biodiesel | 130.000 | 55 | 5.7 |
| Pflanzenöl | 130.000 | 50 | 45 |