Lernziele
- Die Zellnotation zur Beschreibung galvanischer Zellen verwenden
- Die grundlegenden Komponenten galvanischer Zellen beschreiben
Galvanische Zellen, auch bekannt als galvanische Zellen, sind elektrochemische Zellen, in denen spontane Oxidations-Reduktionsreaktionen elektrische Energie erzeugen. Beim Aufstellen der Gleichungen ist es oft zweckmäßig, die Oxidations-Reduktionsreaktionen in Halbreaktionen aufzuteilen, um das Gleichgewicht der Gesamtgleichung zu erleichtern und die tatsächlichen chemischen Umwandlungen hervorzuheben.
Betrachten Sie, was passiert, wenn ein sauberes Stück Kupfermetall in eine Silbernitratlösung gegeben wird (Abbildung 1). Sobald das Kupfermetall hinzugefügt wird, beginnt sich Silbermetall zu bilden und Kupferionen gehen in die Lösung über. Die blaue Farbe der Lösung ganz rechts zeigt die Anwesenheit von Kupferionen an. Die Reaktion kann in zwei Halbreaktionen aufgeteilt werden. Halbreaktionen trennen die Oxidation von der Reduktion, so dass jede einzeln betrachtet werden kann.
Die Gleichung für die Reduktionshalbreaktion musste verdoppelt werden, damit die Anzahl der bei der Reduktionshalbreaktion „gewonnenen“ Elektronen der Anzahl der bei der Oxidationshalbreaktion „verlorenen“ Elektronen entsprach.

Galvanische oder voltaische Zellen beinhalten spontane elektrochemische Reaktionen, bei denen die Halbreaktionen getrennt sind (Abbildung 2), so dass Strom durch einen externen Draht fließen kann. Das Becherglas auf der linken Seite der Abbildung wird als Halbzelle bezeichnet und enthält eine 1 M Lösung von Kupfer(II)-nitrat mit einem Stück Kupfermetall, das teilweise in die Lösung eingetaucht ist. Das Kupfermetall ist eine Elektrode. Das Kupfer wird oxidiert; daher ist die Kupferelektrode die Anode. Die Anode ist mit einem Draht an ein Voltmeter angeschlossen, und der andere Anschluss des Voltmeters ist über einen Draht mit einer Silberelektrode verbunden. Das Silber wird reduziert; daher ist die Silberelektrode die Kathode. Die Halbzelle auf der rechten Seite der Abbildung besteht aus der Silberelektrode in einer 1 M Lösung von Silbernitrat (AgNO3). An diesem Punkt fließt kein Strom, d. h. es findet keine nennenswerte Bewegung von Elektronen durch den Draht statt, da der Stromkreis offen ist. Der Stromkreis wird mit einer Salzbrücke geschlossen, die den Strom mit bewegten Ionen überträgt. Die Salzbrücke besteht aus einer konzentrierten, nicht reaktiven Elektrolytlösung wie der in diesem Beispiel verwendeten Natriumnitratlösung (NaNO3). Während die Elektronen von links nach rechts durch die Elektrode und den Draht fließen, gelangen Nitrationen (Anionen) durch den porösen Stopfen auf der linken Seite in die Kupfer(II)-Nitratlösung. Dadurch bleibt das Becherglas auf der linken Seite elektrisch neutral, da die Ladung der Kupfer(II)-Ionen, die bei der Oxidation des Kupfermetalls in der Lösung entstehen, neutralisiert wird. Zur gleichen Zeit, in der die Nitrat-Ionen nach links wandern, wandern Natrium-Ionen (Kationen) nach rechts, durch den porösen Stopfen und in die Silbernitratlösung auf der rechten Seite. Diese hinzugefügten Kationen „ersetzen“ die Silberionen, die bei der Reduktion zu Silbermetall aus der Lösung entfernt wurden, so dass das Becherglas auf der rechten Seite elektrisch neutral bleibt. Ohne die Salzbrücke würden die beiden Kammern nicht elektrisch neutral bleiben und es würde kein nennenswerter Strom fließen. Wenn die beiden Kammern jedoch in direktem Kontakt stehen, ist eine Salzbrücke nicht erforderlich. In dem Moment, in dem der Stromkreis geschlossen ist, zeigt das Voltmeter +0,46 V an; dies wird als Zellpotenzial bezeichnet. Das Zellpotenzial entsteht, wenn die beiden ungleichen Metalle miteinander verbunden werden, und ist ein Maß für die Energie pro Ladungseinheit, die bei der Oxidations-Reduktionsreaktion zur Verfügung steht. Das Volt ist die abgeleitete SI-Einheit für das elektrische Potenzial
In dieser Gleichung ist A der Strom in Ampere und C die Ladung in Coulomb. Beachten Sie, dass Volt mit der Ladung in Coulomb (C) multipliziert werden muss, um die Energie in Joule (J) zu erhalten.
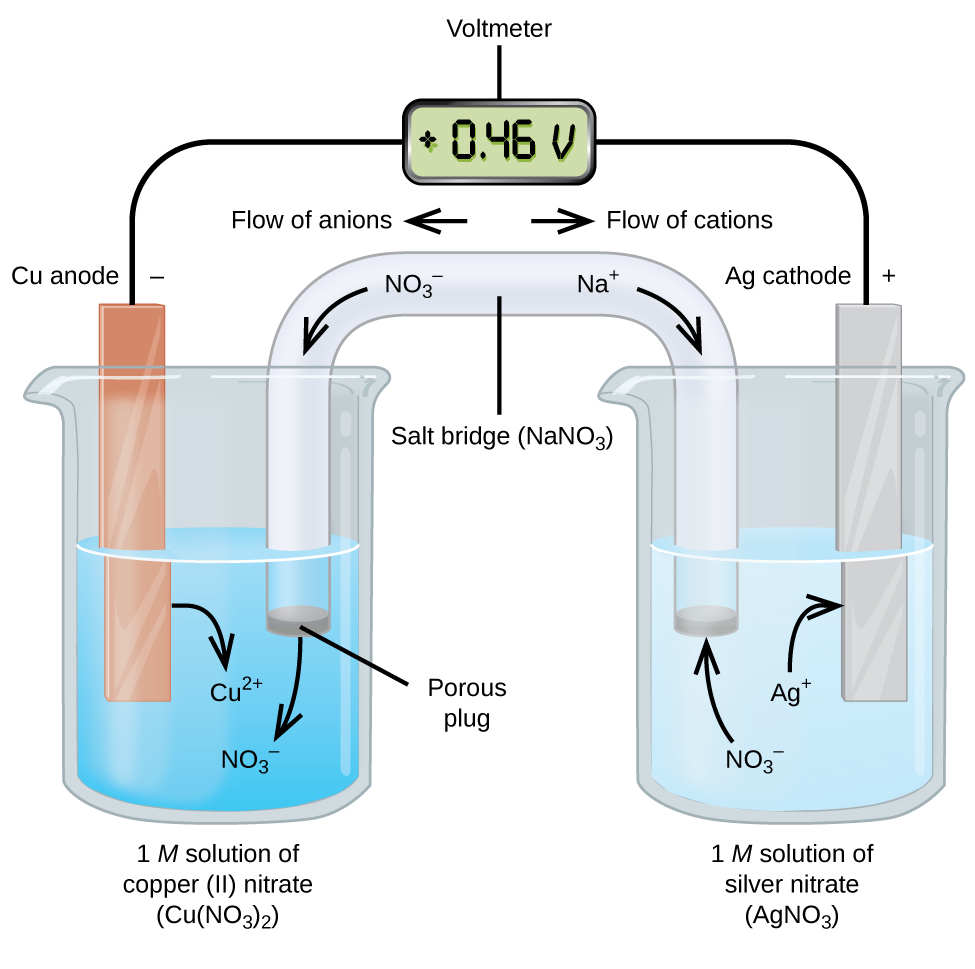
Wenn die elektrochemische Zelle auf diese Weise aufgebaut ist, zeigt ein positives Zellpotential eine spontane Reaktion an und dass die Elektronen von links nach rechts fließen. In Abbildung 2 geht eine Menge vor sich, daher ist es nützlich, die Dinge für dieses System zusammenzufassen:
- Elektronen fließen von der Anode zur Kathode: von links nach rechts in der galvanischen Standardzelle in der Abbildung.
- Die Elektrode in der linken Halbzelle ist die Anode, weil hier Oxidation stattfindet. Der Name bezieht sich auf den Fluss der Anionen in der Salzbrücke zu ihr hin.
- Die Elektrode in der rechten Halbzelle ist die Kathode, weil hier eine Reduktion stattfindet. Der Name bezieht sich auf den Fluss der Kationen in der Salzbrücke zu ihr hin.
- Die Oxidation findet an der Anode statt (die linke Halbzelle in der Abbildung).
- Die Reduktion findet an der Kathode statt (die rechte Halbzelle in der Abbildung).
- Das Zellpotential, +0.46 V, ergibt sich in diesem Fall aus den inhärenten Unterschieden in der Beschaffenheit der Materialien, aus denen die beiden Halbzellen bestehen.
- Die Salzbrücke muss vorhanden sein, um den Stromkreis zu schließen (zu vervollständigen), und es muss sowohl eine Oxidation als auch eine Reduktion stattfinden, damit Strom fließen kann.
Es gibt viele mögliche galvanische Zellen, daher wird in der Regel eine Kurzschreibweise verwendet, um sie zu beschreiben. Die Zellschreibweise (manchmal auch als Zelldiagramm bezeichnet) liefert Informationen über die verschiedenen an der Reaktion beteiligten Arten. Diese Notation funktioniert auch für andere Arten von Zellen. Eine senkrechte Linie, │, bezeichnet eine Phasengrenze und eine Doppellinie, ‖, die Salzbrücke. Die Informationen über die Anode werden auf der linken Seite geschrieben, gefolgt von der Anodenlösung, dann die Salzbrücke (falls vorhanden), dann die Kathodenlösung und schließlich die Informationen über die Kathode auf der rechten Seite. Die Zellnotation für die galvanische Zelle in Abbildung 2 lautet dann
Beachten Sie, dass Spektator-Ionen nicht eingeschlossen sind und dass die einfachste Form jeder Halbreaktion verwendet wurde. Wenn die Anfangskonzentrationen der verschiedenen Ionen bekannt sind, werden sie in der Regel mit angegeben.
Eine der einfachsten Zellen ist die Daniell-Zelle. Man kann diese Batterie konstruieren, indem man eine Kupferelektrode auf den Boden eines Glases legt und das Metall mit einer Kupfersulfatlösung bedeckt. Auf die Kupfersulfatlösung wird eine Zinksulfatlösung aufgeschwemmt; dann wird eine Zinkelektrode in die Zinksulfatlösung gelegt. Wenn man die Kupferelektrode mit der Zinkelektrode verbindet, kann ein elektrischer Strom fließen. Dies ist ein Beispiel für eine Zelle ohne Salzbrücke, und Ionen können über die Grenzfläche zwischen den beiden Lösungen fließen.
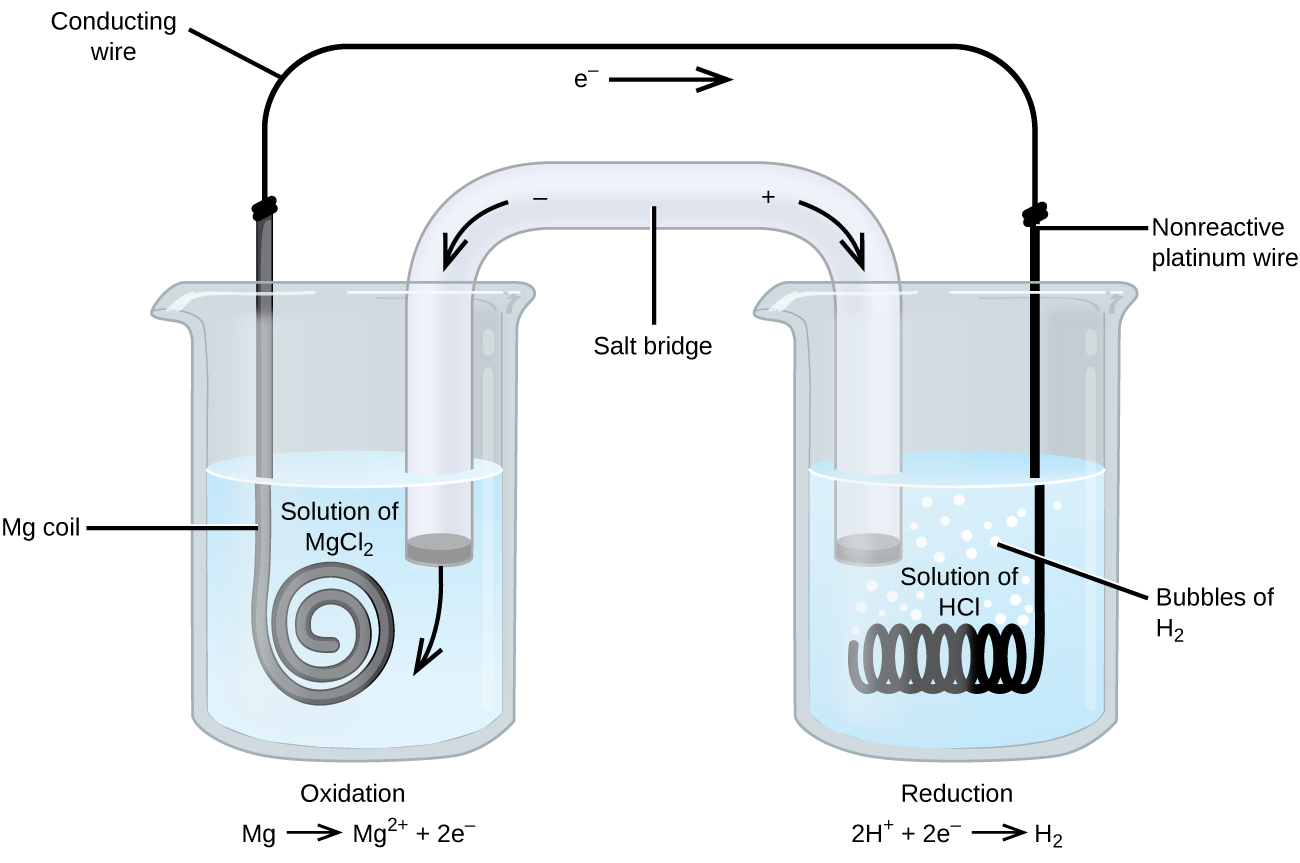
Bei einigen Oxidations-Reduktions-Reaktionen sind Spezies beteiligt, die Elektrizität schlecht leiten, so dass eine Elektrode verwendet wird, die an den Reaktionen nicht beteiligt ist. Häufig handelt es sich bei der Elektrode um Platin, Gold oder Graphit, die alle gegenüber vielen chemischen Reaktionen inert sind. Ein solches System ist in Abbildung 3 dargestellt. Magnesium wird an der Anode links in der Abbildung oxidiert und Wasserstoffionen werden an der Kathode rechts reduziert. Die Reaktion lässt sich wie folgt zusammenfassen
Die Zelle verwendet einen inerten Platindraht als Kathode, daher lautet die Zellennotation
Die Magnesiumelektrode ist eine aktive Elektrode, da sie an der Oxidations-Reduktionsreaktion beteiligt ist. Inerte Elektroden, wie die Platinelektrode in Abbildung 3, nehmen nicht an der Oxidations-Reduktionsreaktion teil und sind vorhanden, damit Strom durch die Zelle fließen kann. Platin oder Gold eignen sich im Allgemeinen gut als inerte Elektroden, da sie chemisch nicht reaktiv sind.
Beispiel 1
Verwendung der Zellennotation
Betrachten Sie eine galvanische Zelle, bestehend aus
Beschreiben Sie die Oxidations- und Reduktionshalbreaktionen und schreiben Sie die Reaktion in Zellschreibweise. Welche Reaktion findet an der Anode statt? An der Kathode?
Lösung
Bei der Betrachtung wird Cr oxidiert, wenn drei Elektronen verloren gehen und Cr3+ bilden, und Cu2+ wird reduziert, wenn es zwei Elektronen gewinnt und Cu bildet. Der Ausgleich der Ladung ergibt
Die Zellschreibweise verwendet die einfachste Form jeder der Gleichungen und beginnt mit der Reaktion an der Anode. Es wurden also keine Konzentrationen angegeben: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Die Oxidation findet an der Anode und die Reduktion an der Kathode statt.
Verwendung der Zellennotation
Betrachten Sie eine galvanische Zelle bestehend aus
Schreiben Sie die Oxidations- und Reduktionshalbreaktionen auf und schreiben Sie die Reaktion in Zellschreibweise. Welche Reaktion findet an der Anode statt? An der Kathode?
Lösung
Bei genauer Betrachtung wird Fe2+ oxidiert, wenn ein Elektron verloren geht und Fe3+ bildet, und MnO4- wird reduziert, wenn es fünf Elektronen gewinnt und Mn2+ bildet. Der Ausgleich der Ladung ergibt
Die Zellschreibweise verwendet die einfachste Form jeder der Gleichungen und beginnt mit der Reaktion an der Anode. Es ist notwendig, eine inerte Elektrode, wie z. B. Platin, zu verwenden, da kein Metall vorhanden ist, um die Elektronen von der Anode zur Kathode zu leiten. Es wurden also keine Konzentrationen angegeben: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Die Oxidation findet an der Anode und die Reduktion an der Kathode statt.
Check Your Learning
Beschreibe die galvanische Zelle, in der Kupfer(II)-Ionen zu Kupfermetall reduziert und Zinkmetall zu Zinkionen oxidiert wird, mit Hilfe der Zellschreibweise.
Antwort:
Aus den Informationen in der Aufgabe:
\begin{array}{lr @{{}\longrightarrow{}} l} \text{anode\;(Oxidation):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \text{Kathode};(Reduktion):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \\ \hline \\\ \text{overall:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
Verwendung der Zellnotation:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Elektrochemische Zellen bestehen normalerweise aus zwei Halbzellen. Die Halbzellen trennen die Oxidations-Halbreaktion von der Reduktions-Halbreaktion und ermöglichen den Stromfluss durch einen externen Draht. Eine Halbzelle, die in der Abbildung normalerweise auf der linken Seite dargestellt ist, enthält die Anode. An der Anode findet die Oxidation statt. Die Anode ist mit der Kathode in der anderen Halbzelle verbunden, die in einer Abbildung oft auf der rechten Seite dargestellt ist. An der Kathode findet die Reduktion statt. Durch Hinzufügen einer Salzbrücke wird der Stromkreis geschlossen, so dass Strom fließen kann. Die Anionen in der Salzbrücke fließen zur Anode und die Kationen in der Salzbrücke fließen zur Kathode. Durch die Bewegung dieser Ionen wird der Stromkreis geschlossen und jede Halbzelle bleibt elektrisch neutral. Elektrochemische Zellen können mit der Zellnotation beschrieben werden. In dieser Notation erscheinen die Informationen über die Reaktion an der Anode auf der linken Seite und die Informationen über die Reaktion an der Kathode auf der rechten Seite. Die Salzbrücke wird durch eine Doppellinie dargestellt, ‖. Die festen, flüssigen oder wässrigen Phasen innerhalb einer Halbzelle werden durch eine einzelne Linie, │, getrennt. Die Phase und die Konzentration der verschiedenen Spezies sind hinter dem Namen der Spezies angegeben. Elektroden, die an der Oxidations-Reduktionsreaktion teilnehmen, werden als aktive Elektroden bezeichnet. Elektroden, die nicht an der Oxidations-Reduktionsreaktion beteiligt sind, sondern nur dazu dienen, den Stromfluss zu ermöglichen, werden als inerte Elektroden bezeichnet. Inerte Elektroden werden häufig aus Platin oder Gold hergestellt, die bei vielen chemischen Reaktionen unverändert bleiben.
Chemie Übungen am Ende des Kapitels
- Schreiben Sie die folgenden Gleichgewichtsreaktionen in Zellschreibweise. Verwenden Sie ggf. Platin als inerte Elektrode.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- Bestimmen Sie bei den folgenden Zellschreibweisen die oxidierten und reduzierten Spezies sowie das Oxidationsmittel und das Reduktionsmittel, ohne die Gleichgewichtsreaktionen zu schreiben.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- Für die Zellennotationen in der vorherigen Aufgabe, Schreiben Sie die entsprechenden Gleichgewichtsreaktionen.
- Bilanzieren Sie die folgenden Reaktionen und schreiben Sie die Reaktionen in Zellschreibweise. Ignorieren Sie die inerten Elektroden, da sie nie Teil der Halbreaktionen sind.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(basisch\;Lösung)}
- Bestimmen Sie die oxidierte Spezies, die reduzierte Spezies sowie das Oxidationsmittel und das Reduktionsmittel für alle Reaktionen in der vorherigen Aufgabe.
- Beschreiben Sie die folgenden Systeme mithilfe der Zellschreibweise:
(a) In einer Halbzelle bildet eine Lösung von Pt(NO3)2 Pt-Metall, während in der anderen Halbzelle Cu-Metall in eine Cu(NO3)2-Lösung mit einer Konzentration von 1 M übergeht.
(b) Die Kathode besteht aus einer Goldelektrode in einer 0,55 M Au(NO3)3-Lösung und die Anode ist eine Magnesiumelektrode in 0.75 M Mg(NO3)2-Lösung.
(c) Eine Halbzelle besteht aus einer Silberelektrode in einer 1 M AgNO3-Lösung, und in der anderen Halbzelle wird eine Kupferelektrode in 1 M Cu(NO3)2 oxidiert.
- Warum ist eine Salzbrücke in galvanischen Zellen wie der in Abbildung 2 notwendig?
- Eine aktive (Metall-)Elektrode verliert an Masse, wenn die Oxidations-Reduktions-Reaktion abläuft. War die Elektrode Teil der Anode oder der Kathode? Erkläre.
- Aktive Elektroden nehmen an der Oxidations-Reduktionsreaktion teil. Da Metalle Kationen bilden, würde die Elektrode an Masse verlieren, wenn die Metallatome in der Elektrode oxidieren und in Lösung gehen würden. Die Oxidation findet an der Anode statt.
- Die Masse von drei verschiedenen Metallelektroden, jede aus einer anderen galvanischen Zelle, wurde bestimmt, bevor und nachdem der durch die Oxidations-Reduktions-Reaktion in jeder Zelle erzeugte Strom einige Minuten lang fließen konnte. Die erste Metallelektrode mit der Bezeichnung A hat an Masse zugenommen, die zweite Metallelektrode mit der Bezeichnung B hat ihre Masse nicht verändert, und die dritte Metallelektrode mit der Bezeichnung C hat an Masse verloren. Stellen Sie eine Vermutung darüber an, welche Elektroden aktiv und welche inert sind und welche Anode(n) und welche Kathode(n) sind.
Glossar
aktive Elektrode Elektrode, die an der Oxidations-Reduktionsreaktion einer elektrochemischen Zelle beteiligt ist; die Masse einer aktiven Elektrode ändert sich während der Oxidations-Reduktionsreaktion Anodenelektrode in einer elektrochemischen Zelle, an der die Oxidation stattfindet; Informationen über die Anode werden auf der linken Seite der Salzbrücke in Zellennotation aufgezeichnet Kathodenelektrode in einer elektrochemischen Zelle, an der eine Reduktion stattfindet; Informationen über die Kathode werden auf der rechten Seite der Salzbrücke in Zellennotation aufgezeichnet Zellennotation Kurzform für die Darstellung der Reaktionen in einer elektrochemischen Zelle Zellpotentialdifferenz im elektrischen Potential, die entsteht, wenn ungleiche Metalle verbunden werden; die treibende Kraft für den Ladungsfluss (Strom) bei Oxidations-Reduktionsreaktionen galvanische Zelle elektrochemische Zelle, bei der eine spontane Oxidations-Reduktionsreaktion abläuft; elektrochemische Zellen mit positivem Zellpotential; auch als galvanische Zelle bezeichnet inerte Elektrode Elektrode, die einen Stromfluss zulässt, aber ansonsten nicht an der Oxidations-Reduktionsreaktion in einer elektrochemischen Zelle teilnimmt; die Masse einer inerten Elektrode ändert sich während der Oxidations-Reduktionsreaktion nicht; inerte Elektroden werden häufig aus Platin oder Gold hergestellt, da diese Metalle chemisch nicht reaktiv sind. Voltaische Zelle eine andere Bezeichnung für eine galvanische Zelle
Lösungen
Antworten auf die Chemie-Übungen am Ende des Kapitels
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Oxidierte Spezies = Reduktionsmittel: (a) Al(s); (b) NO(g); (c) Mg(s); und (d) MnO2(s); Reduzierte Spezies = Oxidationsmittel: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\;\;2-}(aq); und (d) \text{ClO}_3^{\;\;-}(aq)
7. Ohne die Salzbrücke wäre der Stromkreis offen (oder unterbrochen) und es könnte kein Strom fließen. Mit einer Salzbrücke bleibt jede Halbzelle elektrisch neutral und Strom kann durch den Stromkreis fließen.
9. Es wurde festgestellt, dass eine aktive (Metall-)Elektrode an Masse gewinnt, wenn die Oxidations-Reduktionsreaktion abläuft. War die Elektrode Teil der Anode oder der Kathode? Erkläre.