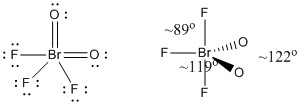Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Geben Sie die Elektronenkonfiguration (unter Verwendung der Edelgasschreibweise für geschlossene Schalen) und das Grundzustandssymbol für folgende Verbindungen an: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Nur das 3d-Elektron trägt zum Termsymbol bei: L = 2 und S = ½ ergibt 2D
b) Sc+
3d2
L = 3 und S = 1 ergibt 3F
c) Sc2+
3d1
L = 2 und S = ½ ergibt 2D
d) Sc3+
L = 0 und S = 0 ergibt 1S
d) Sc-
4s23d2
L = 3 und S = 1 ergibt 3F
2. Schreiben Sie die Lewis-Punktstruktur, geben Sie die formalen Ladungen für alle Atome an, sagen Sie die Molekülgeometrie voraus, schätzen Sie alle Bindungswinkel ab und geben Sie das wahrscheinliche Hybridorbital für die folgenden Verbindungen an: a) BrO2-; b) BrO3-; c) BrO2F3.
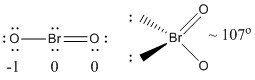
a) BrO2-
Lewis-Struktur:
Formale Ladungen sind auf der Lewis-Struktur angegeben
Struktur: gebogen planar mit einem Bindungswinkel von ~107°
Hybridorbital am Br: sp3
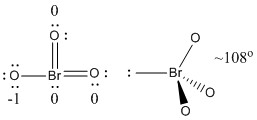
b) BrO3-
Lewis-Struktur:
Formale Ladungen sind in der Lewis-Struktur angegeben
Struktur: pyramidal mit Bindungswinkeln O-Br-O ~108°
Hybridorbital an Br: sp3
c) BrO2F3
Lewis-Struktur:
Formale Ladungen sind in der Lewis-Struktur angegeben
Struktur: trigonal bipyramidal mit den in der Abbildung gezeigten Bindungswinkeln
Hybridorbital an Br: dsp3
3. Die absolute Härte eines Atoms ist definiert als η = ½(IP – EA), wobei IP das Ionisierungspotential und EA die Elektronenaffinität ist. Sagen Sie die periodische Entwicklung von η voraus und begründen Sie Ihre Vorhersage.
Für fast alle Atome ist IP >> EA, so dass η den periodischen Trends von IP folgt: ansteigend, wenn man sich im Periodensystem nach rechts bewegt (in Anlehnung an Z*) und leicht abnehmend, wenn man sich im Periodensystem nach unten bewegt, wenn der Atomradius zunimmt.
4. Cr2 hat eine Elektronenkonfiguration von σ2π4δ4δ*2. Wie ist die Bindungsordnung und wie viele ungepaarte Spins werden vorhergesagt? Würden Sie erwarten, dass Cr2 Licht im sichtbaren Bereich des Spektrums absorbiert? Warum oder warum nicht?
Die Bindungsordnung = ½(2 + 4 + 4 – 2) = 4 mit 2 ungepaarten Spins (da es 2 δ-Orbitale gibt, muss es auch 2 δ*-Orbitale geben, die nach den Hund’schen Regeln jeweils ein Elektron besitzen). Die seitliche Überlappung von d-Orbitalen zur Bildung von δ-Orbitalen ist gering, so dass die Aufspaltung zwischen den δ- und δ*-Orbitalen klein ist. Dies deutet darauf hin, dass die Energie, die erforderlich ist, um ein Elektron vom HOMO zum LUMO zu bewegen, ebenfalls gering ist, was eine Absorption im sichtbaren Teil des Spektrums vorhersagt.