Im einfachsten Fall besteht eine elektrochemische Zelle aus zwei Elektronenleitern, die durch einen Ionenleiter getrennt und durch einen Elektronenleiter verbunden sind.
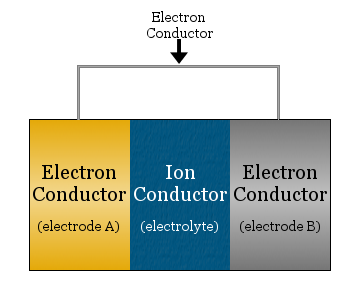
- Der Ionenleiter wird Elektrolyt genannt
- Die Elektronenleiter, die durch den Elektrolyt getrennt sind, werden Elektroden genannt
- Der Elektronenleiter, der verwendet wird, um die Elektroden zu verbinden, ist oft ein Metalldraht, wie z.B. Kupferdraht
- Zwei Arten von Zellen
- Beispiele
- Eine Quelle für thermodynamische Daten
- Sie ermöglichen zum Beispiel die Bestimmung von Standard-Redox-Potentialen, aus denen Standard-Enthalpie-, Standard-Entropie- und Standard-Gibbs-Energiedaten für Reaktionen bequem gewonnen werden können. Trennen von Reaktionen
- Beispiel: Die Daniell-Zelle
- Betrachten wir eine der frühen galvanischen Zellen, die Daniell-Zelle.
- Die Daniell-Zelle
Zwei Arten von Zellen
Es gibt zwei grundlegende Arten von elektrochemischen Zellen: galvanische und elektrolytische.
Die Energieumwandlung wird durch spontane (ΔG < 0) Redoxreaktionen erreicht, die einen Elektronenfluss erzeugen.
Ein Elektronenfluss treibt nicht-spontane (ΔG ≥ 0) Redoxreaktionen an.
Beispiele
- Eine Batterie, die etwas mit Strom versorgt, ist ein Beispiel für eine galvanische Zelle.
- Aufladbare Batterien sind Beispiele für beide Arten von Zellen: Sie arbeiten als galvanische Zellen, wenn sie ein Gerät mit Strom versorgen, und als elektrolytische Zellen, wenn sie wieder aufgeladen werden.
- Beispiele für elektrolytische Zellen sind auch solche, die Wasser in Wasserstoff und Sauerstoff spalten, und solche, die Aluminiumerz in Aluminiummetall umwandeln.
Eine Quelle für thermodynamische Daten
Zusätzlich zu den oben beschriebenen praktischen Anwendungen bieten elektrochemische Zellen eine ausgezeichnete Möglichkeit, thermodynamische Daten zu sammeln.
Sie ermöglichen zum Beispiel die Bestimmung von Standard-Redox-Potentialen, aus denen Standard-Enthalpie-, Standard-Entropie- und Standard-Gibbs-Energiedaten für Reaktionen bequem gewonnen werden können.
Trennen von Reaktionen
Elektrochemische Zellen können:
- Strom liefern, oder
- Metallerze in Metall umwandeln, oder
- thermodynamische Daten liefern,
weil die Redoxreaktionen getrennt ablaufen.
Beispiel: Die Daniell-Zelle
In elektrochemischen Zellen finden die Reaktionen an getrennten Elektroden statt – und die Elektroden selbst können sich in verschiedenen Gefäßen befinden.
Betrachten wir eine der frühen galvanischen Zellen, die Daniell-Zelle.
Die Energiequelle der Daniell-Zelle ist die spontane Reaktion von Zinkmetall mit Kupfersulfat zu Zinksulfat und Kupfermetall.
ΔG° = -212.6 kJ mol-1
Wenn die Stoffe zusammengebracht werden:
- in direktem Kontakt in einem Gefäß, wird chemische potentielle Energie in thermische Energie umgewandelt und das Reaktionsgefäß wird wärmer
- in einer elektrochemischen Zelle wird chemische potentielle Energie in elektrische Energie umgewandelt
Die Daniell-Zelle
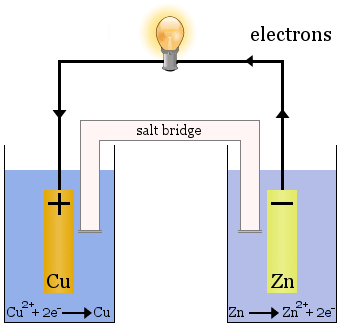
Die Daniell-Zelle besteht aus zwei Halbzellen: In der einen werden Kupferionen reduziert, in der anderen werden Zinkionen oxidiert.
Wenn die Zelle in Betrieb ist, wird Cu2+ aus einer Zelle entnommen und Zn2+ in der anderen Zelle erzeugt.
Die Kupferelektrode beginnt zu wachsen, da sie mit frisch abgeschiedenem Kupfermetall beschichtet wird, und die Zinkelektrode beginnt sich zu verkleinern, da Zink als Ionen in die Lösung verloren geht.
Die Salzbrücke im obigen Fall ist ein Glasrohr, das mit gesättigter KNO3-Lösung gefüllt ist.Sie hat Fritten an den Enden, die eine Vermischung der Lösungen in jeder der Halbzellen verhindern, aber sie lässt Ionen hindurch, um den Stromkreis zu schließen und jede Halbzelle elektrisch neutral zu halten.
Die treibende Kraft ist die gleiche ΔG° = -212.6 kJ mol-1, die man erhält, wenn man die Reaktanten einfach in einem Gefäß mischt; durch die Trennung der beiden Halbreaktionen müssen die Elektronen durch den Draht wandern, und wir können die elektrische Energie nutzen.
