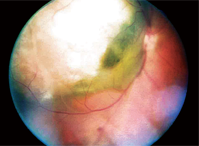
1. Eine Fundusaufnahme des rechten Auges unseres Patienten.
Ein 65-jähriger weißer Häftling stellte sich in der Augenklinik einer staatlichen Justizvollzugsanstalt vor und klagte über „Fehler“ in der Sicht seines linken Auges. Dies geschah seit etwa drei Wochen; eine Photopsie verneinte er. Die Anamnese des Patienten wies Bluthochdruck, Herzprobleme (zwei Herzklappenersatzoperationen) und Typ-2-Diabetes auf, der mit oralen Medikamenten kontrolliert wurde.
Die Augenanamnese wies auf eine „langjährige“ Erblindung auf dem rechten Auge hin.
Auf weitere Nachfragen zu dieser langjährigen Blindheit erfuhren wir, dass der Patient 15 Jahre zuvor einen Netzhautspezialisten aufgesucht hatte, der ihm sagte, er habe eine „Sommersprosse“ im Auge. Er berichtete, dass er vor etwa 10 Jahren sein Sehvermögen auf dem rechten Auge verloren hatte, aber seit diesem Besuch vor 15 Jahren keinen Spezialisten mehr aufgesucht hatte.
Diagnostische Daten
Bei der Untersuchung betrug die Sehschärfe des Patienten nur Lichtwahrnehmung O.D., Die Pupillen hatten eine Größe von 4 mm AD und 3 mm AS und waren rund und reaktiv, mit einem 3+ afferenten Defekt AD. Die Untersuchung des vorderen Augenabschnitts zeigte einen sklerotischen Katarakt. Wir führten eine erweiterte Fundusuntersuchung durch und stellten fest, dass die Hauptbeschwerden des Patienten auf eine hintere Glaskörperabhebung zurückzuführen waren, die eine dichte, zentrale Glaskörpersynerese verursachte. Wir fanden keine Netzhautbrüche oder etwas anderes von klinischer Bedeutung in diesem Auge.
Bei der Fundusuntersuchung seines rechten Auges zeigte sich eine große, erhabene Läsion von etwa 12 Scheibendurchmessern, die sich vom temporalen Sehnervenkopf über die temporale Makula bis über die Arkade superior hinaus erstreckte. Die Läsion hatte eine grau-weiße Farbe mit einem scheinbar flüssigen Inhalt im inferior-nasalen Bereich (Abbildung 1).
Diagnose
Wir stellten die vorläufige Diagnose eines Aderhautmelanoms mit seröser Netzhautablösung und dokumentierten sie mit Fundusfotos.
Behandlung und Nachsorge
Wir überwiesen den Patienten zur weiteren Untersuchung und Behandlung an den Augenarzt der Einrichtung. Etwa zwei Wochen später untersuchte der Augenarzt den Patienten und machte ein Fluoreszeinangiogramm sowie einen A- und B-Scan-Ultraschall. Die Auswertungsberichte für diese Verfahren waren recht rudimentär; sie besagten, dass die A- und B-Scans eine „solide Masse“ zeigten, und das Fluoreszein zeigte, dass die Masse zunächst mit Farbstoff gefüllt war und dann langsam verschwand. Nach diesen Untersuchungen stellte der Augenarzt die Differentialdiagnose eines malignen Melanoms oder einer scheibenförmigen Makuladegeneration. Er überwies den Patienten an einen Netzhautspezialisten, der ihn nur wenige Tage nach seiner augenärztlichen Konsultation aufsuchte.
Der Netzhautspezialist diagnostizierte sofort ein Aderhautmelanom und schickte den Patienten noch am selben Tag zu einem Spezialisten für Okuloplastik, um die Behandlung zu besprechen. Die Ergebnisse der diagnostischen Tests des Netzhautspezialisten und des Augenspezialisten lagen uns in den Unterlagen der Patientin nicht vor. Außerdem wurden eine CT-Untersuchung des Abdomens mit Kontrastmittel und eine Röntgenaufnahme der Brust angeordnet.
Der Patient und der Augenspezialist entschieden sich für eine Enukleation, und der Patient wurde in der folgenden Woche operiert. Die Enukleation war erfolgreich, doch leider hatte der Patient Schwierigkeiten mit der Narkose und starb zwei Tage nach der Enukleation. Das CT des Abdomens und die Röntgenaufnahmen des Brustkorbs waren noch nicht abgeschlossen.
Diskussion
Aderhautmelanome sind relativ selten, mit einer Inzidenz von etwa fünf bis sechs Fällen pro eine Million Menschen, was etwa 1.400 Fällen pro Jahr in den Vereinigten Staaten entspricht.1,2 Sie treten meist bei Erwachsenen auf (mit dem Höhepunkt um das 55. Lebensjahr), sind im Allgemeinen nicht familiär bedingt und zeigen in den meisten Altersgruppen eine leichte Vorliebe für Männer.1,3,4 Sie treten meist bei hellhäutigen Menschen mit blauer oder grüner Iris auf und sind selten bei Schwarzen oder Asiaten zu finden.1,4
Patienten mit Aderhautmelanomen sind oft symptomlos, können aber mit vermindertem Sehvermögen, Gesichtsfelddefekten, Floatern, Photopsien oder, in seltenen Fällen, Schmerzen auftreten.4,5 Wenn Schmerzen auftreten, sind sie in der Regel die Folge eines sekundären Glaukoms oder einer Tumornekrose; Aderhautmelanome können auch Schmerzen verursachen, wenn sie auf die darunter liegenden hinteren Ziliarnerven drücken, was jedoch nur selten vorkommt.3,5
Diese Läsionen sind in der Regel erhaben und können gesprenkelt, dunkelbraun, mattgrau, graugrün oder gelb (amelanotisch) erscheinen.4-6 Sie können eine Pilz- oder Kuppelform mit gestauten Blutgefäßen innerhalb des Tumors annehmen – diese Konfiguration entspricht den 20 % der Aderhautmelanome, die durch die Bruchsche Membran und das retinale Pigmentepithel (RPE) durchbrechen.1,4,5
Aderhautmelanome zeigen oft eine abrupte Erhebung aus der Aderhaut, subretinale Flüssigkeit, orangefarbene Pigmentierung auf der Oberfläche der Läsion und Wachstum im Laufe der Zeit.4 Subretinale Flüssigkeit mit einer darunter liegenden serösen Netzhautablösung ist das Ergebnis eines RPE-Zusammenbruchs. Diese serösen Ablösungen verschieben sich oft und können Blut zu enthalten scheinen, wenn der Tumor die Bruch’sche Membran durchquert hat.5
Die darüber liegende orangefarbene Pigmentierung ist Lipofuszin; dieses Pigment besteht aus Proteinen, Lipiden und kleinen Chromophoren und sammelt sich im RPE als Folge der Zelldegeneration und des unvollständigen Abbaus der äußeren Photorezeptorsegmente an.6,7 Lipofuszin ist nicht spezifisch für Melanome; es kann auch mit Aderhautnävi oder anderen gutartigen Aderhauttumoren assoziiert sein. Lipofuszin wird jedoch viel häufiger bei Melanomen als bei gutartigen Tumoren beobachtet.5
Weitere mögliche Anzeichen für Aderhautmelanome sind Glaskörperblutungen oder pigmentierte Glaskörperzellen, Drusen auf der Tumoroberfläche, neovaskuläre Aderhautmembranen oder sogar Proptose, wenn der Tumor in die Augenhöhle eindringt.4
Differenzialdiagnosen
Es gibt eine Fülle von Differenzialdiagnosen für melanotische und amelanotische Aderhautmelanome, die auf dem prognostischen Kontinuum des Schweregrades variieren.
– Aderhautnävi sind eine wichtige Differenzialdiagnose. Sie sind häufige, gutartige melanozytäre Tumoren und kommen bei etwa 2 bis 6,5 % der weißen Bevölkerung vor.8-10 Nävi sind in der Regel schiefergrau und relativ flach (weniger als 2 mm dick), obwohl es eine erhebliche Größenüberschneidung zwischen kleinen Melanomen und größeren Nävi gibt.8,9 Wie Aderhautmelanome können auch sie überlagerte Drusen oder Lipofuszin aufweisen (Abbildung 2). Statistisch gesehen wird von 500 Aderhautnävi einer eine maligne Transformation durchlaufen, wenn er 10 Jahre lang beobachtet wird; die geschätzte jährliche Rate der malignen Transformation liegt bei einem von 8.845.6,9
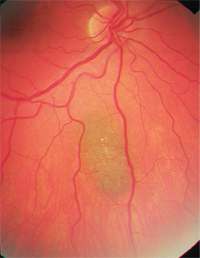
2. Aderhautnävus mit darüber liegenden Drusen.
Es gibt mehrere bekannte Risikofaktoren für eine solche Transformation (siehe „Maligne Transformation“).4,8 Der wichtigste scheint eine anfängliche Naevusdicke von mehr als 2 mm zu sein, aber auch ein großer Basisdurchmesser (mehr als 7 mm) deutet auf eine Prämalignität des Naevus hin.8,9 Das Fehlen von Drusen ist ein guter prognostischer Indikator.7
Während Aderhautmelanome dazu neigen, relativ schnell zu wachsen, können sich Aderhautnävi über einen Zeitraum von mehreren Jahren langsam vergrößern, was nicht unbedingt auf eine bösartige Transformation hinweist. Ein solches nicht-bösartiges Wachstum tritt häufiger bei jüngeren Patienten auf und stabilisiert sich in der Regel mit zunehmendem Alter.11 Daher ist ein langsames Wachstum von Aderhautnävi nicht immer ein Zeichen für eine bösartige Veränderung, insbesondere bei jüngeren Patienten ohne andere Risikofaktoren.11
Interessanterweise haben pigmentierte Aderhautläsionen ohne die oben genannten Risikofaktoren eine Wahrscheinlichkeit von 3 %, innerhalb von fünf Jahren zu wachsen; solche Läsionen sind in der Regel Aderhautnävi.9 Das Vorhandensein eines der oben genannten Faktoren birgt eine 38%ige Wachstumschance, und bei Vorhandensein von zwei oder mehr Risikofaktoren besteht eine mehr als 50%ige Wachstumschance.9 Das relative Wachstumsrisiko steigt vom 1,9-fachen auf das 27,1-fache für das Vorhandensein eines Risikofaktors im Vergleich zu allen fünf Risikofaktoren.9
– Aderhautmetastasen sind Tumoren, die sich über hämatogene Wege von einer primären bösartigen Erkrankung an anderer Stelle im Körper in die Aderhaut ausgebreitet haben. Es handelt sich also nicht um Primärtumore wie das Aderhautmelanom, sondern meist um Metastasen von Brust- oder Lungenkrebs. Diese Läsionen erscheinen in der Regel kuppelförmig und von cremegelber Farbe und führen häufig zu Netzhautablösungen. Aderhautmetastasen sind oft bilateral oder multifokal und erscheinen im Gegensatz zu amelonatischen Melanomen nicht pilzförmig.1
– Eine angeborene Hypertrophie des RPE zeigt sich als einzelne oder multifokale, dunkel pigmentierte, flache Läsionen, oft mit hypopigmentierten Lakunen. Sie sind gutartig, verändern sich in der Regel nicht im Laufe der Zeit und erfordern keine Behandlung.1
Die daraus resultierende seröse Netzhautablösung und Netzhauterhebung als Folge der exsudativen altersbedingten Makuladegeneration (AMD) stellt eine weitere Differenzialdiagnose für Aderhautmelanome dar. AMD kann subretinale Blutungen, lipide oder trübe Exsudation, schmutzig-graue oder gelbe Makulaödeme, Aderhautfalten, Pigmentepithelablösungen oder scheibenförmige Vernarbungen aufweisen.1 Die Fluoreszeinangiographie hilft bei der Unterscheidung zwischen diesen Erkrankungen.
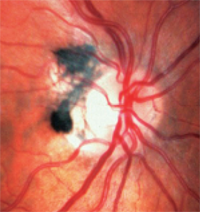
3. Melanozytome sind dunkel pigmentiert und befinden sich auf oder um den Sehnervenkopf.
– Melanozytome sind dunkel pigmentiert und befinden sich auf oder um den Sehnervenkopf (Abbildung 3). Im Gegensatz zu Melanomen sind sie angeboren und treten häufig bei Menschen mit dunkler Pigmentierung auf. Sie sind in der Regel inaktiv, können aber wachsen und sich selten zu Melanomen entwickeln.1
– Choroidale Hämangiome sind gutartige Erweiterungen der choroidalen Blutgefäße und werden häufig mit dem Sturge-Weber-Syndrom in Verbindung gebracht. Sie erscheinen erhaben und sind rot-orange gefärbt. Wie Aderhautmelanome können sie seröse Netzhautablösungen hervorrufen.1
– Aderhautosteome sind gelb-orangefarbene Placoid-Massen. Interessanterweise bestehen sie aus reifem Knochengewebe. Sie können eine choroidale Neovaskularisation und subretinale Blutungen hervorrufen. Aufgrund ihrer sehr charakteristischen Merkmale lassen sie sich mittels Ultraschall oder CT-Scan leicht von Aderhautmelanomen unterscheiden.1
– Weitere Differenzialdiagnosen für amelonotische oder melanotische Aderhautmelanome sind Aderhautablösung, Lymphom, metastasierendes Karzinom, subretinales oder Sub-RPE-Hämatom, lokalisiertes suprachoroidales Hämatom, noduläre Skleritis posterior, reaktive Hyperplasie des RPE oder massive Gliose der Netzhaut.4,5
Zusätzliche Tests
Verschiedene Instrumente können bei der Diagnose von Aderhautmelanomen helfen.
Die A- und B-Scan-Ultraschalluntersuchung hilft nicht nur bei der Diagnose, sondern kann auch genauere Messungen des Tumors liefern. Der A-Scan zeigt in der Regel eine geringe interne Reflektivität innerhalb des Tumors; die Höhenschwankungen der Echos innerhalb der Läsion können mit dem Puls des Patienten übereinstimmen, was auf das Vorhandensein intraläsionaler Gefäße hinweist.1,5
Der B-Scan zeigt eine solide Masse mit einem akustisch hellen vorderen Aspekt mit interner und basaler Dunkelheit; die Querschnittsform ist typischerweise bikonvex, kann aber auch pilzförmig erscheinen. Eine Exkavation der Aderhaut und eine orbitale Verschattung können ebenfalls zu sehen sein.1,5
Die Fluoreszeinangiographie zeigt typischerweise eine Hyperfluoreszenz der Tumorgefäße und eine diffuse Spätfärbung.1 Das Fluoreszeinmuster hängt jedoch unter anderem von der Größe, Form, Pigmentierung und Integrität des RPE des Tumors ab und davon, ob eine entsprechende seröse Netzhautablösung vorliegt.5 Die Fluoreszeinangiographie liefert keine pathognomonischen Anzeichen für ein Aderhautmelanom.3
Bei diesem Patienten wurde das Aderhautmelanom aufgrund der fundoskopischen Untersuchung, des A- und B-Scan-Ultraschalls und der Fluoreszeinangiographie (ohne Biopsie) diagnostiziert.
Der klinische Befund dieses Patienten war allein schon höchst suggestiv – im Grunde eindeutig – für ein Aderhautmelanom. Er wies vier der fünf oben genannten Risikofaktoren für Malignität auf: Dicke > 2 mm, subretinale Flüssigkeit, Symptome/Sehverlust und eine Lage < 3 mm vom Sehnervenkopf entfernt. Obwohl die Abmessungen der melanotischen Läsion auf der Grundlage der Ultraschalluntersuchung nicht verfügbar sind, war sie eindeutig mehr als 2 mm verdickt und hatte einen Basaldurchmesser von mehr als 7 mm (die weithin akzeptierten Obergrenzen für gutartige Nävi).8,12
Außerdem wies die Masse eindeutig invasive Merkmale auf, wie z. B. ein Übergreifen auf den Sehnervenkopf.8,12
Behandlung und Prognose
Wenn eine verdächtige Augenmasse gefunden wird, ist es wichtig, den Patienten zu fragen, ob er eine Augenoperation oder ein Trauma hatte, eine Krebserkrankung in der Vorgeschichte oder systemische Krebssymptome wie Anorexie, Gewichtsverlust, allgemeine Müdigkeit, Unwohlsein oder Krankheit. Obwohl bei 98 % der Patienten mit Aderhautmelanomen zum Zeitpunkt der Diagnose keine metastasierende Erkrankung nachweisbar ist, muss eine Metastasierung ausgeschlossen werden.5 Dies würde am besten von einem Augenonkologen behandelt werden, daher sollte eine solche Überweisung erfolgen.
Zu den Untersuchungen gehören ein komplettes Blutbild, Leberenzyme, Bauch-CT, MRT oder Ultraschall und eine Röntgenaufnahme des Brustkorbs.4,5 Für Aderhautmelanome stehen mehrere Behandlungsmöglichkeiten zur Verfügung, von denen viele jedoch mit hohen Risiken verbunden sind; daher muss der behandelnde Arzt bei der Auswahl der geeigneten Behandlungsmethode für jeden einzelnen Patienten viele Variablen sorgfältig abwägen. Einige der zu berücksichtigenden Faktoren sind die Größe und Lage des Tumors, der Metastasenstatus, der Sehstatus des betroffenen und des nicht betroffenen Auges sowie das Alter und der allgemeine Gesundheitszustand des Patienten.5 Abhängig von diesen Faktoren kann eine Beobachtung ein praktikabler Behandlungsplan sein, wenn der Patient gleichzeitig schwerwiegende medizinische Probleme hat, wird aber im Allgemeinen nicht empfohlen.
Maligne Transformation
Risikofaktoren für eine maligne Transformation von Aderhautnävi sind:4
– Dicke > 2mm.
– Subretinale Flüssigkeit.
– Vorhandensein von Symptomen.
– Prominentes orangefarbenes Pigment über der Läsion.
– Lage < 3mm vom Sehnervenkopf.
*Wenn zwei oder mehr Faktoren vorhanden sind, handelt es sich bei der Läsion wahrscheinlich um ein Aderhautmelanom.
Eine sehr aggressive Behandlung ist die Enukleation, die jedoch mit erheblichen Risiken verbunden ist. Die Hälfte der Patienten, die mit einer Enukleation behandelt werden, stirbt schließlich an einem metastasierenden Melanom. Diese invasive Behandlungsoption wird häufiger diskutiert, wenn das betroffene Auge blind ist, Schmerzen hat, der Sehnervenkopf befallen ist oder der Tumor sehr groß ist.5
Die meisten kleinen Aderhautmelanome werden mit lokal destruktiven Therapien wie Thermotherapie, Strahlentherapie oder Bestrahlung behandelt.12 Zur Behandlung können verschiedene Arten der Bestrahlung eingesetzt werden.4,5 Die häufigste ist die Plaque-Brachytherapie, bei der eine radioaktive Plaque verwendet wird, die außerhalb des Tumors auf die Oberfläche des Augapfels genäht wird.
Dies wird häufiger bei kleineren Tumoren versucht, die mindestens 3 Scheibendurchmesser von der Papille und der Fovea entfernt sind. Bei etwa 10 % bis 15 % der auf diese Weise behandelten Patienten kommt es nach der Behandlung zu einem lokalen Tumorrückfall. Nach der Behandlung bleibt das Sehvermögen der Patienten in der Regel gleich wie vor der Behandlung, es besteht jedoch die Möglichkeit, dass es sich verbessert. Das Sehvermögen kann jedoch aufgrund von Sekundäreffekten wie Strahlenretinopathie, Optikuspapillopathie, Katarakt oder neovaskulärem Glaukom nachträglich verringert werden.
Die Photokoagulation kann bei kleinen Tumoren (< 3 mm Dicke, < 7 mm basaler Durchmesser) versucht werden.4,5 Wie bei der Photokoagulation aus anderen Gründen entsteht in den photokoagulierten Bereichen ein dauerhaftes Skotom. Es können auch andere Laserbehandlungen eingesetzt werden, darunter die transpupilläre Thermotherapie, bei der ein Infrarotlaser mit geringer Leistung und langer Dauer verwendet wird.5,12 Diese Technik kann in Verbindung mit einer Plaque-Strahlentherapie eingesetzt werden, hat aber keine signifikante Verbesserung der lokalen Tumorkontrolle gezeigt.13
Andere, weniger verbreitete Behandlungen sind die lokale Resektion, die photodynamische Therapie oder die Kryotherapie.4,5 Oft werden mehrere Behandlungen als Teil eines Kombinationsansatzes eingesetzt.
Bedauerlicherweise ist die Prognose für Patienten mit Aderhautmelanom oft schlecht. Trotz der Behandlung entwickeln 30 bis 50 % der Patienten schließlich Metastasen; diese treten vorzugsweise in der Leber, aber auch in der Lunge, in den Knochen, in der Haut, in den Lymphknoten oder im zentralen Nervensystem auf.3,11,14 Der gleiche Anteil der Patienten stirbt innerhalb von 10 Jahren nach der Diagnose, in der Regel aufgrund der Ausbreitung von Metastasen.3,11
Sind die Metastasen erst einmal da, ist der Tod fast sicher.11 Am häufigsten werden Metastasen innerhalb eines Jahres nach der Aderhautmelanom-Diagnose entdeckt, obwohl sie möglicherweise erst Jahre später auftreten. Mehrere Faktoren korrelieren mit einer erhöhten Sterblichkeitsrate, darunter die Größe des Melanoms, die anteriore Lage, die extrasklerale Ausdehnung, das Wachstum durch die Bruch’sche Membran, die Ausdehnung auf den Sehnerv, das Fehlen von Pigmentierung und ein aggressiver Zelltyp und/oder mitotische Aktivität.3
Es ist offensichtlich, dass dieser Patient bei seinem ersten Termin in der optometrischen Klinik nicht angemessen behandelt wurde; trotz angemessener Überweisungen nach seinem zweiten Termin waren die Chancen auf einen erfolgreichen Ausgang deutlich geringer.
Auch wenn eine Verzögerung bei der Überweisung um einige Monate das Ergebnis in diesem Fall nicht wesentlich verändert hat, unterstreicht diese Situation die Bedeutung einer gründlichen Anamnese und einer effektiven Kommunikation zwischen Arzt und Patient. Er unterstreicht auch die Bedeutung angemessener Überweisungen und zusätzlicher Untersuchungen, unabhängig von der „langjährigen“ Natur einer Erkrankung.
Auch wenn die Prognose für Patienten mit Aderhautmelanom düster erscheinen mag, müssen Augenärzte eine angemessene Behandlung einleiten, sobald sie eine solche Läsion entdecken, um die Chancen des Patienten auf positive sekundäre Ergebnisse, einschließlich der Erhaltung des Sehvermögens, zu verbessern.
Dr. Weidmayer praktiziert mit einer Gruppe von Optometristen im Eye Center of Lenawee, P.C., in Adrian und Brooklyn, Mich.
1. Spaide RF. Diseases of the Retina and Vitreous. 1st ed. Philadelphia: W.B. Saunders; 1999:262-65.
2. Margo CE. Die kollaborative Augenmelanomstudie: ein Überblick. Cancer Control. 2004 Sep-Oct;11(5):304-9.
3. Garcia-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Aderhautmelanom EMedicine Ophthalmologie. Medscape Referenz. June 24, 2009. http://emedicine.medscape.com/article/1190564-overview. Accessed August 17, 2010.
4. Aderhautnävus und malignes Melanom der Aderhaut. In: Ehlers JP, Shah CP (eds). The Wills Eye Manual: Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5. Auflage. Philadelphia: Lippincott Williams & Wilkins; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In: Yanoff M, Duker JS, eds. Ophthalmology. 1st ed. London: Mosby;1999:1052-63.
6. Jones WL. Ophthalmoscopy. In: Terry JE (ed). Ocular Disease: Detection, Diagnosis, and Treatment. 1st ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Fundusautofluoreszenz und optische Kohärenztomographie bei choroidalen melanozytären Läsionen. Middle East Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Size overlap between benign melanocytic choroidal nevi and choroidal malignant melanomas. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Long term ultrasonic follow up of choroidal naevi and their transformation to melanomas. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Langsame Vergrößerung von choroidalen Nävi: eine Langzeit-Follow-up-Studie. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. Ein genauer, klinisch durchführbarer Multi-Genexpressions-Assay zur Vorhersage der Metastasierung bei Aderhautmelanomen. J Mol Diagn. 2010 July;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Diagnostische transvitreale Feinnadelaspirationsbiopsie kleiner melanozytärer Aderhauttumoren in der Kategorie Naevus versus Melanom. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Plaque-Radiotherapie für juxtapapilläre Aderhautmelanome: Tumorkontrolle in 650 konsekutiven Fällen. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. Whole body PET/CT for initial staging of choroidal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1270-74.