Azid-Ion: Struktur, Eigenschaften und Substitutionsreaktionen
Das Azid-Ion (N3- ) ist eines jener chemischen Gebilde, die einfach nur seltsam aussehen.

- Drei Stickstoffatome in einer Reihe? check
- Zwei negative Ladungen und eine positive Ladung, also eine Nettoladung von -1? check
- Stabil? check (solange es schonend behandelt wird).
Wie sich herausstellt, kann das Azid-Ion sehr nützlich sein, um C-N-Bindungen in nukleophilen Substitutionsreaktionen zu bilden.
Inhaltsverzeichnis
- Das Azid-Ion ist ein großartiges Nukleophil
- Organische Azide als „maskierte“ Amine
- Explodieren auf der Startrampe
- Nukleophile Acylsubstitution mit Azidsalzen: Acyl-Azide
- Umlagerung von Acyl-Aziden: Die Curtius-Umlagerung
- Weitere Beispiele für Azid-Nucleophile: Epoxidöffnung und konjugierte Addition
- Hinweise
- (Fortgeschrittene) Referenzen und weiterführende Literatur
- 1. Das Azid-Ion ist ein großes Nukleophil in SN2-Reaktionen
- 2. Organische Azide als „maskierte Amine“
- Explodieren auf der Startrampe
- 4. Nucleophile Acylsubstitution mit Azidsalzen zur Herstellung von Acylaziden
- 5. Umlagerung von Acylaziden: Die Curtius-Umlagerung
- Weitere Beispiele für Azid-Nucleophile: Epoxid-Öffnung und Konjugat-Addition
- Anmerkungen
- (Fortgeschrittene) Referenzen und weiterführende Literatur
1. Das Azid-Ion ist ein großes Nukleophil in SN2-Reaktionen
Das Azid-Ion ist die konjugierte Base der Azoesäure, HN3. Obwohl es nur schwach basisch ist (der pKa-Wert von HN3 beträgt nur 4,6), ist N3 ein extrem gutes Nukleophil – nach einer Messung ist es nukleophiler als jedes Amin (siehe Beitrag: Nukleophilie von Aminen). Wenn man darüber nachdenkt, ist es nicht schwer zu verstehen, warum das so ist. Mit vier nukleophilen Einzelpaaren auf kleinstem Raum ist die Wahrscheinlichkeit eines Zusammenstoßes mit einem Elektrophil, der zu einer Reaktion führt, viel höher als bei einem Amin mit sperrigen Alkylgruppen, um nur ein Beispiel zu nennen.
Man kann sich N3- als eine schlanke, gemeine Rakete mit Stickstoffspitze vorstellen, die ihre Nutzlast schnell, effizient und ohne nennenswerte Nebenreaktionen auf den Kohlenstoff bringt.
In SN2-Reaktionen werden primäre und sekundäre Alkylhalogenide und Sulfonate leicht durch N3- verdrängt, was zu Alkylaziden führt:
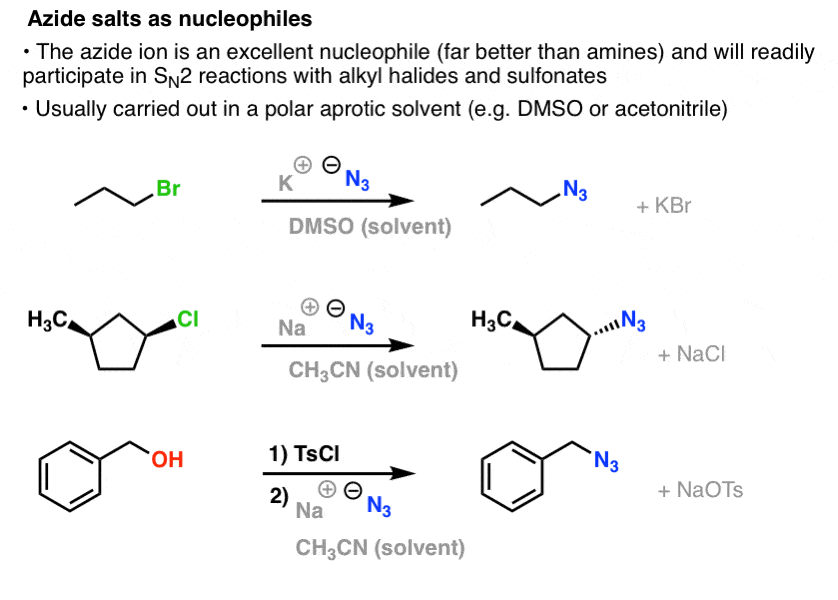
Das übliche Verfahren besteht darin, ein Azidsalz wie NaN3 oder KN3 mit dem entsprechenden Alkylhalogenid in einem polaren aprotischen Lösungsmittel wie Acetonitril (CH3CN) oder Dimethylsulfoxid (DMSO) zu verwenden.
Die organischen Azidprodukte sind einigermaßen stabil, auch wenn sie etwas seltsam aussehen. Einige werden sogar als Arzneimittel (z. B. AZT, unten rechts) oder als nützliche Sonden für die Untersuchung der chemischen Biologie verwendet.
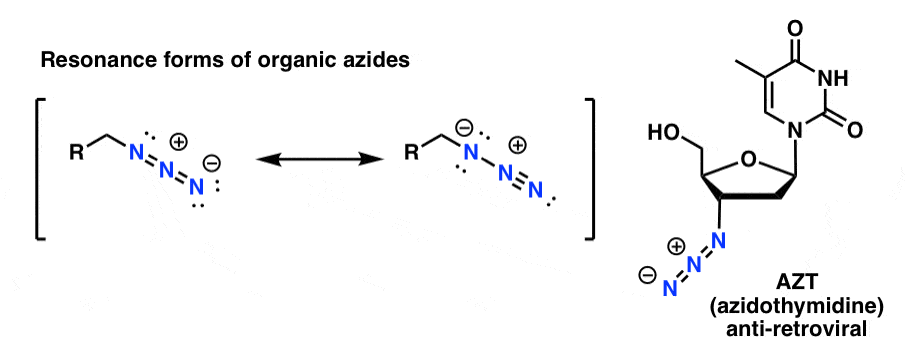
Für unsere Zwecke ist die nützlichste Eigenschaft der organischen Azide, dass sie als „maskierte“ Amine dienen.
2. Organische Azide als „maskierte Amine“
Beachte die obige Resonanzform mit einer Stickstoff-Stickstoff-Dreifachbindung. Durch Behandlung mit einem Reduktionsmittel wie LiAlH4 oder sogar durch katalytische Hydrierung (Pd/C , H2) können organische Azide zu primären Aminen reduziert werden, wobei N2 freigesetzt wird.
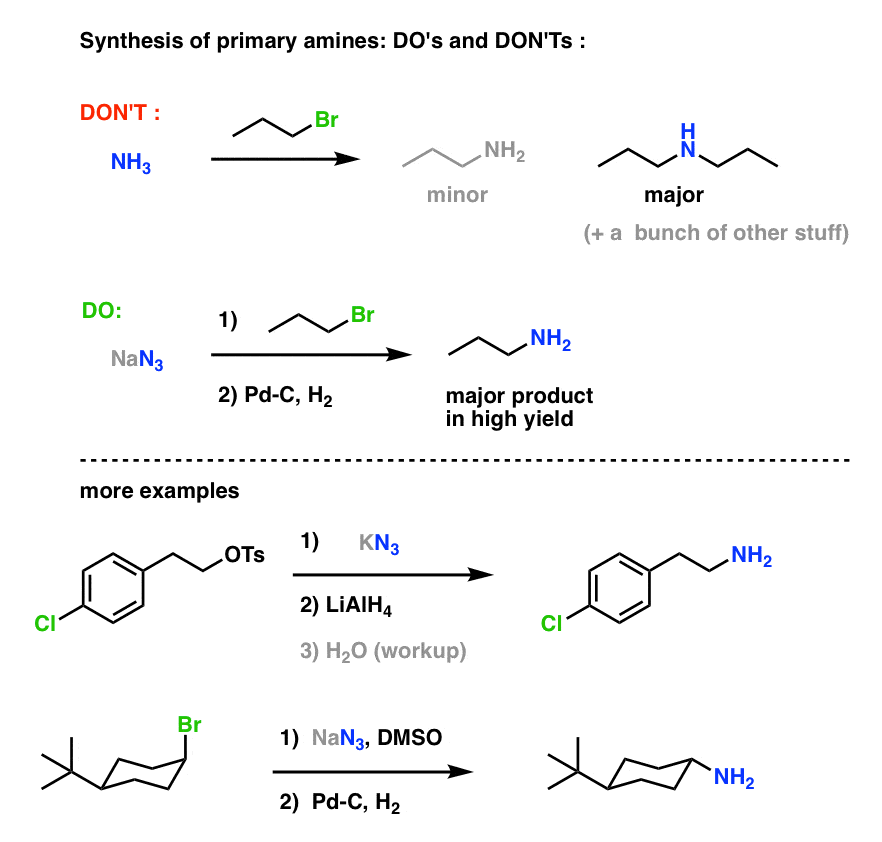
Dies ist ein sehr nützlicher Weg zu primären Aminen aus Alkylhalogeniden!
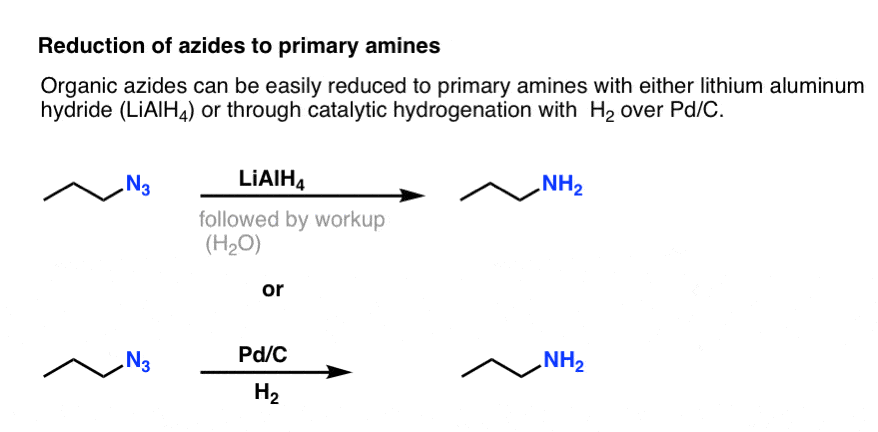
Wir haben bereits die Gabriel-Synthese als Weg zu primären Aminen erforscht, aber dieser Weg ist besser, weil das Azid unter schonenden Bedingungen (z. B. Hydrierung) zum Amin reduziert werden kann. Wir haben auch gesehen, dass die Herstellung von primären Aminen durch direkte Behandlung von Alkylhalogeniden mit NH3 oft nicht zum gewünschten Produkt führt, weil Amine eine Cookie-Monster-ähnliche Tendenz haben, mehrfach mit Alkylhalogeniden zu reagieren: Da die Aminprodukte dazu neigen, nukleophiler zu sein als die Reaktanten, ist es schwer, Amine dazu zu bringen, nur ein Alkylhalogenid zu fressen.
Explodieren auf der Startrampe
Wenn N3 eine „Rakete mit Stickstoffspitze“ ist, wie wir oben kommentiert haben, sollte man sich vor Augen führen, was passiert, wenn eine Rakete nicht mit Sorgfalt behandelt wird: Sie ist im Grunde eine Bombe.
NaN3 und KN3 sind weiße Pulver, die bei Raumtemperatur unbegrenzt gelagert werden können und ohne Probleme auf der Werkbank entnommen werden können.
Aber wenn sie erhitzt oder einem Schock ausgesetzt werden, ist alles anders. Das Gleiche gilt für die Einwirkung von Säure auf diese Azidsalze, wobei sich explosives HN3 bildet.
Und NaN3 und KN3 sind die schönen Azide! Wenn sie mit Metallsalzen von Blei, Quecksilber, Cadmium, Zink oder Silber gemischt werden, können sogar noch explosivere Azidverbindungen entstehen. Diese Metallazide sind Kontaktsprengstoffe, von denen einige so empfindlich sind, dass sie schon explodieren, wenn jemand zwanzig Meter weiter im Flur furzt. Einige verrückte Chemiker stellen diese Dinger sogar absichtlich her, aber wir werden uns in diesem Blog niemals auch nur in die Nähe des Explosionsradius dieses Themas begeben.
NaN3 und KN3 sollten in angemessen verdünnten Konzentrationen, hinter einem Schutzschild im Präparationsmaßstab und übrigens niemals mit dem Lösungsmittel CH2Cl2 verwendet werden, das zu hochexplosivem Diazidomethan führen kann.
Es gibt Momente, in denen eine plötzliche Explosion von Stickstoffgas nützlich ist – und möglicherweise lebensrettend. Vielleicht haben Sie schon einmal einen Teil Ihres Tages in unmittelbarer Nähe von Natriumazid verbracht, ohne es zu merken. Das liegt daran, dass NaN3 eines von mehreren Treibmitteln ist, die in Airbags verwendet werden. Sobald die Detonation von NaN3 durch einen Beschleunigungsmesser ausgelöst wird, wird N2-Gas mit einer Geschwindigkeit von über 200 km/h ausgestoßen und bläst den Airbag in einer halben Sekunde auf.
Ja, Azidsalze!
via GIPHY
(Aber sei nicht dieser Typ):
via GIPHY
Unterm Strich: SN2-Reaktionen zwischen Alkylhalogeniden oder Sulfonaten mit Aziden sind wahrscheinlich der beste Weg, um primäre Amine aus Alkylhalogeniden zu synthetisieren. Sie ist sicherlich besser als die Gabriel-Synthese.
4. Nucleophile Acylsubstitution mit Azidsalzen zur Herstellung von Acylaziden
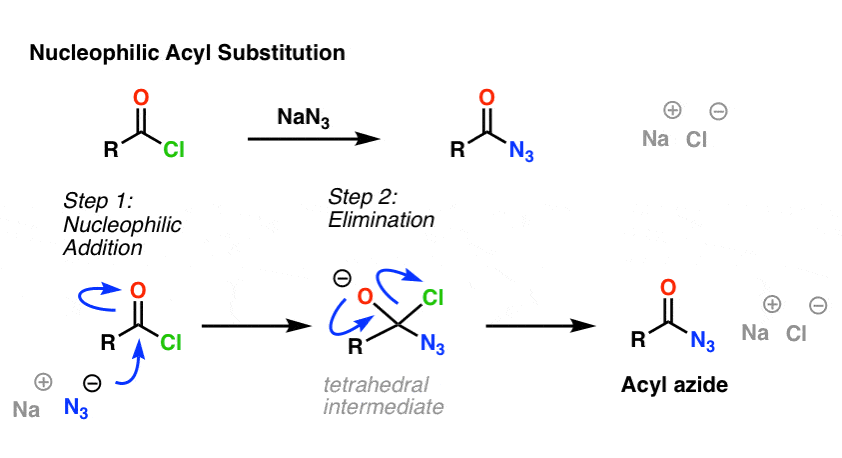
Die SN2-Reaktion ist nicht die einzige Art von Substitutionsreaktion, die wir untersucht haben. Es gibt auch die nukleophile Acylsubstitution. Ein Carbonyl, das an eine gute Abgangsgruppe (z. B. ein Säurechlorid oder -anhydrid) gebunden ist, wird substituiert, wenn ein geeignetes Nucleophil hinzugefügt wird.
Im ersten Schritt des Mechanismus greift das Nucleophil (Nu) das Carbonylkohlenstoffatom an, wobei C-Nu gebildet und C-O (pi) gespalten wird. Dabei entsteht ein tetraedrisches Zwischenprodukt. Im zweiten Schritt wird die C-O-pi-Bindung wiederhergestellt und die Kohlenstoff-(Abgangsgruppen-)Bindung gebrochen, so dass das nukleophile Acylsubstitutionsprodukt entsteht.
Hier ein Beispiel für eine nukleophile Acylsubstitutionsreaktion zwischen einem Säurechlorid und dem N3-Ion zur Bildung eines Acylazids:
5. Umlagerung von Acylaziden: Die Curtius-Umlagerung
Die häufigste Verwendung von Acylaziden besteht darin, dass sie beim Erhitzen zu Isocyanaten umgelagert werden, eine Reaktion, die als Curtius-Umlagerung bekannt ist.
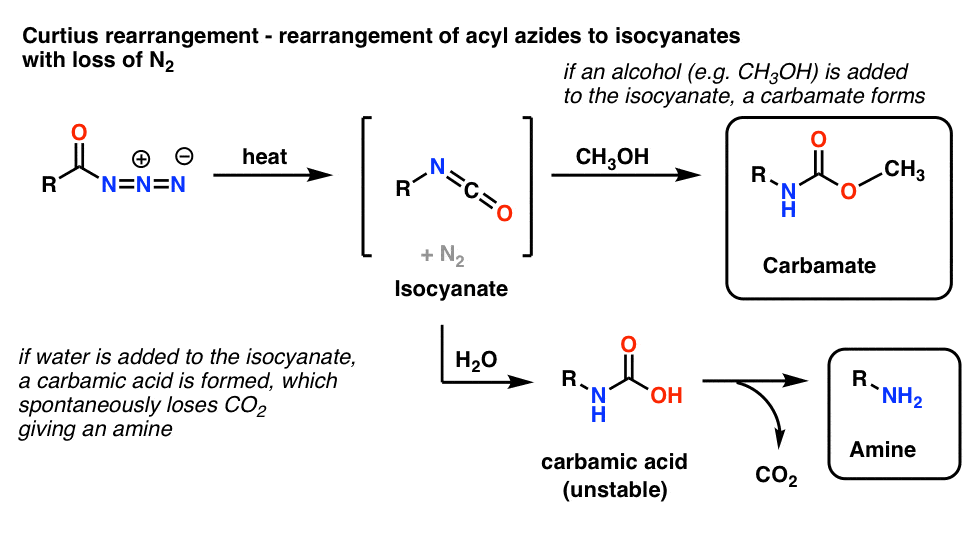
- Wird die Curtius-Umlagerung in Gegenwart eines Alkohols wie Methanol durchgeführt, entsteht ein Carbamat.
- Wird stattdessen Wasser zugegeben, bildet sich kurzzeitig eine instabile Carbaminsäure, die dann Kohlendioxid verliert und ein primäres Amin ergibt.
Warum könnte dies nützlich sein? Hier ist eine Möglichkeit.
Es gibt viele Methoden zur Herstellung aromatischer Carbonsäuren, aber nicht so viele gute Möglichkeiten zur Bildung von C-N-Bindungen an aromatischen Ringen. Nehmen wir an, Sie haben eine Benzoesäure (z. B. p-Methylbenzoesäure) und müssen ein (geschütztes) aromatisches Amin bilden. Das Curtius-Protokoll stellt eine gute Möglichkeit dar, eine neue C-N-Bindung am Ring zu bilden, ohne auf Nitrierung und Reduktion zurückgreifen zu müssen.
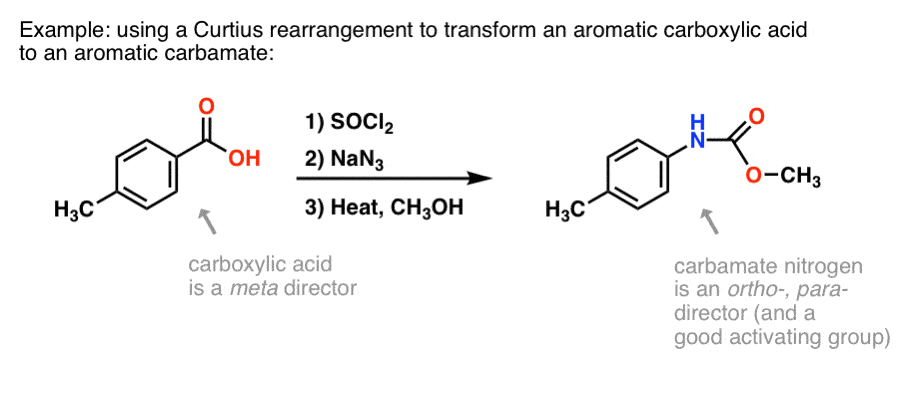
(Auf diese Weise ist es gewissermaßen ein Stickstoff-Äquivalent der Baeyer-Villiger-Oxidation. )
Weitere Beispiele für Azid-Nucleophile: Epoxid-Öffnung und Konjugat-Addition
Zwei weitere Anwendungen des Azid-Ions als Nucleophil sind die Öffnung von Epoxiden (im Wesentlichen ein SN2-Prozess – man beachte die Umkehrung der Konfiguration) und auch die Konjugat-Addition an alpha,beta-ungesättigten Ketonen:
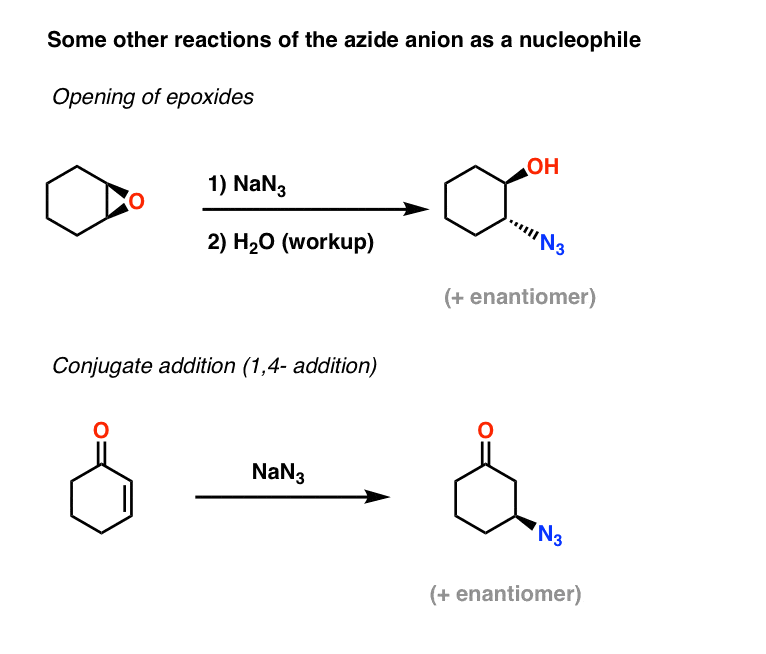
Die resultierenden Alkylazide können dann mit den oben beschriebenen Methoden zu primären Aminen reduziert werden.
Anmerkungen
Fußnote: Azid-Alkyn-Cycloadditionen, auch bekannt als. „Click“-Chemie
Eine interessante und nützliche Anwendung organischer Azide, die es noch nicht in die Einführungslehrbücher der organischen Chemie geschafft hat (aber wahrscheinlich in naher Zukunft schaffen wird), ist ein Prozess, der technisch als „kupferkatalysierte Azid-Alkin-Cycloaddition“ bezeichnet wird, aber üblicherweise einfach „Alkin-Azid-Click-Reaktion“ genannt wird.
Wenn ein endständiges Alkin mit einem Kupferkatalysator in Gegenwart eines organischen Azids behandelt wird, kommt es rasch zu einer Cycloaddition, die zur Bildung eines 1,2,3-Triazols führt.
Wir wollen nicht zu sehr ins Detail gehen, aber diese ringbildende Reaktion beinhaltet 6 pi-Elektronen und ist ein Cousin der Diels-Alder-Reaktion (Nörgler werden zu Recht anmerken, dass die kupferkatalysierte Version technisch gesehen kein konzertierter Prozess ist, aber die nicht katalysierte Version ist es)
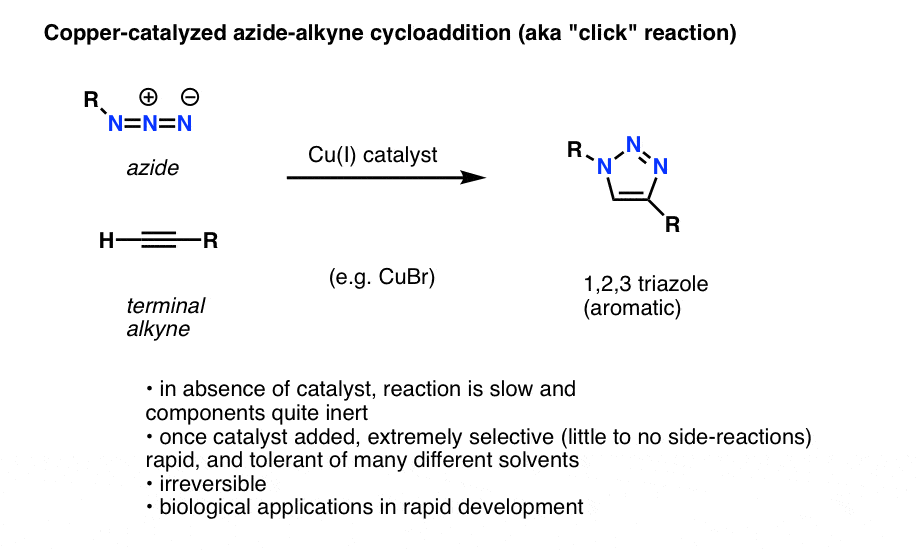
Die Reaktion ist aus mehreren Gründen bemerkenswert:
- Die reaktiven Partner (endständiges Alkin und organisches Azid) sind in Abwesenheit eines Katalysators unter den meisten Bedingungen relativ inert.
- Sobald Kupfer hinzugefügt wird, erfolgt die Reaktion unter milden Bedingungen und in einer Vielzahl von Lösungsmitteln (einschließlich Wasser) extrem schnell.
- Sie ist unter diesen Bedingungen extrem selektiv, die Alkin- und Azidpartner reagieren nur miteinander, irreversibel.
- Das Produkt, ein Triazolring, ist aromatisch und stabil
Einer der Begründer dieser Reaktion, Barry Sharpless, hat sie als „Klick“-Reaktion bezeichnet, weil sie einer Reaktion am nächsten kommt, die wie das reibungslose „Zusammenklicken“ zweier komplementärer Legosteine funktioniert.
Was diese Reaktion in letzter Zeit besonders nützlich gemacht hat, ist die Tatsache, dass Azid- und Alkinpartner in Moleküle von biologischem Interesse eingebaut und bei Bedarf „zusammengeklickt“ werden können.
Zum Beispiel:
- Das Anbringen eines Acetylens an der 5′-Position eines Zuckers und eines Azids an der 3′-Position wurde verwendet, um „geklickte“ DNA herzustellen, wobei das Triazol das Organophosphat ersetzt.
- Unglaublicherweise hat eine Gruppe „geklickte“ DNA hergestellt, sie in menschliche Zellen eingebracht und es geschafft, sie durch Boten-RNA zu transkribieren.
- Azidhaltiges AZT (oben) wirkt, indem es die Transkriptionsmaschinerie blockiert. Einige clevere Leute haben einen Weg gefunden, die Azid-Alkin-Klickreaktion für die schnelle Genomsequenzierung einzusetzen, eine Technik, die als ClickSeq bekannt ist.
Takata verwendete in den frühen 1990er Jahren Natriumazid und wechselte dann zu Tetrazol und dann zu Ammoniumnitrat.
Aus „Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis“.
Ammoniumnitrat war etwa ein Zehntel des Preises von Tetrazol, so Upham, der auch Patente der Industrie überprüft hat. Aber Ammoniumnitrat hatte einen kritischen Fehler, der seiner Meinung nach andere Airbag-Hersteller dazu veranlasste, es aufzugeben: Ammoniumnitrat besteht aus fünf Phasen mit unterschiedlicher Dichte, die es schwierig machen, es über einen längeren Zeitraum stabil zu halten. Ein mit Ammoniumnitrat hergestelltes Treibmittel würde bei Temperaturschwankungen anschwellen und schrumpfen, und schließlich würde die Tablette zu Pulver zerfallen. Wasser und Feuchtigkeit würden diesen Prozess beschleunigen. Pulver brennt schneller als eine Tablette, so dass ein Airbag, dessen Treibmittel zerfallen ist, sich wahrscheinlich zu aggressiv entfalten würde. Die kontrollierte Explosion wäre dann nur eine Explosion. „Alle haben einen bestimmten Weg eingeschlagen, nur Takata hat einen anderen Weg eingeschlagen“, sagt Jochen Siebert, der die Airbagbranche seit den 1990er Jahren verfolgt und heute Geschäftsführer von JSC Automotive Consulting ist. „Wenn man die Konferenzunterlagen von damals liest, sieht man, dass die Leute gesagt haben: ‚Nein, das solltet ihr nicht. Es ist gefährlich.‘ „
Splitter aus den fehlerhaften Airbags haben weltweit 13 Menschen getötet und mehr als 100 verletzt.
Am 25. Juni 2017 meldete Takata angesichts von Verbindlichkeiten in Höhe von über 11 Milliarden Dollar Insolvenz an.
Primäre Aminsynthese „Do’s and Don’ts“ :
(Fortgeschrittene) Referenzen und weiterführende Literatur
Azide sind in der organischen Synthese nützlich, und ein Highlight der Azidchemie ist in den folgenden Referenzen angegeben.
- Nucleophile Reaktivität des Azidions in verschiedenen Lösungsmitteln
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, München, Deutschland) hat seine Karriere damit verbracht, zur grundlegenden physikalischen organischen Chemie beizutragen, indem er Elektrophilie und Nukleophilie quantifizierte und Skalen zum Vergleich der Reaktivität verschiedener Nukleophile und Elektrophile entwickelte. - Die SN2-Verschiebungen an 2-Norbornylbrosylaten
Klaus Banert und Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - Eine verbesserte Synthese von Azidothymidin
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nukleoside, Nukleotide & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azide können als Nukleophile in SN2-Reaktionen verwendet werden. Ref. #3 zeigt die Verwendung von Azidionen bei der Synthese von AZT (Azidothymidin). Die Umwandlung von 1 zu 5 über 3 in Ref. #Nr. 3 wird die Mitsunobu-Reaktion verwendet, die die Verdrängung einer -OH-Gruppe durch ein Nukleophil mit Umkehrung der Konfiguration ermöglicht. - Reduktion organischer Azide zu primären Aminen mit Lithiumaluminiumhydrid
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Die Reduktion von organischen Aziden zu primären Aminen ist eine bequeme Methode zur Synthese von primären Aminen, die sonst mit Standardmethoden nur schwer selektiv zu synthetisieren sind. - Die explosive Empfindlichkeit der Metallazide gegenüber Stößen
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Eine Untersuchung der Stoßempfindlichkeit von NaN3, TlN3 und Pb(N3)2. - Die Curtius-Reaktion
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Eine alte, aber umfassende Übersicht über die Curtius-Reaktion, die die Geschichte der Entdeckung dieser Umlagerung, den Umfang der Substrate, die Grenzen, den Vergleich mit anderen ähnlichen Reaktionen und experimentelle Verfahren umfasst. - Synthetische Methoden und Reaktionen. 121. Zinkjodid-katalysierte Herstellung von Aroylaziden aus Aroylchloriden und Trimethylsilylazid
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Ein bequemes Verfahren zur Herstellung aromatischer Arylazide von Nobelpreisträger Prof. George A. Olah. Diese können dann für Curtius-Umlagerungen verwendet werden.
Epoxidöffnung und konjugierte Addition:
- CYCLOHEXENE IMINE (7-AZA-BICYCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh und Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Dies ist ein besonders nützliches Verfahren, da es sich um eine Staudinger-Reaktion zur Umwandlung von Epoxiden in NH-Aziridine (das Stickstoff-Analogon der Epoxide) handelt. Die Synthese kann knifflig sein, aber es wurden hier viele Details angegeben, so dass sie reproduziert werden kann, passend zu einem Verfahren in Organic Syntheses. - Amin-katalysierte Addition von Azid-Ionen an α,β-ungesättigte Carbonylverbindungen
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Diese Arbeit ist interessant, da sie eine frühe Form der Organokatalyse darstellt und wahrscheinlich über ein Imin- oder Iminium-Ionen-Zwischenprodukt verläuft. Leider wird der Begriff nirgends in der Arbeit verwendet – diese Autoren hätten Prof. MacMillan zuvorkommen können! - Click Chemistry: Diverse chemische Funktionen aus ein paar guten Reaktionen
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Die Cu-katalysierte Cycloaddition von Aziden mit Alkinen wurde von Nobelpreisträger Prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) aufgrund ihrer Einfachheit, hohen Ausbeute, schnellen Kinetik und Kompatibilität mit einer breiten Palette von Bedingungen und Substraten als „Klick“-Reaktion bezeichnet. Cu-freie Reaktionen sind auch möglich, wenn gespannte Alkine verwendet werden (z. B. Cyclooctine).