- Review Artikel
- Enterokutane Fistel: Evidenzbasiertes Management
- Abstract
- Einführung
- Tabelle 1
- Tabelle 1: Klassifizierung.
- Tabelle 2
- Tabelle 2: ECF Prognostische Variablen.
- Klassifikation
- Prognostische Faktoren für ECF
- Diagnose
- Abbildung 1
- Management
- Wiederbelebung
- Quellenkontrolle
- Abflussmanagement
- Wundversorgung
- Tabelle 3
- Tabelle 3: Zeit bis zum endgültigen Management.
- Ernährung
- Schlussfolgerung
Review Artikel
Enterokutane Fistel: Evidenzbasiertes Management
Ryan P Dumas1*, Sarah A Moore1 und Carrie A Sims2
1Abteilung für Traumatologie, chirurgische Intensivpflege &Notfallchirurgie, Perelman School of Medicine an der University of Pennsylvania, Philadelphia, PA, USA
2Abteilung für Chirurgie, Abteilung für Traumatologie, chirurgische Intensivpflege & Notfallchirurgie, Perelman School of Medicine an der University of Pennsylvania, Philadelphia, PA, USA
*Zuständiger Autor: Ryan P. Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Die Behandlung von enterokutanen Fisteln (ECF) ist eine klinische Fertigkeit, die im Armamentarium jedes Allgemeinchirurgen enthalten sein sollte. Obwohl die endgültige Behandlung häufig auf einem chirurgischen Verschluss beruht, ist die präoperative Pflege und Sorgfalt von größter Bedeutung, um ein erfolgreiches Ergebnis zu gewährleisten. Die Behandlung dieser Patienten sollte sich auf vier Schlüsselphasen konzentrieren. Die erste Phase ist durch eine angemessene Erkennung und Wiederbelebung gekennzeichnet. In der zweiten Phase wird eine vollständige Ernährungsbewertung und -planung vorgenommen. Die Röntgenuntersuchung in der dritten Phase hilft bei der Bestimmung der Anatomie des EKF. Diese Übersicht konzentriert sich auf die Schlüsselaspekte, die jede Phase definieren und dem Allgemeinchirurgen helfen, die Chancen für ein positives Ergebnis zu maximieren.
Einführung
Die Entwicklung einer enterokutanen Fistel (ECF), definiert als anomale Verbindung zwischen dem Darmlumen und der äußeren Haut, ist trotz der Fortschritte sowohl in der chirurgischen als auch in der medizinischen Versorgung eine signifikante Ursache für Morbidität und Mortalität. Die Gesamthäufigkeit von ECF ist jedoch nicht bekannt, und die meisten Daten über ECF stammen aus großen retrospektiven oder chirurgiespezifischen Serien von Institutionen. Bemerkenswerterweise sind nur 25 % aller ECF sekundär auf entzündliche Darmerkrankungen, Divertikelpathologie, Trauma, Bestrahlung und Malignität zurückzuführen. Im Gegensatz dazu sind fast 75 % aller ECFs die direkte Folge eines laparoskopischen oder offenen chirurgischen Eingriffs, wobei ein astomotisches Leck nach einer Ententerektomie für über 50 % dieser Fisteln verantwortlich ist. Die übrigen Fisteln sind auf unbeabsichtigte iatrogene Verletzungen zurückzuführen, wie z. B. Enterotomien oder unerkannte thermische Verletzungen, die während einer Operation auftreten. Da es sich bei der ECF in den meisten Fällen um ein vom Chirurgen verursachtes Problem handelt, liegt die Verantwortung für die Vorbeugung sowie die angemessene Behandlung, Planung und endgültige Behandlung zu Recht beim Chirurgen.
Morbidität und Mortalität nach ECF sind außerordentlich hoch. Bei schätzungsweise 90 % der Patienten kommt es zu einer EKT-bedingten Morbidität, die von Hautexkoriationen über Dehydrierung bis hin zu Sepsis reicht. 5-20 % der Patienten sterben an einer EKT, wobei die Sterblichkeit von einer Reihe von Faktoren wie der zugrunde liegenden Infektion und der Lage der Fistel abhängig ist. Da die Haupttodesursache bei Patienten mit Ekzemen die Sepsis ist, bleibt die Kontrolle der Quelle einer der Eckpfeiler der Therapie. In retrospektiven Serien wurde festgestellt, dass die Sterblichkeit bei einer Sepsis um das 16-fache und bei einer unkontrollierten Infektion um das 22-fache ansteigt. Eine frühzeitige und endgültige Behandlung von undrainierten Ansammlungen in Verbindung mit einer kurzfristigen antimikrobiellen Behandlung kann daher die Ergebnisse erheblich verbessern. In den meisten Serien scheint auch die Sterblichkeit mit der Fistelgröße und -lage zu korrelieren. Die Sterblichkeitsrate steigt von 26 % bei Fisteln mit geringem Durchfluss auf 50 % bei Fisteln mit hohem Durchfluss, wenn man die mit der ECF-Behandlung verbundenen Herausforderungen in Bezug auf Flüssigkeit, Elektrolyte und Ernährung bedenkt. Die Sterblichkeit korreliert auch mit der Lage der Fistel und sinkt bei distaleren Fisteln. Während Jejunalfisteln mit 29 % die höchste Sterblichkeit aufweisen und wesentlich schwieriger zu handhaben sind, ist die Sterblichkeit bei Kolonfisteln mit 6 % am niedrigsten.
Neben den Auswirkungen auf den Patienten, die sowohl physiologischer als auch psychologischer Natur sind, stellt das EKT-Management eine enorme Belastung für die Ressourcen des Gesundheitswesens dar. Schätzungen zufolge belaufen sich die Kosten für die Behandlung von Ekzemen auf weit über 500.000 US-Dollar und erfordern ein multidisziplinäres Team aus Ernährungsberatern, Wundpflegern und Chirurgen, um ein gutes Ergebnis zu gewährleisten. Die Bedeutung von Behandlungszentren mit hohem Fachwissen sollte nicht unterschätzt werden, denn es hat sich gezeigt, dass die Sterblichkeit von 42 % auf 20 % gesenkt werden kann.
Tabelle 1

| Anatomisch | Proximal oder distal | Magen, Duodenal, Jejunal, Ileal, Kolon |
| Physiologisch | Hoher, mäßiger, niedriger Output | Hoher Output >500 cc/Tag Mäßiger 200-500cc/Tag Niedriger Output < 200cc/Tag |
| Etiologie | Iatrogen vs. spontan Traumatisch |
Bösartig Strahlung Entzündliche Darmerkrankung Divertikel |
Tabelle 1: Klassifizierung.
Tabelle 1
Klassifizierung.
Tabelle 2

| VORTEILE | UNFORABLE |
|---|---|
| Nährstoffreich | Nährstoffarm |
| – Albumin >3.0 | – Albumin niedrig, Transferrin niedrig |
| Langer Fistelgang (>2cm) | Kurze Fistel, multiple, komplexe Fisteln |
| Divertikuläre Fistel | Großer enteraler Defekt (>1cm), sichtbare Schleimhaut |
| geringe Leistung | hohe Leistung (>500cc/Tag) |
| Einzelne Fistel | Vorbestrahlung |
| Intestinale Kontinuität | Mehrere vorherige Operationen |
| Index-Operation im selben Zentrum durchgeführt | Externe Überweisungen an ein Zentrum mit hohemZentrum mit hohem Volumen |
Tabelle 2: ECF Prognostische Variablen.
Tabelle 2
ECF Prognostische Variablen.
Klassifikation
Es gibt kein universelles oder gut etabliertes Klassifikationsschema fürECFs. Fisteln werden im Allgemeinen anatomisch, physiologisch oder nach Krankheitsprozess klassifiziert. Fisteln können außerdem nach der Menge des täglichen Ausflusses klassifiziert werden. Es ist unbedingt erforderlich, dass der Fistelausfluss genau dokumentiert wird, da die Menge eine Änderung der Behandlung erforderlich machen kann. In Tabelle 1 sind drei verschiedene Klassifizierungsparadigmen aufgeführt.
Prognostische Faktoren für ECF
Die prognostischen Faktoren für ECF sind sehr gut beschrieben und stimmen mit dem Standardchirurgie-Dogma überein. Patienten mit einer proximalen Fistel mit hohem Durchfluss und niedrigem Albuminwert (und Patienten ohne Begleiterkrankungen mit Fisteln, die durch einen chirurgischen Eingriff entstanden sind und einen niedrigen Durchfluss aufweisen, haben eine bessere Prognose mit höheren Spontanverschlüssen. In Tabelle 2 sind viele der Variablen aufgeführt, die ein erfolgreiches Ergebnis vorhersagen können.
Die Bedeutung der institutionellen Unterstützung und der multidisziplinären Expertise als positiver Prognosefaktor kann nicht genug betont werden.Mehrere Studien haben bestätigt, dass institutionelle Erfahrung und Volumen entscheidende Faktoren für die Verringerung der Morbidität und die Verbesserung der Mortalität sind. Vor kurzem hat die Canadian Association for EnterostomalTherapy (Kanadische Vereinigung für Enterostomatherapie) die Bedeutung einer multidisziplinären Versorgung kodifiziert, indem sie in ihren „ECF Best Practice“-Empfehlungen neun wesentliche Teammitglieder benannte. Dieser integrierte Teamansatz, der von Chirurgen über Apotheker bis hin zu Kaplanen reicht, erkennt das Fachwissen an, das jedes Fachgebiet in die Pflege dieser komplexen Patienten einbringt.
Diagnose
Ein schwelender postoperativer Verlauf, der durch Ileus und die Entwicklung einer postoperativen Wundinfektion kompliziert wird, ist ein Vorbote für EKT. Sobald der Verdacht auf eine Fistel besteht oder diese bei der körperlichen Untersuchung festgestellt wurde, sind radiologische Untersuchungen eine notwendige Ergänzung. 97 % aller Patienten werden in irgendeiner Form radiologisch untersucht. Eine kontrastmittelverstärkte CT-Untersuchung ist unerlässlich, um das Vorhandensein eines Abszesses oder einer nicht drainierten Ansammlung festzustellen. Sobald die Quellenkontrolle optimiert wurde, spielt die fluoroskopische Fistulographie eine wichtige Rolle bei der Definition der Fistelanatomie. Ein Fistulogramm hilft, den Ursprung zu lokalisieren, die Länge zu bestimmen, das Vorhandensein einer distalen Obstruktion zu beurteilen und festzustellen, ob die Fistel in Kontinuität mit dem restlichen Darm steht. Sobald die Diagnose einer ECF bestätigt ist, sollte der Schwerpunkt auf das Management gelegt werden.
Abbildung 1
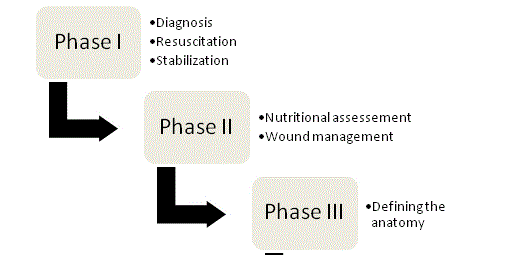
Abbildung 1
Vier Phasen des ECF-Managements.
Management
Die Grundsätze des ECF-Managements wurden erstmals 1964 von Chapman und Kollegen vertreten und sind bis heute die Eckpfeiler der Therapie. In ihrem ursprünglichen Artikel nannten Chapman et al. vier Schlüsselfaktoren: Flüssigkeitswiederbelebung, Quellenkontrolle, Abflussmanagement und Hautschutz. Als fünftes Schlüsselelement hat sich in letzter Zeit die Bedeutung der Ernährung herauskristallisiert. Bei jedem Fistelpatienten sollte ein organisierter, systematischer Ansatz verfolgt werden, um die Chancen auf ein erfolgreiches Ergebnis zu optimieren, und das Management kann letztlich in vier Phasen unterteilt werden (Abbildung 1).
Wiederbelebung
Die Wiederbelebung eines Patienten mit einer neu diagnostizierten ECF folgt vielen der gleichen Prinzipien wie die Wiederbelebung septischer Patienten, und die Grundsätze der Surviving Sepsis Campaign sollten als Rahmen dienen. Die Erstversorgung sollte sich auf eine aggressive Flüssigkeitsreanimation, eine rasche Beurteilung und Korrektur von Elektrolyt-Ungleichgewichten und die Normalisierung der Laktatazidose konzentrieren. Patienten mit ECF sind aufgrund der anhaltenden GI-Verluste häufig hyponatriämisch, hypokaliämisch und azidotisch. Bei Patienten mit Fisteln mit hoher Ausscheidung sollten die Flüssigkeits-, Elektrolyt- und Bikarbonatverluste intravenös ersetzt werden, um eine Dehydrierung und tiefgreifende metabolische Instabilität während der anfänglichen Stabilisierungsphase zu vermeiden. Eine sorgfältige Überwachung der Urinausscheidung und ein gezielter Ersatz des Fistelausflusses alle 4 bis 8 Stunden verhindern eine anhaltende Dehydrierung.
Quellenkontrolle
Nach der Wiederbelebung des Patienten sollte die Aufmerksamkeit auf die Quellenkontrolle gerichtet werden. Wie bereits erwähnt, ist eine kontrastmittelverstärkte CT-Untersuchung hilfreich, um nicht drainierte Ansammlungen und Abszesse zu erkennen. Bei postoperativen Patienten wird die Quellensicherung am ehesten durch die interventionelle Radiologie erreicht. Bei unzugänglichen Ansammlungen oder unkontrollierter intraabdominaler Sepsis kann jedoch eine Operation unumgänglich sein. Empirische intravenöse Breitbandantibiotika sollten nicht routinemäßig zur Behandlung von ECF eingesetzt werden, es sei denn, es gibt Hinweise auf intraabdominale Ansammlungen oder eine Wundinfektion mit einer damit verbundenen Zellulitis. Wann immer es möglich ist, sollten Antibiotika auf spezifische Kulturdaten ausgerichtet und auf weniger als 2 Wochen begrenzt werden.
Abflussmanagement
Das Management eines erfolgreichen Abflusses kann erhebliche Auswirkungen auf Volumenstatus, Elektrolythaushalt, Ernährung und Hautintegrität haben.Der Einsatz von Protonenpumpeninhibitoren kann beide Ziele erreichen, und die Dosis sollte so lange titriert werden, bis der pH-Wert des Ausflusses über 6 liegt und das Ausflussvolumen weniger als 1 l/Tag beträgt. Obwohl Psyllium äußerst nützlich sein kann, um den Ausfluss aufzublähen und die Transitzeit zu verlängern, sind Antimotilitäts- und Antisekretionsmittel, einschließlich Loperamid, Atropindiphenoxylat, Codein, Opiumtinktur und sogar Methadon, die Hauptstütze der Volumenreduktion. In Anbetracht seiner Rolle als universeller gastrointestinaler Hormoninhibitor wurden die Auswirkungen von exogenem Somatostatin auf Patienten mit EKT intensiv erforscht. Trotz einer beträchtlichen Anzahl randomisierter kontrollierter Studien sind aussagekräftige Schlussfolgerungen aufgrund der geringen Stichprobengröße und des uneinheitlichen Studiendesigns nur schwer zu ziehen. Octreotid, ein länger wirkendes Somatostatin-Analogon, wurde ebenfalls als ECF-Begleitmittel mit vielversprechenden Ergebnissen untersucht. Octreotid 100 mcg dreimal täglich kann das Ausflussvolumen verringern und hat in einigen Studien gezeigt, dass es die Zeit bis zum spontanen Verschluss verkürzt. Daher kann eine Octreotid-Therapie über 72 Stunden mit engmaschiger Überwachung des Fistelausflusses gerechtfertigt sein, insbesondere in Fällen, in denen andere Therapien das Ausflussvolumen nicht verringern konnten. Zu den häufigen Nebenwirkungen gehören Hyperglykämie, Kopfschmerzen und Cholelithiasis.
Während die Daten eindeutig belegen, dass Fisteln mit niedrigem Ausstoß eine höhere Rate an Spontanverschlüssen aufweisen, ist es weniger eindeutig, dass eine Verringerung des Ausstoßvolumens den Fistelverschluss verbessert. Nichtsdestotrotz kann eine Verringerung des Ausstoßvolumens die Belastung durch das Fistelmanagement erheblich verringern und sich positiv auf das Wohlbefinden der Patienten auswirken.
Wundversorgung
Eine der schwierigsten und ressourcenintensivsten Aspekte des ECF-Managements ist vielleicht die lokale Kontrolle des Ausflusses. Ein erfolgreicher Ausfluss kann die Haut schnell zerstören und schwer zu behandelnde Reizungen verursachen. Daher ist ein angemessenes Hautmanagement mit Barrierecremes, Feuchtigkeitsbarrieren, Beuteln und Absaugvorrichtungen von entscheidender Bedeutung. Insbesondere Fisteln mit hohem Durchfluss erfordern oft ein kompliziertes Netz von Drainagen, Beuteln und Absaugungen, um den Abfluss angemessen zu kontrollieren. Hochspezialisierte Wundversorgungsteams und enterostomale Therapeuten sind sowohl für das Wundmanagement als auch für den Patientenkomfort von unschätzbarem Wert.
Angesichts des allgegenwärtigen Einsatzes der Unterdrucktherapie (NPT) bei der Behandlung von Wunden und offenen Bäuchen ist es nicht überraschend, dass die NPT Teil des chirurgischen Arsenals zur Behandlung von Ekzemen geworden ist. In der bisher größten Serie berichteten Wainstein et al. über ihre Erfahrungen mit 91 Patienten mit Fisteln mit hohem Output, die mit einem Unterdruck von -350 bis -600 mmHg behandelt wurden. Neben einer signifikanten Verringerung der Ausflussmenge von durchschnittlich 1400 cc/Tag auf 138 cc/Tag wurde bei 46 % der Patienten ein Spontanverschluss erreicht.2016 veröffentlichten Misky et al. eine Metaanalyse, in der der Einsatz von NPT bei ECF untersucht wurde. Anhand von zehn retrospektiven Studien mit insgesamt 151 Patienten fanden diese Autoren heraus, dass die mediane Spontanverschlussrate 65 % betrug (von 7 % bis 100 %) und die mediane Zeit bis zum Verschluss 58 Tage betrug. Die Forscher berichteten auch über eine Fistelneubildungsrate von 4,4 % – eine bekannte Komplikation, die einige Praktiker stutzig gemacht hat.Es sind zwar weitere Untersuchungen erforderlich, um festzustellen, ob die NPT die Verschlussrate von ECF definitiv verbessern oder die Zeit bis zum spontanen Verschluss verkürzen kann, doch sollten die positiven Vorteile dieser Verbände nicht übersehen werden. Zumindest kann diese Technologie das Management von ECF durch die Kontrolle des Ausflusses, den Schutz der Haut und die Verringerung der Häufigkeit des Verbandwechsels erleichtern.
Tabelle 3

| Prüfer | Institutionelle Praxis |
|---|---|
| Hollington | 8 Monate |
| Evenson | 4 Monate |
| Rahbour | 12 Monate |
| Datta | 6 Monate |
| Lynch | 6 Monate |
| Li | 6 Monate |
| Mcintyre | 6 Monate |
Tabelle 3: Zeit bis zum endgültigen Management.
Tabelle 3
Zeitplan bis zur endgültigen Behandlung.
Ernährung
BeurteilungDer Ernährungszustand eines ECF-Patienten ist von größter Bedeutung. Vor dem Aufkommen peptidbasierter enteraler Formeln und totaler parenteraler Ernährung (TPN) verdeutlichen retrospektive historische Serien die Belastung durch Mangelernährung bei EKT-Patienten. In einer Serie von 157 Patienten in den 1950er und 1960er Jahren waren fast 75 % der Patienten mit proximalen Fisteln mangelernährt. Ähnliche Ergebnisse wurden von Chapman et al. berichtet, die feststellten, dass nur eine kleine Minderheit der Patienten optimal ernährt war und dass die EKT-bedingte Sterblichkeit von 55 % auf 12-16 % zurückging, sobald die Ernährung verbessert wurde.
Bei jedem Patienten mit einer EKT sollte eine vollständige Ernährungsbewertung durchgeführt werden. Obwohl die Harris-Benedict-Gleichung einen guten Ausgangspunkt für die Berechnung des Nährstoffbedarfs bietet, wird allgemein anerkannt, dass ECF-Patienten katabolisch und hyper-metabolisch sind. Im Allgemeinen benötigen diese Patienten eine erhöhte Kalorienzufuhr mit mindestens 25-30 kcal/kg/Tag in Form von Kohlenhydraten und Fett und 1,5 bis 2 Gramm Eiweiß/kg/Tag.
Der Ernährungszustand und die Fortschritte sollten regelmäßig neu bewertet werden. Insbesondere präoperatives Albumin hat sich als stärkster Prädiktor für Mortalität und Morbidität nach allgemeiner Chirurgie erwiesen, und Hypoalbuminämie ist nach wie vor ein signifikanter Prädiktor für schlechte Ergebnisse bei ECF-Patienten. Das vielleicht am besten untersuchte Protein in ECF ist jedoch Transferrin, und Werte über 140 wurden mit erhöhten Spontanverschlussraten und einer verringerten Sterblichkeit in Verbindung gebracht. Obwohl die Stickstoffbilanz ein hilfreiches Instrument sein kann, kann diese Standardmessung bei Patienten mit Fisteln mit hohem Ausstoß schwierig sein. In komplexeren Fällen, die nicht auf die Standardbehandlung ansprechen, können zusätzliche Tests wie die indirekte Kalorimetrie in Erwägung gezogen werden.
Parenteral vs. enterale Ernährung
Die parenterale Ernährung hat bei der Behandlung von ECF eine entscheidende Rolle gespielt, wobei ihre Verwendung 1969 von Dudrick fest etabliert wurde.In seinem richtungsweisenden Artikel, in dem er die optimale Behandlung von TPN beschrieb, kam Dudrick zu dem Schluss, dass: „Mit der ausschließlichen Anwendung der parenteralen Hyperalimentation werden Gewichtszunahme, positive Stickstoffbilanz, Wachstum und Entwicklung regelmäßig erreicht“. Obwohl die TPN die Sekretion des Magen-Darm-Trakts um 30-50 % reduziert und damit das Auftreten von Dehydratation und Elektrolytstörungen verringert, gibt es keine randomisierten Studien, die sich mit den Auswirkungen der TPN auf die anabole Umwandlung, die Spontanverschlussraten oder die Mortalität befassen. Nichtsdestotrotz ist die TPN trotz schwerwiegender Komplikationen wie Infektionen und Leberfunktionsstörungen nach wie vor eine beliebte Langzeitbehandlung.
In jüngster Zeit hat die Verwendung von enteraler Ernährung bei ECF jedoch an Bedeutung gewonnen. Der Einsatz enteraler Ernährung hat eine Reihe von Vorteilen, darunter geringere Kosten, weniger Infektionen und eine bessere immunologische Funktion im Vergleich zur TPN. Darüber hinaus kann selbst eine enterale Zufuhr von nur 20 % der Kalorien zur Aufrechterhaltung der Darmflora und zur Verringerung der bakteriellen Translokation beitragen.
In mehreren Serien wurde von überraschenden Erfolgen der enteralen Ernährung bei ECF-Patienten berichtet. In einer retrospektiven Serie von Li et al. wurden 86,4 % von 1168 Patienten mit enteraler Unterstützung erfolgreich behandelt. Die enterale Ernährung kann sogar bei Fisteln mit hohem Output erfolgreich eingesetzt werden, wenn sie mit elementaren Formeln, Antimotilitätsmitteln und Ballaststoffen kombiniert wird. In einer Serie von 335 Patienten mit Fisteln mit hohem Output konnten Levy et al. bei 85 % ihrer Kohorte mit Hilfe von enteraler Ernährung erfolgreich eine TPN-Abhängigkeit erreichen. Interessanterweise waren die Sterblichkeit und die Rate des Spontanverschlusses trotz der enteralen Ernährung und der fehlenden „Darmruhe“ ähnlich hoch wie in früheren Serien.
Bei einer Fistel mit hohem Output und einem distalen Mukokutan-Schenkel kann die Fistellyse eine wichtige Ergänzung zur enteralen Standardernährung sein. Die Fistuloklyse hat ihren Ursprung in der Praxis der Rückfütterung von Chymus bei Neugeborenen und kann sich entweder auf die Rückfütterung von Erfolgen oder auf die Ergänzung zusätzlicher enteraler Sondennahrung über einen Katheter beziehen, der in das distale Glied einer EKT gelegt wird. Teubner et al. beschrieben 2004 in einer Fallserie von zwölf Patienten mit proximalen Fisteln erstmals die Fistuloklyse als Therapie der ECF. Seitdem haben eine Reihe von Fallberichten und kleinen Serien die ernährungsphysiologische Wirksamkeit dieser Technik gezeigt. Im Vergleich zu einer Kohorte von Patienten, die eine TEN ohne Fistuloklyse erhielten, wiesen Patienten mit einer Fistel mit hohem Output, die mit Fistuloklyse behandelt wurden, signifikant verbesserte Leberfunktionen und Ernährungsparameter auf. Die Fistuloklyse kann vor allem bei Patienten hilfreich sein, bei denen es zu TPN-bedingten Komplikationen wie Infektionen, Problemen mit dem venösen Zugang oder Leberversagen kommt. Komplikationen können jedoch auftreten und eine Obstruktion einschließen, wenn die peristaltische Aktivität des Dünndarms den Fistelkatheter distal in den Dünndarm vorschiebt.
Vitamine und Mineralien sind bei ECF-Patienten oft mangelhaft. Defizite an fettlöslichen Vitaminen sind häufig, während Defizite an wasserlöslichen Vitaminen selten sind, es sei denn, die Fistel befindet sich im proximalen Jejunum. Da Vitamin B12 nur in den letzten 50 bis 60 cm des Ileums resorbiert wird, ist bei vielen ECF-Patienten eine Vitamin-B12-Injektion erforderlich. Magnesium wird bei Fisteln mit hohem Output häufig verschwendet und sollte entweder mit intravenösem Magnesiumsulfat oder oralem Magnesiumchlorid ergänzt werden, um die enterale Resorption zu verbessern. Schließlich wurde eine hochdosierte Zufuhr von Zink und Vitamin C empfohlen. Omega-3-Fettsäuren und Fischöl wurden zwar in der Intensivmedizin mit einem gewissen Nutzen untersucht, doch wurden diese Nahrungsergänzungsmittel noch nie bei EKT-Patienten untersucht und werden nicht routinemäßig eingesetzt.
Operative Überlegungen
Die Rate des spontanen EKT-Verschlusses schwankt in der Literatur zwischen 15 und 75 %. Diese große Bandbreite an Verschlussraten spiegelt wahrscheinlich Unterschiede in der Patientenpopulation und den institutionellen Praktiken wider. Bei Fisteln ist die Wahrscheinlichkeit eines Spontanverschlusses nach 4 Wochen deutlich geringer; nur 10 % der Fisteln schließen sich nach zwei Monaten. Da die Spontanverschlußraten bei EKA gering sind, ist ein chirurgischer Eingriff oft die einzige definitive Behandlungsstrategie.
Die Entscheidung, eine EKA zu operieren, sollte jedoch nicht leichtfertig getroffen werden, da die Rezidivraten nach einer EKA-Entfernung zwischen 13 und 34 % liegen. Obwohl die Prinzipien der chirurgischen Intervention bei ECF viele der Grundprinzipien der allgemeinen Chirurgie beinhalten, ist der Zeitpunkt der Operation vielleicht der wichtigste Faktor, der zu berücksichtigen ist. Fazio et al. haben gezeigt, wie wichtig ein vorausschauendes Management bei der Betreuung von EKT-Patienten ist. Wenn die Operation weniger als 6 Wochen nach der Entstehung der EKT durchgeführt wurde, lag die Sterblichkeit bei über 20 %. Bei einer Verzögerung der Operation um mehr als 6 Wochen sank die Sterblichkeit jedoch auf 11 %.Außerdem führt eine frühe Operation möglicherweise zu einem erhöhten Rezidivrisiko. In einer Serie von Lynch et al. lag die Rezidivrate bei Patienten, die zwischen 2 und 12 Wochen nach der ECF-Bildung operiert wurden, bei 28 %, während sie bei einer Verzögerung von mehr als 12 Wochen auf 15 % sank. Tabelle 3 zeigt, wie lange die Experten zu warten raten, bevor sie einen operativen Eingriff bei einer nicht heilenden ECF in Erwägung ziehen.
Ein operativer Eingriff sollte nur mit vollem Einsatz und Verständnis von Patient und Chirurg durchgeführt werden. ECF-Verschlüsse sind langwierige, technisch anspruchsvolle Fälle mit dem Risiko erheblicher Komplikationen. In Anbetracht der Tatsache, dass 36 % der rezidivierenden Fisteln das Ergebnis von Verletzungen sind, die während der ECF-Verschluss-Operation entstanden sind, sollte bei der Lysis von Adhäsionen sehr sorgfältig vorgegangen werden, um eine unbeabsichtigte Verletzung des gesunden Darms zu vermeiden. Die Behandlung des fistelförmigen Darms sollte immer eine Darmresektion und eine primäre Astomose beinhalten. Eine Übernahmeresektion oder eine keilförmige Resektion der Fistel führt unweigerlich zu einem höheren Rezidivrisiko (36 % gegenüber 16 %).
Schlussfolgerung
Die enterokutane Fistel ist eine der schwierigsten Komplikationen, mit denen der Allgemeinchirurg konfrontiert wird. Die Anwendung eines sorgfältigen, systematischen und patientenzentrierten Ansatzes wird dazu beitragen, die klinischen Ergebnisse zu maximieren. Trotz der Konsistenz der Grundsätze des ECF-Managements bei allen Patienten ist jede Fistel einzigartig, und ihr Management wird zu einem großen Teil durch ihren Ausgang sowie ihre Lage und die Komorbiditäten des Patienten bestimmt. Chirurgische und institutionelle Erfahrungen unterstreichen die Bedeutung eines verzögerten Eingriffs. Obwohl Chirurgen und Patienten gleichermaßen den starken Wunsch haben können, mit einem chirurgischen Verschluss fortzufahren, ist den Patienten mit einer mindestens sechsmonatigen nichtoperativen Behandlung am besten gedient. Letztendlich erfordert die Langzeitpflege von EKT-Patienten eine multidisziplinäre Behandlung, die oft vom Chirurgen koordiniert wird.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Eine 11-jährige Erfahrung mit enterokutaner Fistel. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Management von enterokutanen Fisteln: 30-year clinical experience. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: Eine Überprüfung von 132 Fällen. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Review of 404 patients with gastrointestinal fistulas. Impact of parenteral nutrition. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimierung der Behandlung von oberen gastrointestinalen Fisteln. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Ernährung und Management der enterokutanen Fistel. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Klassifizierung und Pathophysiologie von enterokutanen Fisteln. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. The pathophysiology of enterocutaneous fistulas. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterokutane Fistel: verbessern sich die Behandlungsmöglichkeiten? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Ein multivariates Modell zur Bestimmung prognostischer Faktoren bei gastrointestinalen Fisteln. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historische Perspektiven in der Versorgung von Patienten mit enterokutaner Fistel. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutaneous fistula complicating trauma laparotomy: Eine große Ressourcenbelastung. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years‘ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterokutane Fistel: Bewährte Strategien und Updates. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Current management of enterocutaneous fistula. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. Eine zehnjährige Erfahrung. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Externe Fisteln aus dem Magen-Darm-Trakt. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Der präoperative Serumalbuminspiegel als Prädiktor für die operative Mortalität und Morbidität: Ergebnisse der National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Factors predictive of recurrence and mortality after surgical repair of enterocutaneous fistula. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Kann die intravenöse Ernährung als einziges Mittel zur Ernährung das Wachstum eines Kindes unterstützen und den Gewichtsverlust eines Erwachsenen ausgleichen? Eine bejahende Antwort. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Die Fistuloklyse kann die parenterale Ernährung bei der Ernährungsunterstützung von Patienten mit enterokutaner Fistel erfolgreich ersetzen. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis improves liver function and nutritional status in patients with high-output upper enteric fistula. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Management of enterocutaneous fistulas. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Chirurgisches Management von enterokutanen Fisteln mit hohem Output: eine 24-jährige Erfahrung. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative Chirurgie für enterokutane Fisteln. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Klinisches Ergebnis und Faktoren zur Vorhersage eines Rezidivs nach einer enterokutanen Fisteloperation. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Management of external gastrointestinal fistulas. Ann Surg. 1978;188:460-7.