ATP, NAD UND FAD
ATP
Zellen verwenden ein Molekül namens Adenosintriphosphat (oder ATP) als Energiequelle (siehe Abbildung 2). Die Phosphate in diesem Molekül können den Substraten in unseren Zellen Energie liefern. In unseren Zellen gibt es Enzyme, die ein Phosphat aus dem ATP entfernen und es an ein anderes Molekül – in der Regel ein Protein – binden können (siehe Abbildung 3). Wenn dies geschieht, spricht man von einer Phosphorylierung des Proteins. Stellen Sie sich das dritte Phosphat als einen kleinen Sack voller Energie vor. Wenn es auf ein Protein übertragen wird, kann diese Energie für eine bestimmte Aufgabe verwendet werden. In Abbildung 3 zum Beispiel ändert das Protein seine Form, wenn es phosphoryliert wird. Wenn Proteine ihre Form ändern, nennen wir dies oft eine Konformationsänderung der Proteinstruktur. Es gibt viele Proteine im Körper, die ein Phosphat aus ATP verwenden, um eine Konformationsänderung zu bewirken. Diese Verschiebung der Proteinform ermöglicht letztendlich Dinge wie Muskelkontraktion, Zellmobilität, Membrantransport und Enzymaktivität. Zellen und Leben existieren nur, wenn eine konstante und stetige Versorgung mit ATP vorhanden ist.
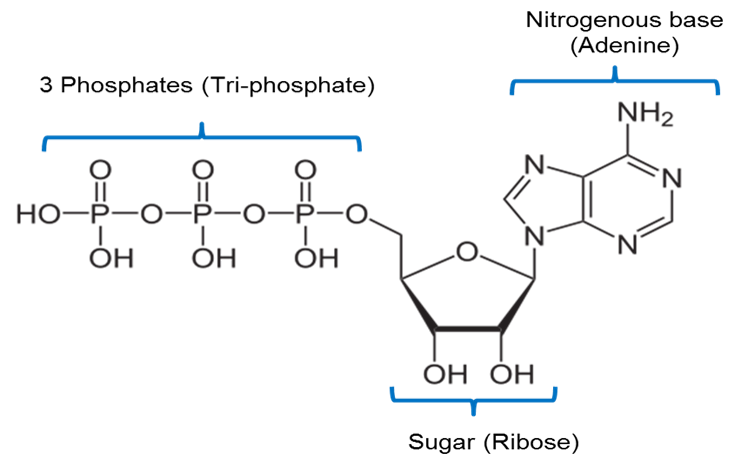
Bild erstellt von JS an der BYU Idaho F2013.
Das obige Bild ist eine Darstellung der chemischen Struktur von ATP. ATP enthält eine stickstoffhaltige Base namens Adenin, die mit einem 5-Kohlenstoff-Zucker namens Ribose und 3 Phosphatgruppen verbunden ist.
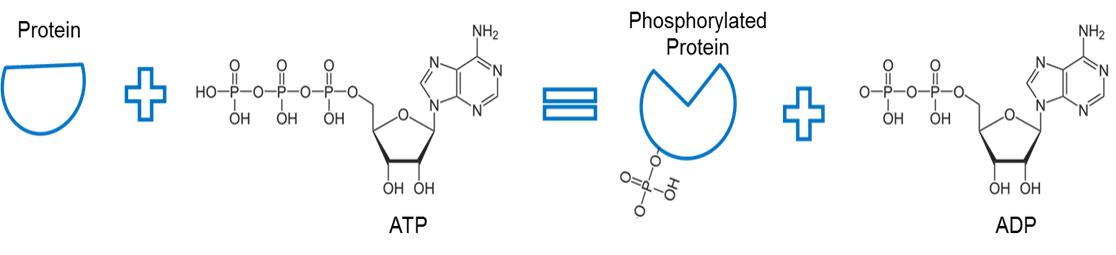
Bild erstellt von JS an der BYU Idaho F2013.
ATP wird zur Phosphorylierung eines Proteins verwendet. Ein Enzym, eine so genannte Kinase (nicht abgebildet), entfernt ein Phosphat aus ATP und ermöglicht eine Bindung zwischen dem Phosphat und einem anderen Protein. Die Bindung eines Phosphats an ein Protein auf diese Weise wird als Phosphorylierung bezeichnet. Die Phosphatbindung mit dem Protein hat eine höhere Energie. Man beachte, dass die Phosphorylierung diese Energie nutzt, um eine Konformationsänderung der Proteinform zu bewirken.
NAD und FAD
Nicotinamid-Adenin-Dinucleotid (NAD) und Flavin-Adenin-Dinucleotid (FAD) sind Coenzyme, die an reversiblen Oxidations- und Reduktionsreaktionen beteiligt sind. Diese Verbindungen werden häufig als Elektronenüberträger bezeichnet, da sie während der katabolischen Schritte beim Abbau organischer Moleküle wie Kohlenhydrate und Lipide Elektronen aufnehmen (reduziert werden). Dann können diese reduzierten Coenzyme diese Elektronen an eine andere biochemische Reaktion abgeben, die normalerweise an einem anabolen Prozess (wie der ATP-Synthese) beteiligt ist.
NAD+ / NADH
Nicotinamid-Adenin-Dinucleotid wird in seinem oxidierten Zustand als NAD+ bezeichnet, nachdem es reduziert wurde (oder Elektronen aufnimmt), wird es als NADH bezeichnet. Siehe Abbildung 4 für eine molekulare Veranschaulichung. Das Vitamin Niacin (auch B3 genannt) wird zur Herstellung dieser Verbindung verwendet. Niacin liefert die organische Ringstruktur, die direkt an der Übertragung eines Wasserstoffatoms und zweier Elektronen beteiligt ist. NAD+ kommt häufig in Verbindung mit einem „Dehydrogenase“-Enzym vor. Bei einer Dehydrogenase-Reaktion werden zwei Wasserstoffatome entfernt; eines in Form eines Hydrids (:H-) (ein Hydrid ist ein Wasserstoffatom mit 2 Elektronen) und eines in Form eines Wasserstoffkations (H+) (ein Wasserstoffkation hat natürlich keine Elektronen). Das Hydrid verbindet sich mit NAD+ und bildet eine reduzierte Verbindung von Nictinamid-Adenin-Dinukleotid (NADH). Das zweite Wasserstoffatom (H+) wird in die Lösung freigesetzt, siehe Abbildung 4.
Suchen Sie bei der Untersuchung der Stoffwechselreaktionen nach Reaktionen, bei denen NADH entsteht. NADH ist wichtig, da es die Wasserstoffatome und Elektronen, die es aufnimmt, an biochemische Prozesse abgibt, die die Elektronen und Wasserstoffatome zur Herstellung von ATP verwenden können.
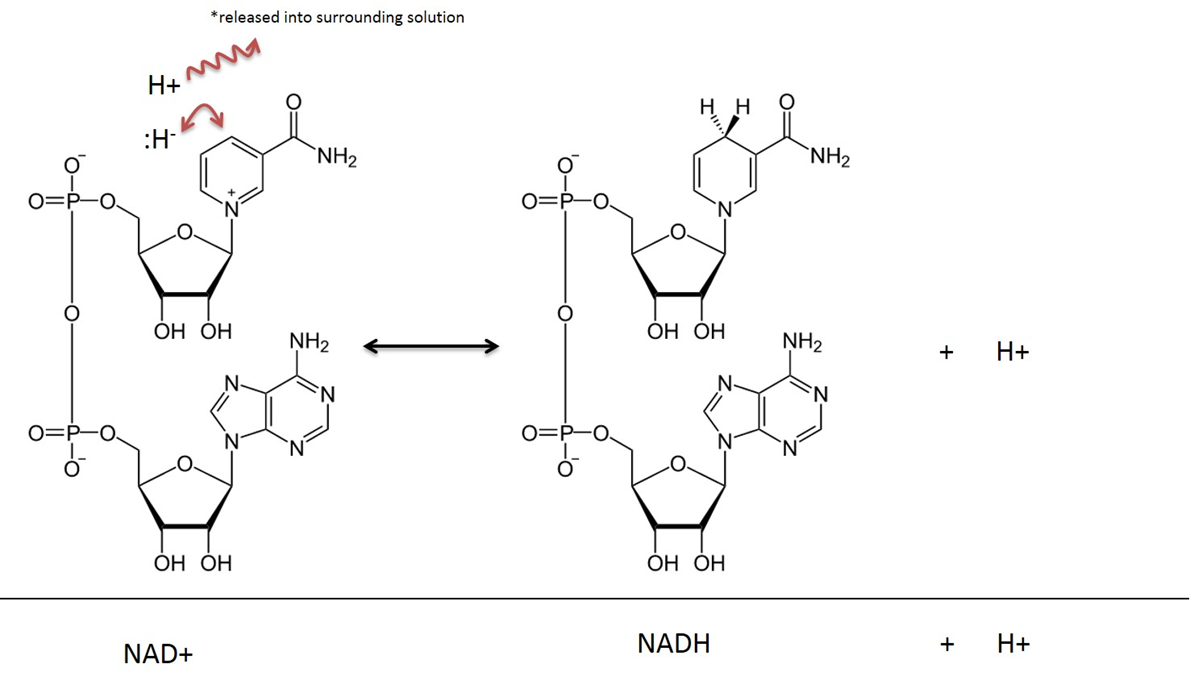
Bild erstellt von JS an der BYU Idaho F2013.
In Stoffwechselreaktionen, an denen NAD beteiligt ist, werden zwei Wasserstoffatome und zwei Elektronen aus einem Substrat entfernt und auf NAD+ übertragen. NAD+ nimmt ein Hydrid-Ion (ein Wasserstoff mit 2 Elektronen) auf und wird zu Nicotinamid-Adenin-Dinukleotid in der reduzierten Form (NADH). Das Wasserstoffkation, das bei der Reaktion ebenfalls eingefangen wird, wird in die umgebende Lösung abgegeben. Denken Sie daran, dass diese Reaktion reversibel ist.
Bei der Erklärung von Reaktionen, die im Stoffwechsel ablaufen, wird das in die Lösung freigesetzte H+ üblicherweise ignoriert, und in diesem Text wird das Ergebnis der NAD-Reduktion einfach als NADH und nicht als NADH + H+ dargestellt.
FAD / FADH2
Flavin-Adenin-Dinukleotid wird in seinem oxidierten Zustand als FAD bezeichnet. Nach der Reduktion wird es als FADH2 bezeichnet. Siehe Abbildung 5 für eine molekulare Illustration. Das Vitamin Riboflavin (oder B2) wird zur Herstellung dieser Verbindung verwendet. Riboflavin liefert die Ringstrukturen, die direkt an der Übertragung von zwei Wasserstoffatomen (diesmal mit je einem Elektron) beteiligt sind. Ähnlich wie NAD arbeitet FAD in Verbindung mit einem „Dehydrogenase“-Enzym. Bei der Reaktion werden zwei Wasserstoffatome, jeweils ein Proton und ein Elektron, entfernt. Beide Wasserstoffatome verbinden sich mit FAD. Bei dieser Reaktion wird kein H+ in die Lösung freigesetzt, wie es bei der Reduktion von NAD der Fall ist.
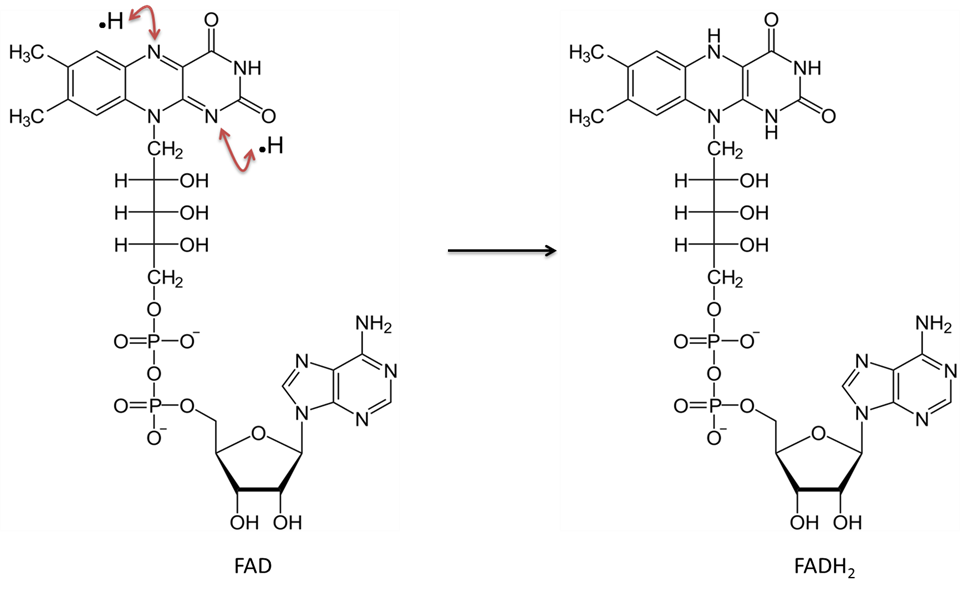
Bild erstellt von JS an der BYU Idaho F2013.
Flavin-Adenin-Dinukleotid in der oxidierten Form (FAD) nimmt zwei Wasserstoffatome (mit je einem Elektron) auf und wird zu FADH2.
Suchen Sie bei der Untersuchung der Stoffwechselreaktionen nach einer Reaktion, bei der FADH2 entsteht. Ähnlich wie NADH ist FADH2 wichtig, da es Wasserstoff und Elektronen an biochemische Prozesse liefert, die die Elektronen und Wasserstoff zur Herstellung von ATP verwenden können.
**Sie können die Schaltflächen unten verwenden, um zur nächsten oder vorherigen Lektüre in diesem Modul zu gelangen**

