Generischer Name: Naftifin Hydrochlorid
Dosierung Form: Gel
Medically reviewed by Drugs.com. Last updated on April 1, 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Schwangerschaft
- Mehr
- Indikationen und Verwendung für Naftin Gel
- Naftin Gel Dosierung und Anwendung
- Dosierungsformen und Stärken
- Kontraindikationen
- Warnungen und Vorsichtsmaßnahmen
- Lokale unerwünschte Wirkungen
- Nebenwirkungen
- Erfahrungen aus klinischen Studien
- Erfahrungen nach dem Inverkehrbringen
- VERWENDUNG IN BESONDEREN POPULATIONEN
- Schwangerschaft
- Stillzeit
- Anwendung bei Kindern
- Geriatrische Anwendung
- Naftin Gel Beschreibung
- Naftin Gel – Klinische Pharmakologie
- Wirkmechanismus
- Pharmakodynamik
- Pharmakokinetik
- Mikrobiologie
- Nichtklinische Toxikologie
- Kanzerogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
- Klinische Studien
- Lieferweise/Lagerung und Handhabung
- Patientenberatung
- Hauptanzeigetafel – 45g Tube Karton
- Hauptanzeigetafel – 60 g Tube Karton
- Mehr über Naftin (Naftifin topisch)
- Ressourcen für den Verbraucher
- Ressourcen für Fachleute
- Andere Formulierungen
- Verwandte Behandlungsrichtlinien
Indikationen und Verwendung für Naftin Gel
NAFTIN ® Gel ist ein Allylamin-Antimykotikum, das zur Behandlung von Tinea pedis interdigitalis, verursacht durch den Organismus Trichophyton rubrum, angezeigt ist, Trichophyton mentagrophytes, und Epidermophyton floccosum.
Naftin Gel Dosierung und Anwendung
Eine dünne Schicht NAFTIN ® Gel einmal täglich auf die betroffenen Stellen plus einen ungefähren ½ Zoll Rand der gesunden umgebenden Haut für 2 Wochen auftragen.
Nur zur äußerlichen Anwendung. NAFTIN ® Gel ist nicht zur ophthalmischen, oralen oder intravaginalen Anwendung bestimmt.
Dosierungsformen und Stärken
Gel, 2%. Jedes Gramm enthält 20 mg Naftifinhydrochlorid in einem farblosen bis gelben Gel.
Kontraindikationen
Keine.
Warnungen und Vorsichtsmaßnahmen
Lokale unerwünschte Wirkungen
Wenn sich bei der Anwendung von NAFTIN ® Gel eine Reizung oder Empfindlichkeit entwickelt, sollte die Behandlung abgebrochen werden.
Nebenwirkungen
Erfahrungen aus klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
In zwei randomisierten, Vehikel-kontrollierten Studien wurden 1143 Probanden mit NAFTIN ® Gel und 571 Probanden mit dem Vehikel behandelt. Die Studienteilnehmer waren 12 bis 92 Jahre alt, überwiegend männlich (76 %) und zu 59 % Kaukasier, zu 38 % Schwarze oder Afroamerikaner und zu 23 % Hispano- oder Latinoamerikaner. Die Probanden erhielten 2 Wochen lang einmal täglich eine topische Dosis, um die betroffenen Hautbereiche plus einen ½-Zoll-Rand der umgebenden gesunden Haut abzudecken. Die häufigsten unerwünschten Wirkungen waren Reaktionen an der Applikationsstelle, die in der Naftin-Gel-Gruppe zu 2 % und in der Vehikel-Gruppe zu 1 % auftraten. Die meisten Nebenwirkungen waren von geringem Schweregrad.
In einer offenen pädiatrischen Pharmakokinetik- und Sicherheitsstudie erhielten 22 pädiatrische Probanden im Alter von 12-17 Jahren mit interdigitaler Tinea pedis NAFTIN ® Gel. Die Inzidenz von Nebenwirkungen in der pädiatrischen Population war ähnlich wie in der erwachsenen Population.
Kumulative Irritationstests zeigten das Potenzial von NAFTIN ® Gel, Irritationen zu verursachen. Es gab keine Hinweise darauf, dass NAFTIN ® Gel eine Kontaktsensibilisierung, Phototoxizität oder Photoallergenität bei gesunder Haut verursacht.
Erfahrungen nach dem Inverkehrbringen
Da diese Reaktionen freiwillig aus einer Population von ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen. Die folgenden unerwünschten Wirkungen wurden bei der Anwendung von Naftifinhydrochlorid nach der Zulassung festgestellt: Blasen, Brennen, Krustenbildung, Trockenheit, Erythem/Rötung, Entzündung, Reizung, Mazeration, Schmerzen, Juckreiz/Juckreiz, Hautausschlag und Schwellung.
VERWENDUNG IN BESONDEREN POPULATIONEN
Schwangerschaft
Risikozusammenfassung
Es liegen keine Daten über die Anwendung von NAFTIN® Gel bei schwangeren Frauen vor, um ein arzneimittelassoziiertes Risiko für schwerwiegende Geburtsfehler, Fehlgeburten oder nachteilige mütterliche oder fötale Ergebnisse zu bewerten.
In tierexperimentellen Reproduktionsstudien wurden bei oralen Dosen, die während der Organogenese bis zum 37-fachen der maximal empfohlenen Humandosis (MRHD) bei trächtigen Ratten verabreicht wurden, oder bei subkutanen Dosen, die während der Organogenese bis zum 4-fachen der MRHD bei trächtigen Ratten oder dem 7-fachen der MRHD bei trächtigen Kaninchen verabreicht wurden, keine nachteiligen Auswirkungen auf die embryofetale Entwicklung beobachtet ( siehe Daten).
Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Aborte oder andere nachteilige Ergebnisse. Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten für die angegebene Population ist nicht bekannt. In der Allgemeinbevölkerung der USA liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2 bis 4 % bzw. 15 bis 20 %.
Daten
Tierdaten
Systemische Studien zur embryofetalen Entwicklung wurden an Ratten und Kaninchen durchgeführt. Für den Vergleich von Tier- und Humandosen wurde die MRHD auf 4 g 2% Gel pro Tag (1,33 mg/kg/Tag für ein 60 kg schweres Individuum) festgelegt.
Orale Dosen von 30, 100 und 300 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Ratten während der Zeit der Organogenese verabreicht. Es wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Toxizität bei Dosen von bis zu 300 mg/kg/Tag (das 37-fache der MRHD auf der Grundlage eines mg/m 2-Vergleichs) festgestellt. Subkutane Dosen von 10 und 30 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Ratten während des Zeitraums der Organogenese verabreicht. Es wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Toxizität bei einer Dosis von 30 mg/kg/Tag (das Vierfache des MRHD auf der Grundlage eines mg/m 2-Vergleichs) festgestellt. Subkutane Dosen von 3, 10 und 30 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Kaninchen während des Zeitraums der Organogenese verabreicht. Es wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Toxizität bei 30 mg/kg/Tag (das 7-fache des MRHD basierend auf einem mg/m 2 Vergleich) festgestellt.
Eine Studie zur peri- und postnatalen Entwicklung wurde an Ratten durchgeführt. Orale Dosen von 30, 100 und 300 mg/kg/Tag Naftifinhydrochlorid wurden weiblichen Ratten vom 14. Trächtigkeitstag bis zum 21. Laktationstag verabreicht. Bei 300 mg/kg/Tag (das 37-fache des MRHD auf der Grundlage eines mg/m 2-Vergleichs) wurde eine verringerte Körpergewichtszunahme der weiblichen Tiere während der Trächtigkeit und der Nachkommen während der Laktation festgestellt. Bei 100 mg/kg/Tag (das 12-fache der MRHD basierend auf einem mg/m 2 -Vergleich) wurde keine Entwicklungstoxizität festgestellt.
Stillzeit
Risikozusammenfassung
Es liegen keine Informationen über das Vorhandensein von Naftifinhydrochlorid in der menschlichen Milch, die Auswirkungen des Arzneimittels auf den gestillten Säugling oder die Auswirkungen des Arzneimittels auf die Milchproduktion nach topischer Anwendung von Naftin Gel bei stillenden Frauen vor. Es ist nicht bekannt, ob Naftifinhydrochlorid in die Muttermilch ausgeschieden wird. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist bei der Verabreichung von Naftifinhydrochlorid an eine stillende Frau Vorsicht geboten.
Das Fehlen klinischer Daten während der Stillzeit schließt eine eindeutige Bestimmung des Risikos von Naftin Gel für einen Säugling während der Stillzeit aus. Daher sollten die entwicklungs- und gesundheitsfördernden Wirkungen des Stillens zusammen mit dem klinischen Bedarf der Mutter an Naftin Gel und möglichen unerwünschten Wirkungen von Naftin Gel oder der mütterlichen Grunderkrankung auf den gestillten Säugling berücksichtigt werden.
Anwendung bei Kindern
Die Sicherheit und Wirksamkeit von NAFTIN® Gel wurde in der Altersgruppe der 12- bis 18-Jährigen mit Tinea pedis interdigitalis nachgewiesen.
Die Anwendung von NAFTIN® Gel in dieser Altersgruppe wird durch Nachweise aus adäquaten und gut kontrollierten Studien bei Erwachsenen sowie durch zusätzliche Sicherheits- und PK-Daten aus einer Open-Label-Studie unterstützt, die an 22 Jugendlichen ≥12 Jahren durchgeführt wurde, die NAFTIN® Gel in einer Dosis von etwa 4 g/Tag erhielten.
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten <12 Jahren wurde nicht nachgewiesen.
Geriatrische Anwendung
Im Rahmen klinischer Studien wurden 99 Probanden (9 %) im Alter von 65 Jahren und älter mit NAFTIN® Gel behandelt. Sicherheit und Wirksamkeit waren ähnlich wie bei jüngeren Probanden.
Naftin Gel Beschreibung
NAFTIN ® Gel ist ein klares bis gelbes Gel zur äußerlichen Anwendung. Jedes Gramm NAFTIN ® Gel enthält 20 mg Naftifinhydrochlorid, eine synthetische Allylamin-Antimykotikum-Verbindung.
Chemisch gesehen ist Naftifin HCl (E)-N-Cinnamyl-N-methyl-1-napthalenemethylamin-Hydrochlorid.
Die Summenformel ist C 21H 21N∙HCl mit einem Molekulargewicht von 323,86.
Die Strukturformel von Naftifinhydrochlorid lautet: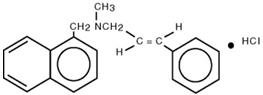
NAFTIN ® Gel enthält die folgenden inaktiven Bestandteile: Alkohol, Benzylalkohol, Edetat-Dinatrium, Hydroxyethylcellulose, gereinigtes Wasser, Propylenglycol, Polysorbat 20 und Trolamin.
Naftin Gel – Klinische Pharmakologie
Wirkmechanismus
NAFTIN ® Gel ist ein topisches Antimykotikum.
Pharmakodynamik
Die Pharmakodynamik von NAFTIN ® Gel ist nicht bekannt.
Pharmakokinetik
In vitro- und in vivo-Bioverfügbarkeitsstudien haben gezeigt, dass Naftifin das Stratum corneum in ausreichender Konzentration durchdringt, um das Wachstum von Dermatophyten zu hemmen.
Die pharmakokinetische Analyse von Plasmaproben von 32 Probanden mit Tinea pedis, die mit einer mittleren Dosis von 3,9 g NAFTIN ® Gel behandelt wurden, das 14 Tage lang einmal täglich auf beide Füße aufgetragen wurde, zeigte eine erhöhte Exposition im Laufe des Behandlungszeitraums mit einem geometrischen Mittelwert (CV%) der AUC 0-24 (Fläche unter der Plasmakonzentrations-gegen-Zeit-Kurve von 0 bis 24 Stunden) von 10,5 (118) ng∙hr/mL an Tag 1 und einer AUC 0-24 von 70 (59) ng∙hr/mL an Tag 14. Das Akkumulationsverhältnis auf der Grundlage der AUC betrug etwa 6.
Die maximale Konzentration (C max) stieg ebenfalls im Laufe des Behandlungszeitraums an; der geometrische Mittelwert (CV%) von C max nach einer Einzeldosis betrug 0,9 (92) ng/ml an Tag 1; C max an Tag 14 betrug 3,7 (64) ng/ml. Die mediane T max betrug 20,0 Stunden (Bereich: 8 bis 20 Stunden) nach einer einmaligen Anwendung an Tag 1 und 8,0 Stunden (Bereich: 0 bis 24 Stunden) an Tag 14. Die Trogplasmakonzentrationen stiegen während des Versuchszeitraums an und erreichten nach 11 Tagen den Steady State. In der gleichen pharmakokinetischen Studie betrug der Anteil der Dosis, der während der Behandlungszeit im Urin ausgeschieden wurde, weniger als oder gleich 0,01 % der verabreichten Dosis.
In einer zweiten Studie wurde die Pharmakokinetik von NAFTIN ® Gel bei 22 pädiatrischen Probanden im Alter von 12-17 Jahren mit Tinea pedis untersucht. Die Probanden wurden mit einer mittleren Dosis von 4,1 Gramm NAFTIN ® Gel behandelt, das 14 Tage lang einmal täglich auf die betroffene Stelle aufgetragen wurde. Die Ergebnisse zeigten, dass die systemische Exposition während des Behandlungszeitraums zunahm. Der geometrische Mittelwert (CV%) der AUC0-24 betrug 15,9 (212) ng∙hr/ml an Tag 1 und 60,0 (131) ng∙hr/ml an Tag 14. Der geometrische Mittelwert (CV%) der Cmax nach einer Einzeldosis betrug 1,40 (154) ng/ml an Tag 1 und 3,81 (154) ng/ml an Tag 14. Der Anteil der Dosis, der während des Behandlungszeitraums im Urin ausgeschieden wurde, war kleiner oder gleich 0,003 % der verabreichten Dosis.
Mikrobiologie
Wirkungsmechanismus
Naftifin ist ein Antimykotikum, das zur Klasse der Allylamine gehört. Obwohl der genaue Wirkmechanismus gegen Pilze nicht bekannt ist, scheint Naftifinhydrochlorid die Sterolbiosynthese durch Hemmung des Enzyms Squalen-2,3-Epoxidase zu beeinträchtigen. Die Hemmung der Enzymaktivität durch dieses Allylamin führt zu verminderten Mengen an Sterolen, insbesondere Ergosterol, und zu einer entsprechenden Anhäufung von Squalen in den Zellen.
Mechanismus der Resistenz
Bis heute wurde kein Mechanismus der Resistenz gegen Naftifin identifiziert.
Naftifin hat sich gegen die meisten Isolate der folgenden Pilze sowohl in vitro als auch bei klinischen Infektionen als wirksam erwiesen, wie im Abschnitt INDIKATIONEN UND ANWENDUNG beschrieben:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Nichtklinische Toxikologie
Kanzerogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
In einer 2-Jahres-Studie zur dermalen Karzinogenität wurde Naftifinhydrochlorid-Creme an Sprague-Dawley-Ratten in topischen Dosen von 1%, 2% und 3% (10, 20 und 30 mg/kg/Tag Naftifinhydrochlorid) verabreicht. In dieser Studie wurden keine arzneimittelbedingten Tumore bis zur höchsten in dieser Studie untersuchten Dosis von 30 mg/kg/Tag (das 36-fache des MRHD auf der Grundlage des AUC-Vergleichs) festgestellt.
Naftifinhydrochlorid ergab keine Hinweise auf ein mutagenes oder klastogenes Potenzial, basierend auf den Ergebnissen von zwei In-vitro-Genotoxizitätstests (Ames-Assay und Chromosomenaberrationstest an Ovarialzellen des chinesischen Hamsters) und einem In-vivo-Genotoxizitätstest (Mikronukleustest am Knochenmark der Maus).
Die orale Verabreichung von Naftifinhydrochlorid an Ratten während der Paarung, Trächtigkeit, Geburt und Laktation zeigte bei Dosen bis zu 100 mg/kg/Tag (das 12-fache des MRHD basierend auf einem mg/m 2-Vergleich) keine Auswirkungen auf Wachstum, Fruchtbarkeit oder Reproduktion.
Klinische Studien
NAFTIN ® Gel wurde auf seine Wirksamkeit in zwei randomisierten, doppelblinden, Vehikel-kontrollierten, multizentrischen Studien untersucht, die 1175 Probanden mit symptomatischer und Dermatophytenkultur-positiver interdigitaler Tinea pedis einschlossen. Die Probanden wurden randomisiert, um NAFTIN ® Gel oder Vehikel zu erhalten. Die Probanden trugen Naftifinhydrochlorid-Gel (2 %) oder Vehikel einmal täglich für 2 Wochen auf die betroffene Stelle des Fußes auf. Die Anzeichen und Symptome der interdigitalen Tinea pedis (Vorhandensein oder Fehlen von Erythem, Juckreiz und Schuppung) wurden bewertet, und 6 Wochen nach der ersten Behandlung wurden eine Kaliumhydroxid (KOH)-Untersuchung und eine Dermatophytenkultur durchgeführt.
Das Durchschnittsalter der Studienpopulation betrug 45 Jahre; 77 % waren männlich; und 60 % waren Kaukasier, 35 % waren Schwarze oder Afroamerikaner, und 26 % waren Hispanoamerikaner oder Latinos. Bei Studienbeginn wurden bei den Probanden Anzeichen und Symptome einer interdigitalen Tinea pedis, eine positive KOH-Untersuchung und eine bestätigte Dermatophytenkultur festgestellt. Der primäre Wirksamkeitsendpunkt war der Anteil der Probanden mit einer vollständigen Heilung 6 Wochen nach Behandlungsbeginn (4 Wochen nach der letzten Behandlung). Vollständige Heilung wurde sowohl als klinische Heilung (Abwesenheit von Erythem, Juckreiz und Schuppung) als auch als mykologische Heilung (negative KOH- und Dermatophytenkultur) definiert.
Die Wirksamkeitsergebnisse in Woche 6, vier Wochen nach Ende der Behandlung, sind in Tabelle 1 unten dargestellt.
| Studie 1 | Studie 2 | |||
|---|---|---|---|---|
| Endpunkt | NAFTIN ® Gel, 2% N=382 n (%) |
Vehikel N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Vehikel N=213 n (%) |
| * Vollständige Heilung ist ein zusammengesetzter Endpunkt von sowohl mykologischer als auch klinischer Heilung. Klinische Heilung ist definiert als das Fehlen von Erythem, Juckreiz und Schuppung (Grad 0). † Eine wirksame Behandlung ist ein negatives KOH-Präparat und eine negative Dermatophytenkultur, Erythem, Schuppung und Juckreiz mit einem Grad von 0 oder 1 (fehlend oder fast fehlend). ‡ Mykologische Heilung ist definiert als negative KOH und Dermatophytenkultur. | ||||
| Vollständige Heilung * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Wirksamkeit der Behandlung † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Mykologische Aushärtung ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Lieferweise/Lagerung und Handhabung
Lieferweise
NAFTIN ® Gel ist ein farbloses bis gelbes Gel, das in zusammenklappbaren Tuben in folgender Größe geliefert wird:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Lagerung
NAFTIN ® Gel bei 25°C (77°F) lagern; Abweichungen von 15-30°C (59-86°F) sind zulässig.
Patientenberatung
- Informieren Sie die Patienten, dass NAFTIN ® Gel nur zur äußerlichen Anwendung bestimmt ist. NAFTIN ® Gel ist nicht für die ophthalmische, orale oder intravaginale Anwendung bestimmt.
- Die Patienten sollten angewiesen werden, ihren Arzt zu kontaktieren, wenn bei der Anwendung von NAFTIN ® Gel eine Reizung auftritt.
Vertrieben von Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Alle Rechte vorbehalten.
Hauptanzeigetafel – 45g Tube Karton

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Nur zur äußerlichen Anwendung
Nicht zur ophthalmischen, Orale oder intravaginale Anwendung
45g
Nur Rx
Hauptanzeigetafel – 60 g Tube Karton

NDC 54766-772-60
NAFTIN®
(Naftifinhydrochlorid) Gel, 2%
Sebela Pharmaceuticals Inc.
Nur zur äußerlichen Anwendung
Nicht zur ophthalmischen, Orale oder intravaginale Anwendung
60g
Nur Rx
| NAFTIN Naftifinhydrochlorid-Gel |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
Etikettierer – Sebela Pharmaceuticals Inc. (079104574)
| Einrichtung | |||
| Name | Adresse | ID/FEI | Betrieb |
| DPT Laboratories, Ltd. | 832224526 | Herstellung(54766-772), Analyse(54766-772), Kennzeichnung(54766-772) | |
Mehr über Naftin (Naftifin topisch)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierung Informationen
- Preisangaben& Gutscheine
- En Español
- 3 Bewertungen
- Generische Verfügbarkeit
- Medikamentenklasse: Topische Antimykotika
Ressourcen für den Verbraucher
- Patienteninformationen
- Naftin Topical (Advanced Reading)
Ressourcen für Fachleute
- Verschreibungsinformationen
- Naftin (AHFS-Monographie)
Andere Formulierungen
- Naftin-MP Topical
Verwandte Behandlungsrichtlinien
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medizinischer Haftungsausschluss