Im zellvermittelten Teil der adaptiven Immunantwort werden kurze Peptide durch Moleküle des Haupthistokompatibilitätskomplexes (MHC) der Klasse I und der Klasse II gebunden und an der Zelloberfläche präsentiert, wo sie von den Antigenrezeptoren der T-Lymphozyten erkannt werden. Die Bindung eines T-Zell-Rezeptors (TCR), der einen bestimmten MHC-Peptidkomplex erkennt, veranlasst naive Lymphozyten zur Differenzierung in Effektorzellen (zytotoxische und Helfer-T-Zellen), die infizierte Wirtszellen zerstören oder die Antikörperproduktion anregen, und in Gedächtniszellen, die eine schützende Immunität gegen Reinfektionen bieten.
Struktur und Funktion der MHC-Moleküle
Zwei in der MHC-Genomregion angesiedelte Multigenfamilien kodieren für antigenbindende Moleküle, die fremde Peptide an der Zelloberfläche präsentieren. Tatsächlich präsentieren MHC-Moleküle auch selbst hergestellte Peptide. Die negative thymische Selektion gegen autoreaktive T-Zellen verhindert jedoch, dass MHC-Selbst-Peptid-Komplexe eine Immunantwort auslösen. MHC-Klasse-I-Moleküle werden auf den meisten kernhaltigen Zellen exprimiert und enthalten in der Regel endogene Peptide, die von intrazellulären Pathogenen stammen, die sich im Zytosol replizieren (z. B. Viren). Zytosolische Proteine werden durch das Proteasom in kurze Peptidfragmente abgebaut und zunächst durch die ATP-abhängigen Transporter TAP1 & 2 in das endoplasmatische Retikulum (ER) transportiert, um dort MHCI zu laden, und dann an die Zelloberfläche zu gelangen, wo sie zirkulierenden zytotoxischen CD8+ T-Zellen präsentiert werden, deren Aufgabe es ist, die Apoptose und Lyse der infizierten Zielzelle einzuleiten. (Die Abbildungen stammen aus Murphy et al. (2008) Abb. 3.12, 3.25, 5.5, & 5.11.)
Die konstitutive Expression von MHC-Klasse-II-Loci ist auf Antigen-präsentierende Zellen des Immunsystems (APCs, z. B. Makrophagen, dendritische Zellen und B-Lymphozyten) beschränkt. MHCII-Moleküle werden durch die Assoziation mit der invarianten Klasse-II-Kette (Ii oder CD74) stabilisiert und daran gehindert, Antigene zu binden, während sie sich im ER befinden, und werden dann vom standardmäßigen sekretorischen Weg in den endozytischen Weg umgelenkt. Dort treffen sie auf Peptide, die von Krankheitserregern stammen, die sich in intrazellulären Vesikeln replizieren, oder von extrazellulären Krankheitserregern und Proteinen, die in die Zelle transportiert werden. Die stabile Peptidbindung wird durch das nichtklassische MHCII-Dimer DMα/β katalysiert und ermöglicht es den MHCII-Peptidkomplexen, den endozytischen Weg zu verlassen, um an der Zelloberfläche präsentiert zu werden. Die Erkennung durch CD4+ T-Zellen aktiviert die Zielwirtszelle, um antibakterielle Mechanismen (in Makrophagen) zu stimulieren oder die Antikörperproduktion und die humorale Immunantwort auszulösen.
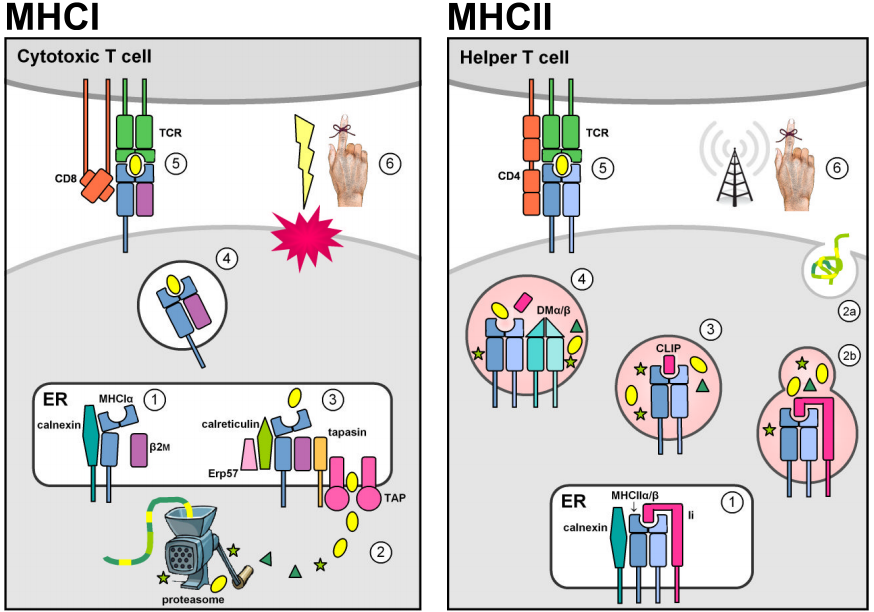
Strukturelle Ähnlichkeiten von MHCI- und MHCII-Molekülen spiegeln wahrscheinlich ihre Abstammung von einem gemeinsamen Vorfahren wider. Reife MHC-Moleküle sind integrale Typ-I-Membranglykoproteine, die aus einer Peptidbindungsfurche und immunglobulinartigen, transmembranen und zytoplasmatischen Domänen bestehen. Die extrazellulären Teile der MHC-Moleküle bestehen aus zwei membrandistalen Domänen, die zusammen einen Peptidbindungshohlraum bilden, der von zwei unterbrochenen α-Helices begrenzt wird, die auf einer antiparallelen β-Folie ruhen, sowie aus zwei membranständigen immunglobulinähnlichen (Ig-ähnlichen) Domänen, die an der Bindung von CD4- und CD8-Corezeptoren beteiligt sind.
Trotz dieser strukturellen Ähnlichkeiten werden die Proteinuntereinheiten für Moleküle der Klasse I und II unterschiedlich kodiert. MHCI-Moleküle sind Heterodimere, die durch nicht-kovalente Assoziation zwischen einer schweren MHCIα-Kette und β2-Mikroglobulin (β2m) gebildet werden, das von einem weitgehend unveränderlichen Locus kodiert wird, der außerhalb der MHC-Genomregion liegt. Die schwere Kette steuert sowohl die Peptidbindungsspalte als auch eine der Ig-ähnlichen Domänen bei, während β2m nur eine zweite Ig-ähnliche Region liefert, der ein Transmembrananker fehlt. MHC-Klasse-II-Moleküle sind Heterodimere, die durch die nicht-kovalente Assoziation einer α- und einer β-Kette gebildet werden, die beide einzelne peptidbindende und membranverankerte Ig-ähnliche Domänen beisteuern und die jeweils von einem bestimmten Locus transkribiert werden, der typischerweise in der MHC-Region zu finden ist.
Die Mitglieder der MHC-Genfamilie können weiter in klassische und nicht-klassische Loci sowie in nicht-funktionelle Pseudogene unterteilt werden. Klassische MHC-Ia-Loci werden häufig exprimiert und sind typischerweise mit einer hohen Sequenzvariabilität und einer positiven Selektion verbunden, die auf Substitutionen an Resten der Peptidbindungsregion (PBR) wirkt. Nicht-klassische MHC-Ib-Loci haben dagegen eine geringere Expression oder eine begrenzte Gewebeverteilung, einen geringeren Polymorphismus und können eingeschränkte oder veränderte Funktionen haben. Bei Klasse-II-Genen bezieht sich der Begriff „klassisch“ in der Regel auf alle Antigen-präsentierenden Loci, während der Begriff „nicht-klassisch“ für Gene wie DMα/β reserviert ist, die akzessorische Funktionen im Antigen-Präsentationsweg erfüllen. Obwohl diese funktionelle Kategorisierung der Mitglieder der Genfamilie ein nützliches Arbeitsvokabular bietet, ist die Grenze zwischen klassischen und nichtklassischen Loci in der Praxis nicht immer klar, und einige nichtklassische MHCI-Loci sind polymorph, weit verbreitet oder binden peptidische Liganden in der traditionellen Art und Weise klassischer Gene.
Extremer Polymorphismus auf Populationsebene und Hinweise auf eine ausgleichende Selektion deuten darauf hin, dass eine erhebliche allelische Variation der MHC-Gene wahrscheinlich erforderlich ist, um eine Vielzahl von Krankheitserregern zu erkennen und auf sie zu reagieren. Trotz umfangreicher Genduplikation in einigen Arten exprimieren die Individuen jedoch in der Regel nur eine mäßige Anzahl klassischer MHC-Loci, und auch bei einigen polyploiden Xenopus-Arten wird eine Rückkehr zur disomischen Vererbung beobachtet. Man geht davon aus, dass die Beschränkung der intraindividuellen MHC-Variation (zumindest bei hoch exprimierten klassischen Loci) auf einen funktionellen Kompromiss zwischen der Vergrößerung des Allelrepertoires zur Präsentation einer größeren Vielfalt pathogener Peptide und der damit einhergehenden Verringerung des T-Zell-Repertoires zurückzuführen ist, das zur Aufrechterhaltung der Selbsttoleranz erforderlich wäre. Einzelne MHC-Moleküle müssen daher zu einer permissiven Peptidbindung fähig sein, um ein breites Spektrum fremder Antigene adäquat zu erkennen. Es müssen jedoch auch stabile MHC-Peptid-Komplexe erzeugt werden, die lange genug bestehen, um die Erkennung durch T-Zellen zu ermöglichen, und die keine Peptide an der Zelloberfläche austauschen, was zur Zerstörung nicht infizierter Zellen führen könnte. Eine solche Stabilität ist im Allgemeinen mit einer hohen Affinität und daher mit restriktiven intermolekularen Wechselwirkungen verbunden.
MHC-Moleküle bringen diese konkurrierenden Bindungsanforderungen durch eine elegante strukturelle Lösung in Einklang: Kontakte zwischen hochkonservierten Resten der Peptidbindungsregion (PBR) des MHC-Moleküls und Peptid-Hauptkettenatomen stabilisieren die vielseitige Bindung der meisten peptidischen Liganden, während polymorphe Reste, die die Peptidbindungsfurche auskleiden, unregelmäßige Taschen mit unterschiedlicher Stereochemie bilden, die Peptidreste in sequenzabhängiger Weise aufnehmen. Die durch Seitenketten-Bindungstaschen auferlegten Beschränkungen variieren sowohl zwischen den Allelen als auch zwischen den Taschen innerhalb eines einzelnen MHC-Moleküls. Taschen, die strengere Bindungsanforderungen stellen, werden als „primäre Anker“ bezeichnet, während „sekundäre Anker“ in ihren Bindungspräferenzen flexibler sind. Zusammen bestimmen diese Besonderheiten das Peptidbindungsmotiv eines bestimmten MHC-Allels, das bei der Antigenpräsentation Selektivität verleiht.