Lokalisiert vs. delokalisiert
Die Unterscheidung zwischen „lokalisiert“ und „delokalisiert“ gibt es nur, wenn man die Bewegung der Elektronen mit Hilfe der Lewis’schen Bindungstheorie beschreibt.
Nach dieser Theorie verhalten sich lokalisierte Elektronen normal. Ein lokalisiertes einsames Paar bleibt in der Nähe eines Atoms. Ein lokalisiertes Bindungspaar bewegt sich zwischen zwei Atomen.
Resonanzhybride enthalten notwendigerweise einige „abnormale“ Elektronen. Ein einsames Elektronenpaar kann den Anschein erwecken, Bindungseigenschaften zu haben; statt in der Nähe eines Atoms zu bleiben, besucht es zwei Atome. Ein Bindungspaar kann sich scheinbar zwischen zwei verschiedenen Atompaaren bewegen. Diese Elektronen überschreiten die Grenzen, die die Lewis-Theorie für sie festgelegt hat, und wir betrachten sie als delokalisiert.
Die einfachste Möglichkeit, delokalisierte Elektronen zu erkennen, ist der Vergleich der Elektronenpositionen in zwei Resonanzformen. Wenn ein Paar in einer Form an einer Stelle erscheint und in einer anderen Form an einer anderen Stelle, ist das Paar delokalisiert.
Das delokalisierte Verhalten kann man in den untenstehenden Resonanzformen I und II sehen. Beide Formen enthalten zwei delokalisierte Elektronenpaare. Kannst du sie finden? Welche Art von Elektronenpaaren sind in jeder Struktur delokalisiert?
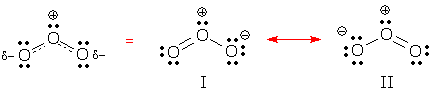
(Antwort: Diese Formen enthalten ein delokalisiertes Bindungspaar und ein delokalisiertes einsames Paar.)
Delokalisierte Bindungen und delokalisierte Ladungen
Die Bezeichnung „delokalisiert“ gilt auch für Bindungen und Ladungen.
Eine delokalisierte Bindung ist eine Bindung, die in einigen Resonanzformen auftritt, in anderen aber nicht. Die Resonanzform I enthält 2 lokalisierte Bindungen und 1 delokalisierte Bindung.
Eine delokalisierte Ladung ist eine formale Ladung, die in einigen Resonanzformen an einem Atom auftritt und in anderen Formen an anderen Atomen. Die negative Ladung von Ozon ist über die beiden End-O delokalisiert, während die positive Ladung auf dem mittleren O lokalisiert ist.