Estabilidad de los intermedios de los carbocationes
Sabemos que el paso que limita la velocidad de una reacción SN1 es el primer paso: la formación de este intermedio de carbocación. La velocidad de este paso -y, por tanto, la velocidad de la reacción de sustitución global- depende de la energía de activación del proceso en el que se rompe el enlace entre el carbono y el grupo saliente y se forma un carbocatión. Según el postulado de Hammond (sección 6.2B), cuanto más estable sea el carbocatión intermedio, más rápido ocurrirá este primer paso de ruptura del enlace. En otras palabras, la probabilidad de que una reacción de sustitución nucleófila proceda por un mecanismo disociativo (SN1) depende en gran medida de la estabilidad del intermedio de carbocación que se forma.
La pregunta crítica ahora se convierte en, ¿qué estabiliza un carbocation?
Así que si se necesita un grupo que retire electrones para estabilizar una carga negativa, ¿qué estabilizará una carga positiva? ¡Un grupo donador de electrones!
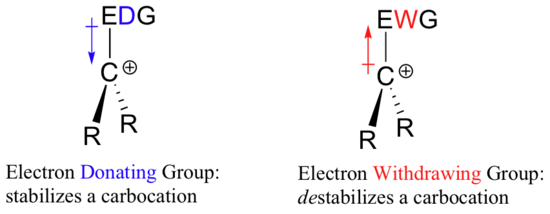
Una especie cargada positivamente como un carbocation es muy pobre en electrones, y por lo tanto cualquier cosa que dona la densidad de electrones al centro de la pobreza de electrones ayudará a estabilizarlo. A la inversa, un carbocation será desestabilizado por un grupo que retira electrones.
Los grupos alquilo – metilo, etilo, y similares – son grupos débiles que donan electrones, y por lo tanto estabilizan los carbocations cercanos. Esto significa que, en general, los carbocationes más sustituidos son más estables: un carbocationes tert-butílico, por ejemplo, es más estable que un carbocationes isopropílico. Los carbocationes primarios son altamente inestables y no se observan a menudo como intermedios de reacción; los carbocationes de metilo son incluso menos estables.
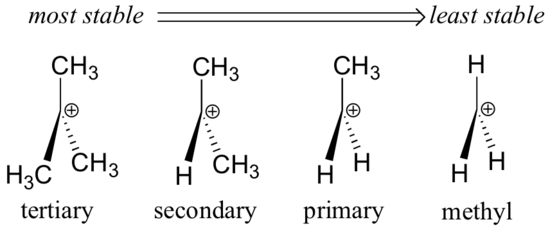
Los grupos alquilo son donadores de electrones y estabilizadores de carbocationes porque los electrones alrededor de los carbonos vecinos son atraídos hacia la carga positiva cercana, reduciendo así ligeramente la pobreza de electrones del carbono cargado positivamente.
No es exacto decir, sin embargo, que los carbocationes con mayor sustitución son siempre más estables que aquellos con menor sustitución. Al igual que los grupos donadores de electrones pueden estabilizar un carbocation, los grupos que retiran electrones actúan para desestabilizar los carbocations. Los grupos carbonilos retiran electrones por efectos inductivos, debido a la polaridad del doble enlace C=O. Es posible demostrar en el laboratorio (véase la sección 16.1D) que el carbocation A abajo es más estable que el carbocation B, aunque A es un carbocation primario y B es secundario.
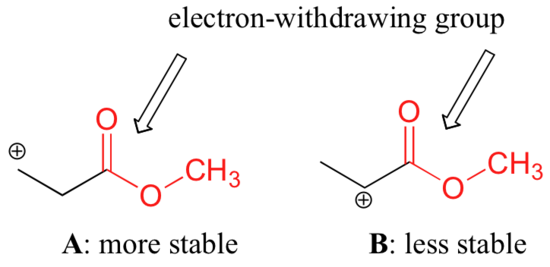
La diferencia de estabilidad puede explicarse considerando el efecto inductivo de extracción de electrones del carbonilo del éster. Recordemos que los efectos inductivos -ya sean de retirada o donación de electrones- se transmiten a través de enlaces covalentes y que la fuerza del efecto disminuye rápidamente a medida que aumenta el número de enlaces intermedios. En otras palabras, el efecto disminuye con la distancia. En la especie B la carga positiva está más cerca del grupo carbonilo, por lo que el efecto desestabilizador de la retirada de electrones es más fuerte que en la especie A.
En el próximo capítulo veremos cómo el efecto desestabilizador del carbocatión de los sustituyentes fluorados que retiran electrones puede utilizarse en experimentos diseñados para abordar la cuestión de si una reacción de sustitución nucleófila bioquímica es SN1 o SN2.
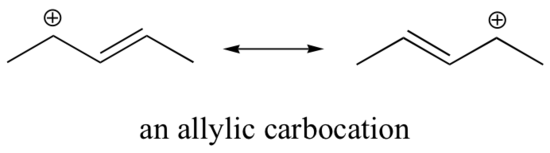
La estabilización de un carbocatión también puede ocurrir a través de efectos de resonancia, y como ya hemos discutido en el capítulo de ácido-base, los efectos de resonancia como regla son más poderosos que los efectos inductivos. Consideremos el caso simple de un carbocatión bencílico:
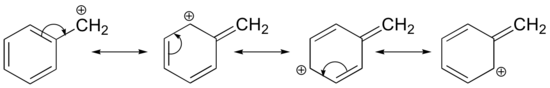
Este carbocatión es comparativamente estable. En este caso, la donación de electrones es un efecto de resonancia. Se pueden dibujar tres estructuras de resonancia adicionales para este carbocatión en el que la carga positiva se encuentra en uno de los tres carbonos aromáticos. La carga positiva no está aislada en el carbono bencílico, sino que está deslocalizada alrededor de la estructura aromática: esta deslocalización de la carga resulta en una estabilización significativa. Como resultado, los carbocationes benzílicos y alílicos (donde el carbono cargado positivamente se conjuga con uno o más dobles enlaces no aromáticos) son significativamente más estables que incluso los carbocationes alquílicos terciarios.
Debido a que los heteroátomos como el oxígeno y el nitrógeno son más electronegativos que el carbono, se podría esperar que por definición fueran grupos retiradores de electrones que desestabilizaran los carbocationes. De hecho, a menudo ocurre lo contrario: si el átomo de oxígeno o nitrógeno está en la posición correcta, el efecto general es la estabilización del carbocation. Esto se debe al hecho de que aunque estos heteroátomos son grupos retiradores de electrones por inducción, son grupos donadores de electrones por resonancia, y es este efecto de resonancia el que es más poderoso. (Esta misma idea la encontramos anteriormente al considerar la acidez y basicidad relativas de los fenoles y las aminas aromáticas en la sección 7.4). Consideremos los dos pares de especies de carbocationes siguientes:
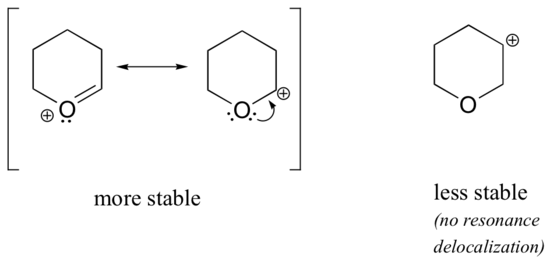
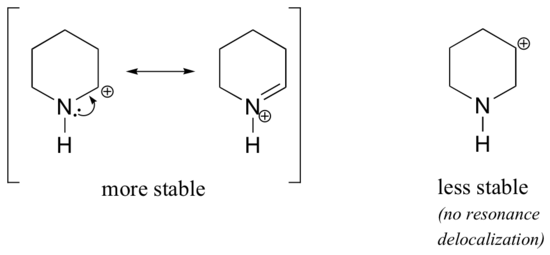
En los carbocationes más estables, el heteroátomo actúa como un grupo donador de electrones por resonancia: en efecto, el par solitario del heteroátomo está disponible para deslocalizar la carga positiva. En los carbocationes menos estables, el carbono con carga positiva está a más de un enlace del heteroátomo, por lo que no es posible ningún efecto de resonancia. De hecho, en estas especies de carbocationes los heteroátomos realmente desestabilizan la carga positiva, porque son retiradores de electrones por inducción.
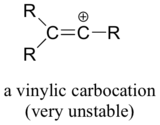
Por último, los carbocationes vinílicos, en los que la carga positiva reside en un carbono de doble enlace, son muy inestables y, por tanto, es poco probable que se formen como intermedios en cualquier reacción.
Ejemplo 7.9.1
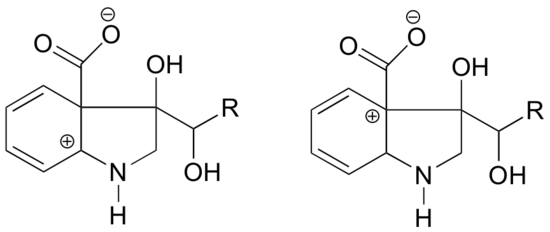
¿En cuál de las estructuras siguientes se espera que el carbocation sea más estable? Explique.
Respuesta
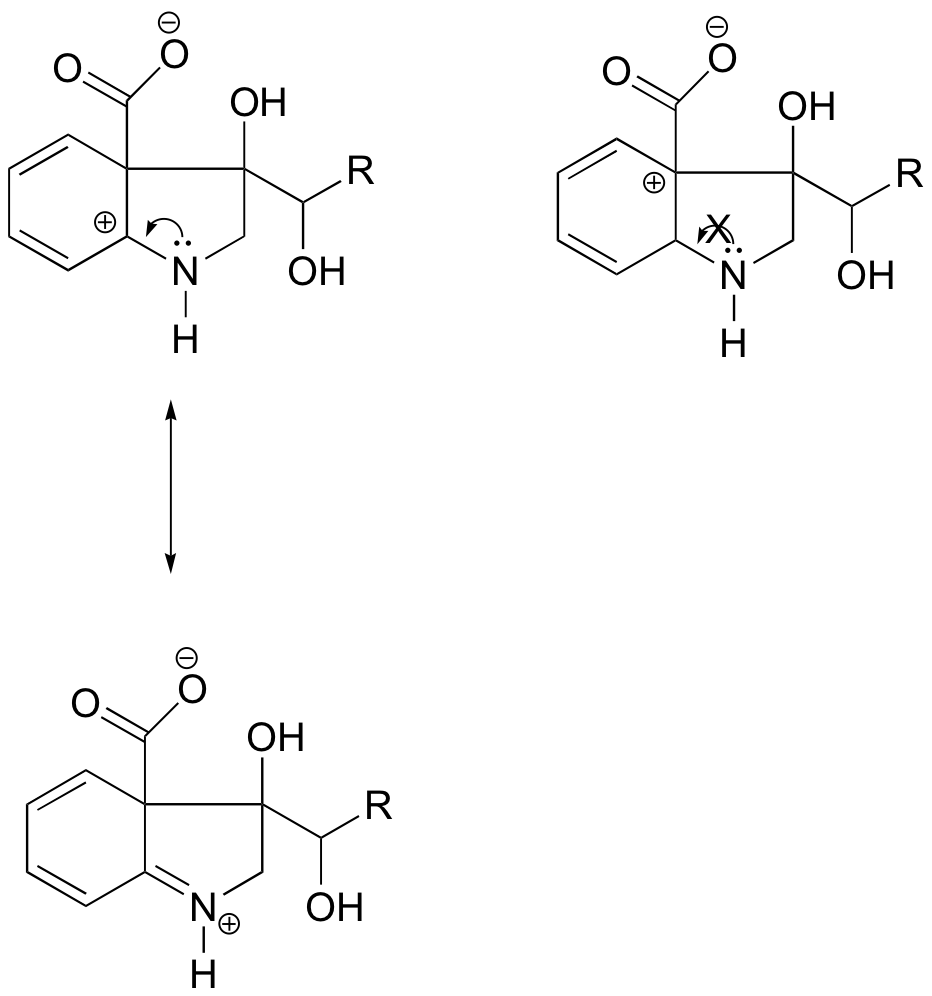
En el carbocation de la izquierda, la carga positiva se encuentra en una posición relativa al nitrógeno tal que el par solitario de electrones en el nitrógeno puede ser donado para llenar el orbital vacío. Esto no es posible para la especie de carbocación de la derecha.
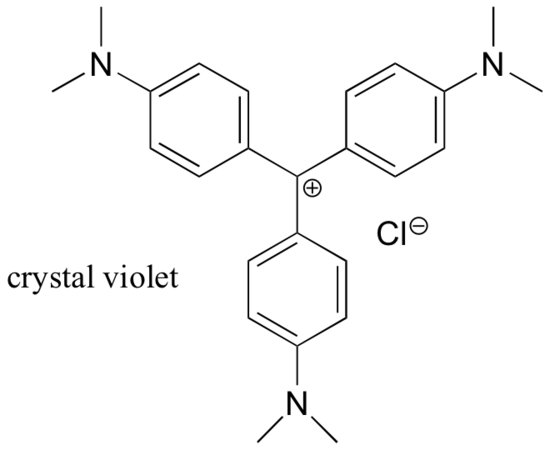
Por la mayor parte, las carbocaciones son especies intermedias transitorias de muy alta energía en las reacciones orgánicas. Sin embargo, hay algunos ejemplos inusuales de carbocationes muy estables que toman la forma de sales orgánicas. Violeta de cristal es el nombre común de la sal de cloruro del carbocation cuya estructura se muestra a continuación. Observe las posibilidades estructurales de una amplia deslocalización de resonancia de la carga positiva, y la presencia de tres grupos amina donadores de electrones.
Ejemplo 7.9.2
Dibuje una estructura de resonancia del catión violeta de cristal en la que la carga positiva está deslocalizada a uno de los átomos de nitrógeno.
Respuesta 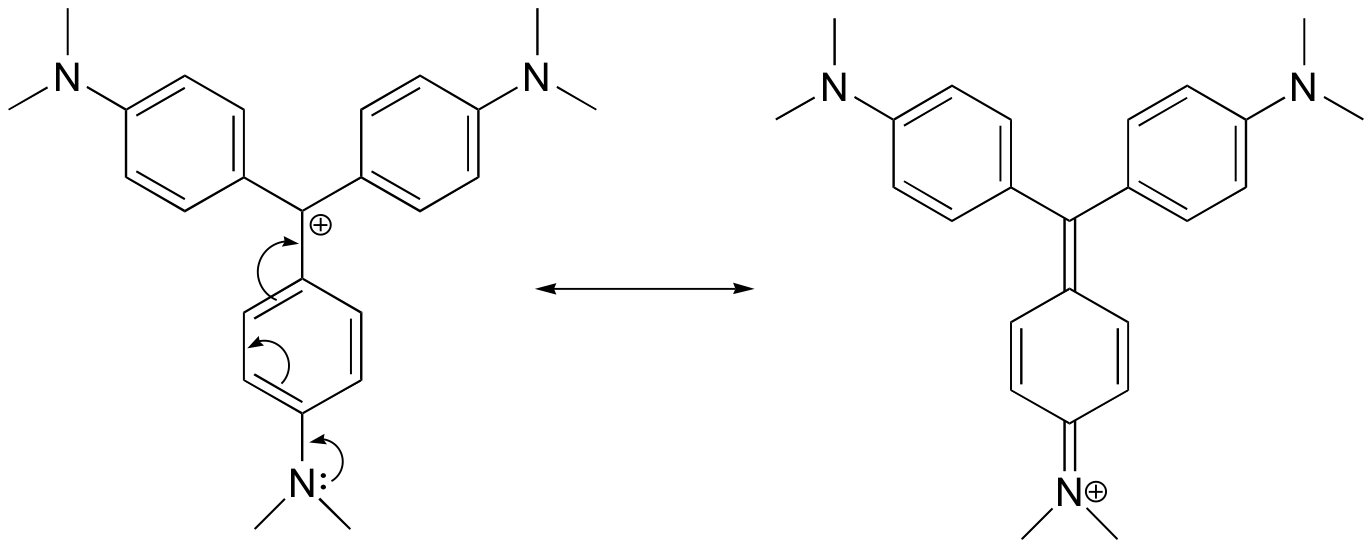
Cuando se considera la posibilidad de que una reacción de sustitución nucleofílica proceda a través de una vía SN1, es fundamental evaluar la estabilidad del hipotético intermedio carbocatión. Si este intermedio no es suficientemente estable, un mecanismo SN1 debe considerarse improbable, y la reacción probablemente procede por un mecanismo SN2. En el próximo capítulo veremos varios ejemplos de reacciones SN1 biológicamente importantes en las que el intermedio cargado positivamente está estabilizado por efectos inductivos y de resonancia inherentes a su propia estructura molecular.
Ejemplo 7.9.3
Indique qué carbocationes de cada par siguiente son más estables, o si se espera que sean aproximadamente iguales. Explique su razonamiento.
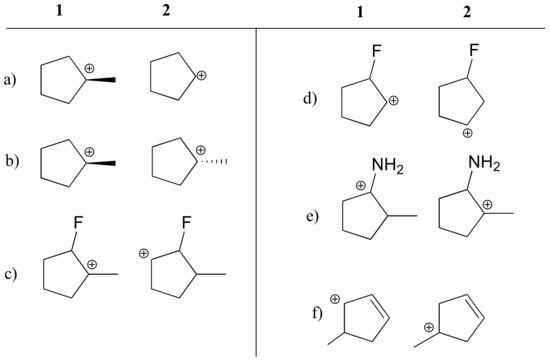
Responda
a) 1 (carbocación terciaria vs. secundaria)
b) igual
c) 1 (carbocación terciaria vs. carbocación secundaria)
d) 2 (la carga positiva está más lejos del flúor que retira electrones)
e) 1 (el par solitario del nitrógeno puede donar electrones por resonancia)
f) 1 (carbocación alílica – la carga positiva puede deslocalizarse a un segundo carbono)