Ión azida: Estructura, Propiedades y Reacciones de Sustitución
El ion azida (N3- ) es una de esas entidades químicas que simplemente tiene un aspecto extraño.

- ¿Tres nitrógenos seguidos? comprobar
- Dos cargas negativas y una positiva, para una carga neta de -1? comprobar
- ¿Estable? comprobar (siempre que se trate con cuidado).
Resulta que el ion azida puede ser extremadamente útil para formar enlaces C-N en reacciones de sustitución nucleofílica.
Tabla de contenidos
- El ion azida es un gran nucleófilo
- Azidas orgánicas como aminas «enmascaradas»
- Explotando en la plataforma de lanzamiento
- Sustitución nucleófila de acil con sales de azida: Azidas de acilo
- Reordenamiento de azidas de acilo: El reordenamiento de Curtius
- Más ejemplos de nucleófilos de azida: Apertura de epóxidos y adición conjugada
- Notas
- (Avanzado) Referencias y lecturas adicionales
- 1. El ion azida es un gran nucleófilo en las reacciones SN2
- Explotando en la plataforma de lanzamiento
- 4. La sustitución nucleofílica de acilo con sales de azida hace azidas de acilo
- 5. Reorganización de azidas de acilo Reordenamiento de las acil azidas: El reordenamiento de Curtius
- Más ejemplos de nucleófilos de azida: Apertura de epóxidos y adición conjugada
- Notas
- (Avanzado) Referencias y lecturas adicionales
1. El ion azida es un gran nucleófilo en las reacciones SN2
El ion azida es la base conjugada del ácido hidrazoico, HN3. A pesar de ser sólo débilmente básico (el pKa del HN3 es sólo 4,6) el N3 es un nucleófilo extremadamente bueno – según una medida, más nucleófilo que cualquier amina (ver post: Nucleofilia de las aminas). No es difícil entender el porqué de esto cuando te paras a pensar en ello. Con cuatro pares solitarios nucleófilos confinados en un volumen muy pequeño, la probabilidad de una colisión con un electrófilo que resulte en una reacción es mucho mayor de lo que sería para una amina con grupos alquilos voluminosos, por poner un ejemplo.
Se puede pensar en el N3- como un misil con punta de nitrógeno magro, que entrega su carga útil en el carbono de forma rápida, eficiente y sin reacciones secundarias significativas.
En las reacciones SN2, los haluros de alquilo primarios y secundarios y los sulfonatos son fácilmente desplazados por el N3- , dando lugar a azidas de alquilo:
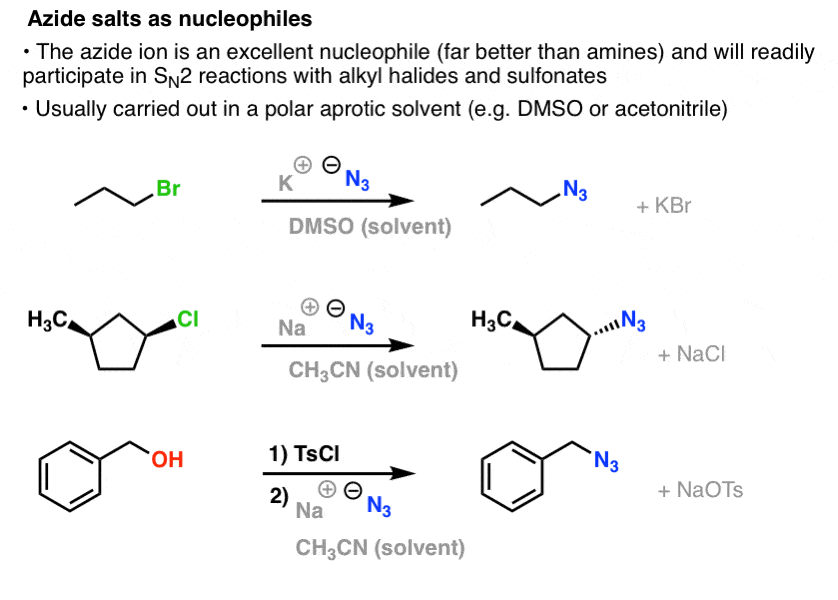
El procedimiento habitual es utilizar una sal de azida como NaN3 o KN3 con el haluro de alquilo apropiado en un disolvente aprótico polar como el acetonitrilo (CH3CN) o el dimetilsulfóxido (DMSO).
Los productos orgánicos de azida son razonablemente estables, aunque tengan un aspecto un poco extraño. Algunos incluso han encontrado uso como productos farmacéuticos (por ejemplo, AZT, abajo a la derecha) o como sondas útiles para estudiar la biología química.
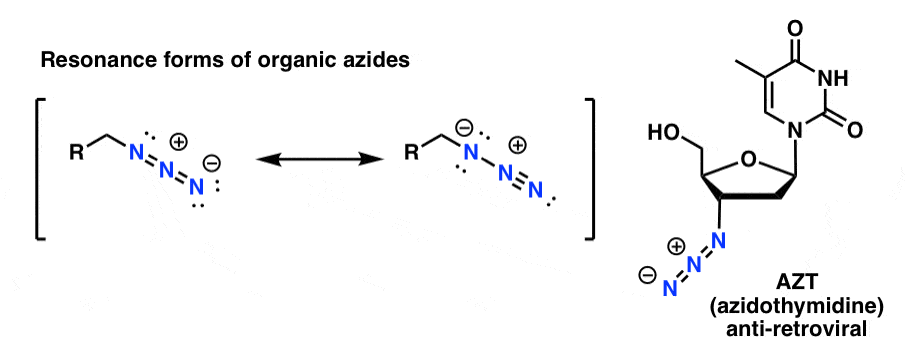
Para nuestros propósitos, la propiedad más útil de las azidas orgánicas es que sirven como aminas «enmascaradas». Azidas orgánicas como «aminas enmascaradas»
Nótese la forma de resonancia anterior con un triple enlace nitrógeno-nitrógeno. Si se tratan con un agente reductor, como LiAlH4 o incluso con hidrogenación catalítica (Pd/C , H2) las azidas orgánicas pueden reducirse a aminas primarias, liberando N2 en el proceso.
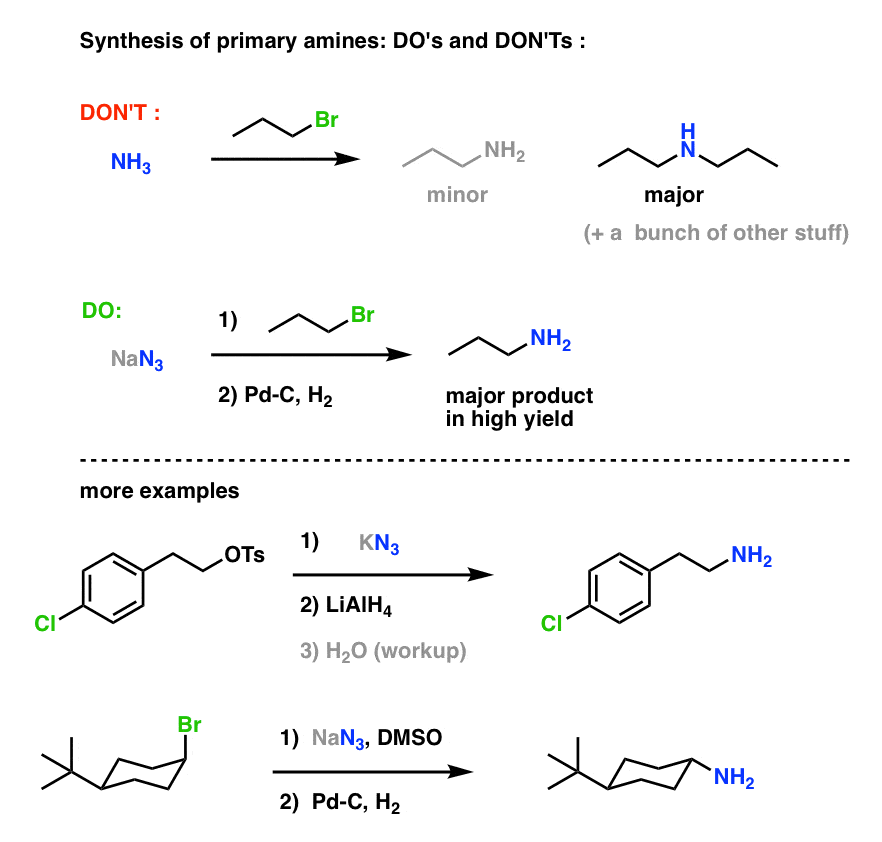
¡Esto constituye una ruta muy útil para obtener aminas primarias a partir de haluros de alquilo!
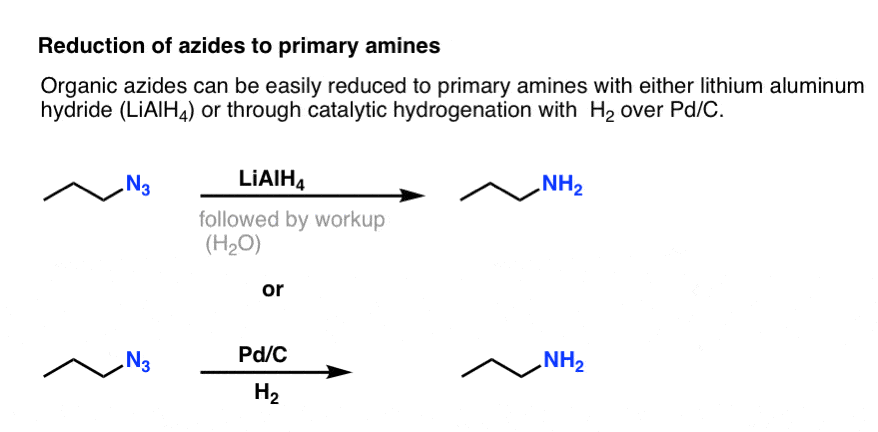
Hemos explorado previamente la síntesis de Gabriel como una ruta a las aminas primarias , pero esta ruta es superior porque la azida puede reducirse a la amina en condiciones suaves (por ejemplo, hidrogenación). Nada de esa escisión a alta temperatura de la ftalimida con hidracina de la que preocuparse.
También vimos que hacer aminas primarias mediante el tratamiento directo de haluros de alquilo con NH3 a menudo no da lugar al producto deseado, porque las aminas tienen una tendencia similar a la de Cookie-Monster a reaccionar múltiples veces con los haluros de alquilo: dado que los productos de las aminas tienden a ser más nucleófilos que los reactivos, es difícil conseguir que las aminas se detengan en masticar sólo un haluro de alquilo.
Explotando en la plataforma de lanzamiento
Si el N3 es un «misil con punta de nitrógeno», como comentamos anteriormente, conviene recordar lo que ocurre cuando un misil no se maneja con cuidado: es esencialmente una bomba.
El NaN3 y el KN3 son polvos blancos que pueden almacenarse indefinidamente a temperatura ambiente y extraerse en el banco sin ningún problema.
Pero cuando se calientan o se someten a golpes… todo se acaba. Lo mismo ocurre con la exposición de estas sales de azida al ácido, que forma HN3 potencialmente explosivo.
¡Y el NaN3 y el KN3 son las azidas bonitas! Si se mezclan con sales metálicas de plomo, mercurio, cadmio, zinc o plata, pueden resultar compuestos de azida aún más explosivos. Estas azidas metálicas son explosivos de contacto, algunos de los cuales son tan sensibles que detonarán si alguien se tira un pedo a seis metros de distancia. Algunos químicos locos incluso hacen estas cosas a propósito, pero no vamos a viajar en cualquier lugar cerca del radio de explosión de ese tema en este blog en cualquier momento, nunca.
NaN3 y KN3 deben ser utilizados en concentraciones razonablemente diluidas, detrás de un escudo de explosión en escala preparativa, y por cierto nunca se utiliza con el disolvente CH2Cl2, que puede resultar en diazidometano altamente explosivo.
Ahora, hay momentos en que una repentina explosión de gas nitrógeno es útil – y potencialmente salva vidas. Es posible que ya haya pasado una parte de su día cerca de la azida sódica sin siquiera darse cuenta. Esto se debe a que el NaN3 es uno de los varios propulsores que se utilizan en los airbags; una vez activado por un acelerómetro, la detonación del NaN3 expulsa gas N2 a más de 200 mph, inflando la bolsa en 1/25 de segundo.
¡Salud a las sales de azida!
vía GIPHY
(Pero no seas este tipo):
vía GIPHY
Finalmente: Las reacciones SN2 entre haluros de alquilo o sulfonatos con azidas son probablemente la mejor manera de sintetizar aminas primarias a partir de haluros de alquilo. Ciertamente supera la síntesis de Gabriel.
4. La sustitución nucleofílica de acilo con sales de azida hace azidas de acilo
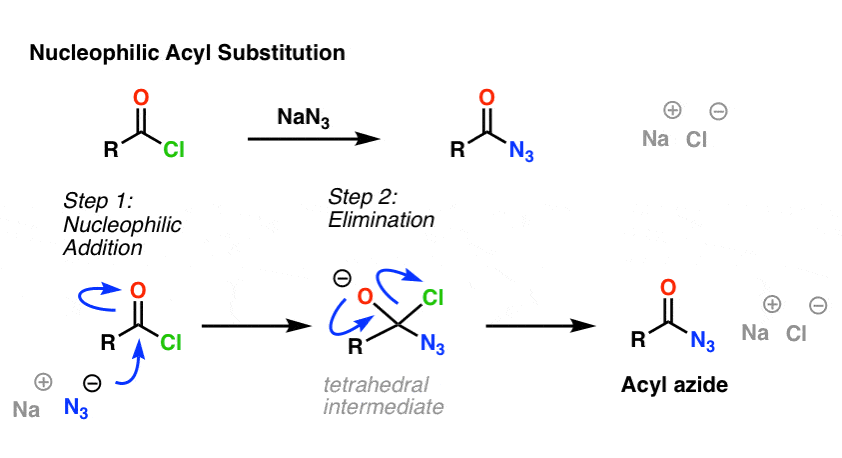
La reacción SN2 no es el único tipo de reacción de sustitución que hemos explorado. También existe la sustitución nucleofílica de acil. Un carbonilo unido a un buen grupo saliente (como un cloruro de ácido o un anhídrido) sufrirá una sustitución cuando se añada un nucleófilo apropiado.
En el primer paso del mecanismo, el nucleófilo (Nu) ataca al carbono del carbonilo, formando C-Nu y rompiendo C-O (pi). Esto da lugar a un intermedio tetraédrico. En el segundo paso, se vuelve a formar el enlace C-O pi, y se rompe el enlace carbono-(grupo saliente), dando lugar al producto de sustitución acílica nucleófila.
Aquí se muestra un ejemplo de reacción de sustitución acílica nucleófila entre un cloruro de ácido y el ion N3 para dar una azida de acilo:
5. Reorganización de azidas de acilo Reordenamiento de las acil azidas: El reordenamiento de Curtius
El uso más común de las acil azidas es que al calentarse se reordenan para dar isocianatos en una reacción conocida como el reordenamiento de Curtius.
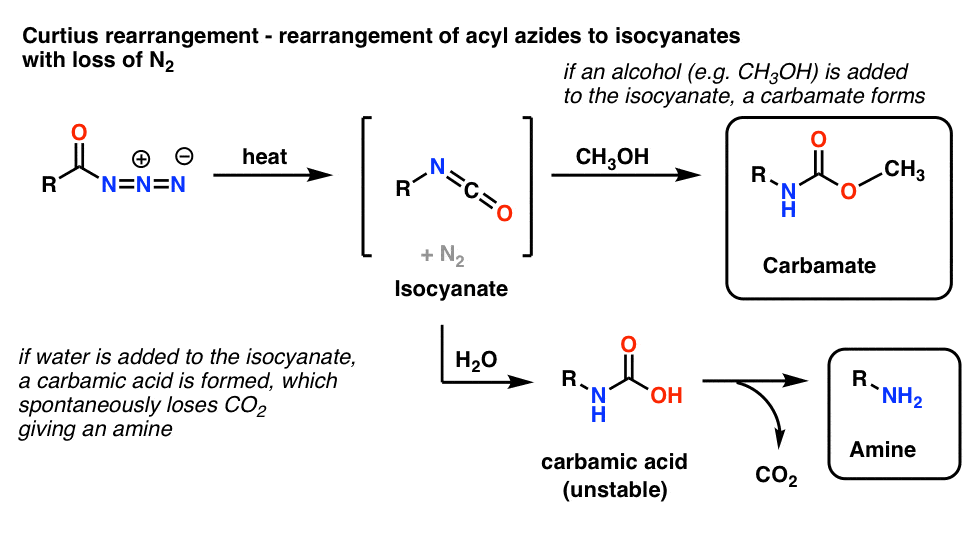
- Si el Curtius se realiza en presencia de un alcohol como el metanol, se forma un carbamato.
- Si en su lugar se añade agua, se forma brevemente un ácido carbámico inestable, que luego pierde dióxido de carbono para dar una amina primaria.
¿Por qué podría ser esto útil? Aquí está una manera.
Hay un montón de métodos para hacer ácidos carboxílicos aromáticos, pero no tantos grandes maneras de formar enlaces C-N en anillos aromáticos. Digamos que tienes un ácido benzoico (como el ácido p-metilbenzoico) pero necesitas formar una amina aromática (protegida). El protocolo de Curtius representa una buena manera de formar un nuevo enlace C-N en el anillo sin tener que recurrir a la nitración + reducción.
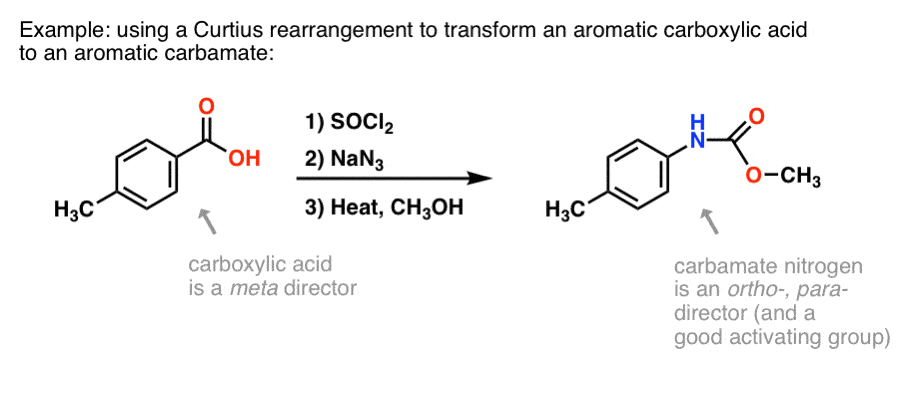
(De esta manera es algo análogo a un equivalente nitrogenado de la oxidación de Baeyer-Villiger. )
Más ejemplos de nucleófilos de azida: Apertura de epóxidos y adición conjugada
Dos aplicaciones más del ion azida como nucleófilo incluyen la apertura de epóxidos (en lo que es esencialmente un proceso SN2 – nótese la inversión de la configuración) y también la adición conjugada en cetonas insaturadas alfa,beta:
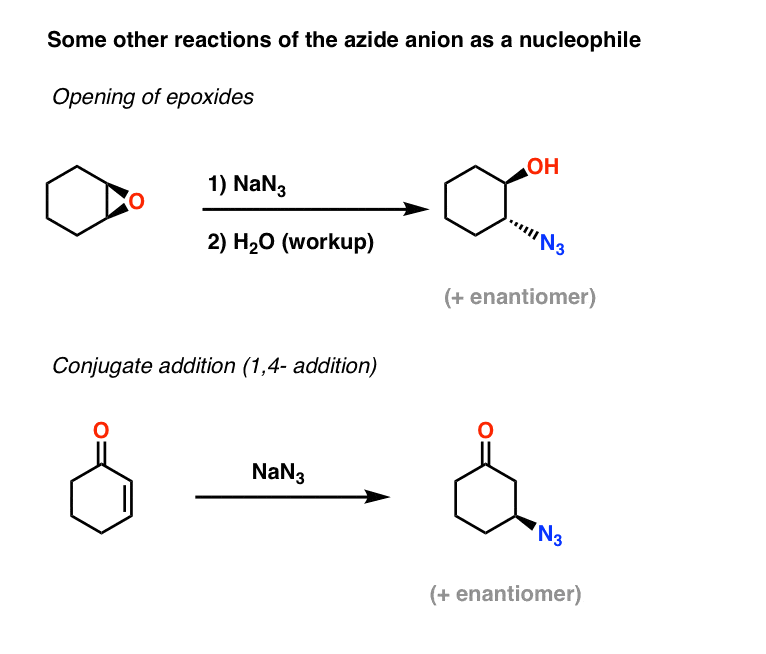
Las azidas de alquilo resultantes pueden entonces reducirse a aminas primarias utilizando los métodos cubiertos anteriormente.
Notas
Nota a pie de página: Cicloadiciones Azida-Alquino, a.k.a. Química de «clic»
Una aplicación interesante y útil de las azidas orgánicas que aún no ha entrado en los libros de texto de introducción a la química orgánica (pero que probablemente lo hará en un futuro próximo) es un proceso técnicamente llamado «reacción de cicloadición azida-alquino catalizada por cobre», pero más comúnmente llamada simplemente «reacción de clic alquino-azida».
Cuando un alquino terminal se trata con un catalizador de cobre en presencia de una azida orgánica, se produce rápidamente una cicloadición que conduce a la formación de un 1,2,3-triazol.
No vamos a profundizar en los detalles, pero esta reacción de formación de anillo implica 6 electrones pi y es un primo de la reacción de Diels-Alder (los quisquillosos observarán con razón que la versión catalizada por cobre no es técnicamente un proceso concertado, pero la versión no catalizada sí lo es)
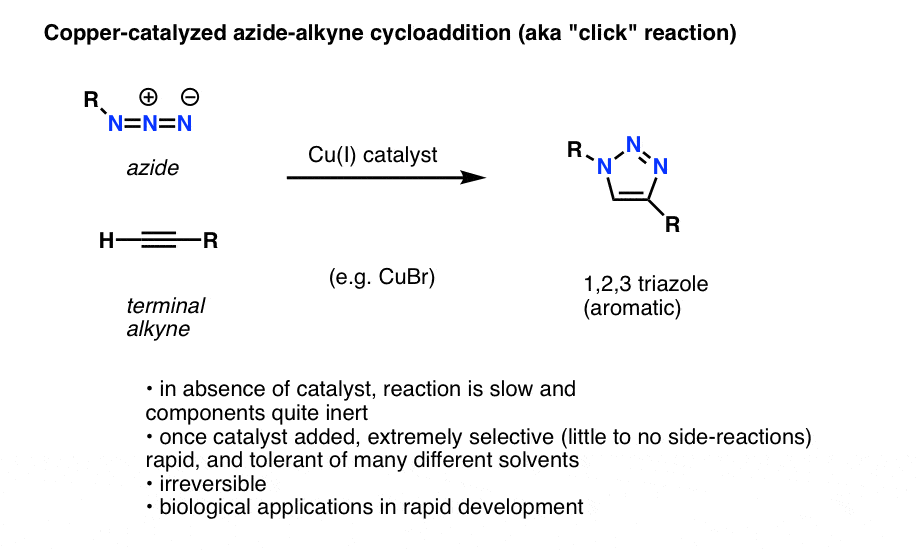
La reacción es notable por algunas razones:
- los socios reactivos (alquino terminal y azida orgánica) son relativamente inertes en ausencia de un catalizador en la mayoría de las condiciones.
- Una vez que se añade cobre, la reacción se produce con extrema rapidez en condiciones suaves y en una variedad de disolventes (incluida el agua).
- Es extremadamente selectiva en estas condiciones, los socios alquino y azida reaccionan sólo entre sí, de forma irreversible.
- El producto, un anillo de triazol, es aromático y estable
Una de sus creadoras, Barry Sharpless, la ha llamado reacción de «clic» porque es una de las cosas más cercanas que tienen los químicos a una reacción que es como el «clic» suave de dos bloques de lego complementarios.
Lo que ha hecho que esta reacción sea especialmente útil en los últimos tiempos es que las parejas de azidas y alquinos pueden instalarse en moléculas de interés biológico y «encajarse» cuando se desee.
Por ejemplo:
- Colocar un acetileno en la posición 5′ de un azúcar y una azida en la posición 3′ se ha utilizado para hacer ADN «encajado», donde el triazol sustituye al organofosfato.
- Increíblemente, un grupo ha fabricado ADN «clicado», lo ha introducido en células humanas y ha conseguido que se transcriba mediante ARN mensajero.
- El AZT que contiene azida (arriba) funciona atascando la maquinaria de transcripción. Algunos ingeniosos encontraron una manera de aplicar la reacción de clic de azida-alquino hacia la secuenciación rápida del genoma, una técnica conocida como ClickSeq.
Takata utilizó azida sódica a principios de los 90, y luego pasó a tetrazol y después a nitrato de amonio.
De «Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis».
El nitrato de amonio costaba una décima parte del precio del tetrazol, según Upham, que también revisó las patentes de la industria. Pero el nitrato de amonio tenía un defecto crítico que, según él, llevó a otros fabricantes de bolsas de aire a renunciar a él: El nitrato de amonio tiene cinco fases de densidad variable que dificultan su estabilidad en el tiempo. Un propulsor fabricado con nitrato de amonio se hinchaba y encogía con los cambios de temperatura y, finalmente, la pastilla se descomponía en polvo. El agua y la humedad acelerarían el proceso. El polvo arde más rápidamente que una pastilla, por lo que una bolsa de aire cuyo propulsor se hubiera desmenuzado probablemente se desplegaría de forma demasiado agresiva. La explosión controlada sería sólo una explosión. «Todo el mundo siguió un camino, y sólo Takata siguió otro», dice Jochen Siebert, que ha seguido el sector de los airbags desde los años 90 y ahora es director general de JSC Automotive Consulting. «Si se leen los documentos de las conferencias de entonces, se puede ver que la gente decía: ‘No, no hay que hacerlo. Es peligroso’. «
La metralla de los airbags defectuosos ha matado a 13 personas en todo el mundo, y ha herido a más de 100.
El 25 de junio de 2017, enfrentándose a responsabilidades de más de 11.000 millones de dólares, Takata se declaró en quiebra.
Síntesis de aminas primarias «Hacer y no hacer» :
(Avanzado) Referencias y lecturas adicionales
Las azidas son útiles en la síntesis orgánica, y un punto destacado de la química de azidas se da en las referencias a continuación.
- Reactividad nucleófila del ion azida en varios disolventes
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
El profesor Herbert Mayr (LMU, Múnich, Alemania) ha dedicado su carrera a contribuir a la química física orgánica fundamental cuantificando la electrofilia y la nucleofilia, y desarrollando escalas para comparar la reactividad de varios nucleófilos y electrófilos. - Los desplazamientos SN2 en brosilatos de 2-norbornilo
Klaus Banert y Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - Una síntesis mejorada de la azidotimidina
I. Balagopala, A. P. Ollapally, &H. J. Lee
Nucleósidos, Nucleótidos &Ácidos Nucleicos 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Los azidas pueden utilizarse como nucleófilos en reacciones SN2. La Ref. #3 muestra el uso del ion azida en la síntesis de AZT (azidotimidina). La conversión de 1 a 5 vía 3 en la ref. #3 utiliza la reacción de Mitsunobu, que permite el desplazamiento de un grupo -OH con un nucleófilo con inversión de la configuración. - Reducción de azidas orgánicas a aminas primarias con hidruro de litio y aluminio
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
La reducción de azidas orgánicas a aminas primarias es un método conveniente para la síntesis de aminas primarias, que de otro modo son difíciles de sintetizar selectivamente por métodos estándar. - La sensibilidad explosiva de las azidas metálicas al impacto
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Una investigación de la sensibilidad al impacto de NaN3, TlN3, y Pb(N3)2. - La reacción de Curtius
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Una revisión antigua pero completa de la reacción de Curtius, que incluye la historia del descubrimiento de este reordenamiento, el alcance del sustrato, las limitaciones, la comparación con otras reacciones similares y los procedimientos experimentales. - Métodos y reacciones sintéticas. 121. Preparación catalizada por yoduro de zinc de aroil azidas a partir de cloruros de aroilo y trimetilsilil azida
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Un procedimiento conveniente para la preparación de azidas de arilo aromáticas del Premio Nobel Prof. George A. Olah. Éstas pueden utilizarse luego para los reordenamientos de Curtius.
Apertura de epóxidos y adición de conjugados:
- CILOHEXENO IMINA (7-AZA-BICICLOFENO)
Iain D. G. Watson, Nicholas Afagh y Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Se trata de un procedimiento especialmente útil, ya que es una reacción de Staudinger para convertir epóxidos en NH-aziridinas (el análogo nitrogenado de los epóxidos). La síntesis puede ser complicada, pero se ha proporcionado mucho detalle aquí para que pueda reproducirse, como encajar un procedimiento en Organic Syntheses. - Adición catalizada por amina del ion azida a compuestos carbonílicos α,β-insaturados
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Este trabajo es interesante ya que representa una forma temprana de organocatálisis y probablemente procede a través de un intermedio de iones imina o iminio. Desgraciadamente, el término no se utiliza en ninguna parte del artículo – ¡estos autores podrían haberse adelantado al profesor MacMillan! - Click Chemistry: Diversa función química a partir de unas pocas buenas reacciones
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
La reacción de cicloadición catalizada por Cu de azidas con alquinos ha sido bautizada como reacción «clic» por el Premio Nobel Prof. K. Barry Sharpless (The Nobel Laureate). K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) debido a su simplicidad, alto rendimiento, rápida cinética y compatibilidad con una amplia gama de condiciones y sustratos. Las reacciones sin Cu también son posibles si se utilizan alquinos tensados (por ejemplo, los ciclooctanos).