Nombre genérico: tartrato de fendimetrazina
Forma de dosificación: comprimido
Revisado médicamente por Drugs.com. Última actualización: 22 de junio de 2020.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
Sólo con receta
El nombre de la marca Bontril de liberación lenta ha sido descontinuado en los EE.UU. Si las versiones genéricas de este producto han sido aprobadas por la FDA, puede haber equivalentes genéricos disponibles.
- Descripción de Bontril
- Bontril – Farmacología clínica
- Indicaciones y uso de Bontril
- Contraindicaciones
- Advertencias
- Precauciones
- Interacciones medicamentosas
- Carcinogénesis, mutagénesis, alteración de la fertilidad
- Embarazo
- Uso en el embarazo
- Madres lactantes
- Uso pediátrico
- Reacciones adversas
- Abuso y dependencia de drogas
- Sustancia controlada
- Dependencia
- Sobredosis
- Dosis y administración de Bontril
- Dosis habitual en adultos
- Cómo se presenta Bontril
- PANEL DE PRESENTACIÓN PRINCIPAL – Etiqueta de frasco de comprimidos de 35 mg
- Más información sobre Bontril de liberación lenta (fendimetrazina)
- Recursos para el consumidor
- Recursos para profesionales
- Guías de tratamiento relacionadas
Descripción de Bontril
El tartrato de fendimetrazina, como isómero dextro, tiene el nombre químico de (2S,3S)-3,4-Dimetil-2-fenilmorfolina L-(+)-tartrato (1:1).
La fórmula estructural es:
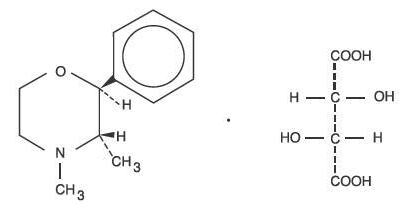
C12H17NO-C4H6O6 P.M. 341,36
El tartrato de fendimetrazina es un polvo cristalino blanco e inodoro. Es libremente soluble en agua; escasamente soluble en alcohol caliente, insoluble en cloroformo, acetona, éter y benceno.
Además, están presentes los siguientes ingredientes inactivos: Azúcar compresible, azúcar de confitería, D&C amarillo nº 10, FD&C azul nº 1, FD&C amarillo nº 6, alcohol isopropílico, lactosa anhidra, estearato de magnesio, celulosa microcristalina, povidona, agua purificada, glicolato sódico de almidón.
Bontril – Farmacología clínica
El tartrato de fendimetrazina es una amina simpaticomimética con actividad farmacológica similar a los fármacos prototipo de esta clase utilizados en la obesidad, las anfetaminas. Sus acciones incluyen la estimulación del sistema nervioso central y la elevación de la presión arterial. Se ha demostrado taquifilaxia y tolerancia con todos los fármacos de esta clase en los que se han buscado estos fenómenos.
Los fármacos de esta clase utilizados en la obesidad se conocen comúnmente como «anorécticos» o «anorexígenos». Sin embargo, no se ha establecido que la acción de dichos fármacos en el tratamiento de la obesidad sea principalmente de supresión del apetito. Pueden estar implicadas, por ejemplo, otras acciones del sistema nervioso central o efectos metabólicos.
Los sujetos adultos obesos instruidos en el manejo de la dieta y tratados con fármacos anorexígenos, pierden más peso por término medio que los tratados con placebo y dieta, según se ha determinado en ensayos clínicos de duración relativamente corta.
La magnitud del aumento de la pérdida de peso de los pacientes tratados con fármacos respecto a los tratados con placebo es de sólo una fracción de libra a la semana. La tasa de pérdida de peso es mayor en las primeras semanas de tratamiento, tanto para los sujetos tratados con el fármaco como con el placebo, y tiende a disminuir en las semanas siguientes. No se ha establecido el posible origen de la mayor pérdida de peso debida a los diversos efectos del fármaco. La cantidad de pérdida de peso asociada al uso de un fármaco anorexígeno varía de un ensayo a otro, y el aumento de la pérdida de peso parece estar relacionado en parte con variables distintas del fármaco prescrito, como el médico investigador, la población tratada y la dieta prescrita. Los estudios no permiten sacar conclusiones sobre la importancia relativa de los factores relacionados con el fármaco y los no relacionados con el fármaco en la pérdida de peso.
La historia natural de la obesidad se mide en años, mientras que los estudios citados se limitan a unas pocas semanas de duración; por lo tanto, el impacto total de la pérdida de peso inducida por el fármaco sobre el de la dieta sola debe considerarse clínicamente limitado.
La principal vía de eliminación es a través de los riñones, donde se excretan la mayor parte del fármaco y los metabolitos. Parte del fármaco se metaboliza en fenmetrazina y también en fendimetrazina-N-óxido. La vida media de eliminación estudiada en condiciones controladas es de unas 3,7 horas tanto para la forma de liberación prolongada como para la de liberación inmediata. La semivida de absorción del fármaco a partir de los comprimidos de fendimetrazina de 35 mg de liberación inmediata es apreciablemente más rápida que la tasa de absorción del fármaco a partir de la formulación de liberación prolongada.
Indicaciones y uso de Bontril
Bontril®PDM (tartrato de fendimetrazina) está indicado en el tratamiento de la obesidad exógena como complemento a corto plazo (unas pocas semanas) en un régimen de reducción de peso basado en la restricción calórica en pacientes con un índice de masa corporal (IMC) inicial de 30 kg/m2 o superior que no han respondido a un régimen adecuado de reducción de peso (dieta y/o ejercicio) por sí solos. A continuación se muestra un gráfico del Índice de Masa Corporal (IMC) basado en varias alturas y pesos. El IMC se calcula tomando el peso del paciente, en kilogramos (kg), dividido por la altura del paciente, en metros (m), al cuadrado. Las conversiones métricas son las siguientes: libras ÷ 2,2 = kg; pulgadas x 0,0254 = metros.
| Índice de masa corporal (IMC), kg/m2 Altura (pies, pulgadas) |
||||||
|---|---|---|---|---|---|---|
| Peso (libras) |
5’0″ | 5’3″ | 5’6″ | 5’9″ | 6’0″ | 6’3″ |
| 140 | 27 | 25 | 23 | 21 | 19 | 18 |
| 150 | 29 | 27 | 24 | 22 | 20 | 19 |
| 160 | 31 | 28 | 26 | 24 | 22 | 20 |
| 170 | 33 | 30 | 28 | 25 | 23 | 21 |
| 180 | 35 | 32 | 29 | 27 | 25 | 23 |
| 190 | 37 | 34 | 31 | 28 | 26 | 24 |
| 200 | 39 | 36 | 32 | 30 | 27 | 25 |
| 210 | 41 | 37 | 34 | 31 | 29 | 26 |
| 220 | 43 | 39 | 36 | 33 | 30 | 28 |
| 230 | 45 | 41 | 37 | 34 | 31 | 29 |
| 240 | 47 | 43 | 39 | 36 | 33 | 30 |
| 250 | 49 | 44 | 40 | 37 | 34 | 31 |
El tartrato de fendimetrazina está indicado únicamente en monoterapia.
Contraindicaciones
Reacciones conocidas de hipersensibilidad o idiosincrásicas a los simpaticomiméticos.
Arteriosclerosis avanzada, enfermedad cardiovascular sintomática, hipertensión moderada y grave, hipertiroidismo y glaucoma.
Pacientes muy nerviosos o agitados.
Pacientes con antecedentes de abuso de drogas.
Pacientes que toman otros estimulantes del SNC, incluyendo inhibidores de la monoaminooxidasa.
Advertencias
El tartrato de fendimetrazina no debe utilizarse en combinación con otros agentes anorexígenos, incluyendo los medicamentos recetados, los preparados de venta libre y los productos a base de hierbas.
En un estudio epidemiológico de casos y controles, el uso de agentes anorexígenos, incluyendo el tartrato de fendimetrazina, se asoció con un mayor riesgo de desarrollar hipertensión pulmonar, un trastorno poco frecuente, pero a menudo mortal. El uso de agentes anorexígenos durante más de tres meses se asoció con un aumento de 23 veces en el riesgo de desarrollar hipertensión pulmonar. No se puede excluir un aumento del riesgo de hipertensión pulmonar con cursos repetidos de terapia.
La aparición o el agravamiento de la disnea de esfuerzo, o los síntomas inexplicables de angina de pecho, síncope o edema de las extremidades inferiores sugieren la posibilidad de aparición de hipertensión pulmonar. En estas circunstancias, el tartrato de fendimetrazina debe ser suspendido inmediatamente, y el paciente debe ser evaluado por la posible presencia de hipertensión pulmonar.
Se han notificado casos de cardiopatía valvular asociados al uso de algunos agentes anorexígenos como la fenfluramina y la dexfenfluramina. Los posibles factores contribuyentes incluyen el uso durante períodos prolongados, una dosis superior a la recomendada y/o el uso en combinación con otros fármacos anorexígenos. Sin embargo, no se han notificado casos de esta valvulopatía cuando se ha utilizado tartrato de fendimetrazina solo.
El riesgo potencial de posibles efectos adversos graves como la valvulopatía y la hipertensión pulmonar debe evaluarse cuidadosamente frente al beneficio potencial de la pérdida de peso. Debe considerarse la posibilidad de realizar una evaluación cardíaca inicial para detectar valvulopatías o hipertensión pulmonar preexistentes antes de iniciar el tratamiento con fendimetrazina. No se recomienda el uso de tartrato de fendimetrazina en pacientes con soplos cardíacos conocidos o valvulopatías. El ecocardiograma durante y después del tratamiento podría ser útil para detectar cualquier trastorno valvular que pueda producirse. Para limitar la exposición y los riesgos injustificados, el tratamiento con tartrato de fendimetrazina debe continuarse sólo si el paciente tiene una pérdida de peso satisfactoria dentro de las primeras 4 semanas de tratamiento (es decir, una pérdida de peso de al menos 4 libras, o según lo determinen el médico y el paciente).
La tolerancia al efecto anoréxico de la fendimetrazina se desarrolla en unas pocas semanas. Cuando esto ocurra, debe interrumpirse su uso; no debe superarse la dosis máxima recomendada.
El uso de tartrato de fendimetrazina dentro de los 14 días siguientes a la administración de inhibidores de la monoaminooxidasa puede dar lugar a una crisis hipertensiva.
La interrupción brusca de la administración después de una dosis elevada prolongada produce fatiga y depresión extremas. Debido al efecto sobre el sistema nervioso central, el tartrato de fendimetrazina puede perjudicar la capacidad del paciente para realizar actividades potencialmente peligrosas, como manejar maquinaria o conducir un vehículo de motor; por lo tanto, se debe advertir al paciente en consecuencia.
No se recomienda el tartrato de fendimetrazina en pacientes que hayan utilizado algún agente anorexígeno durante el año anterior.
Precauciones
Hay que tener precaución al prescribir fendimetrazina a pacientes incluso con hipertensión leve.
Los requerimientos de insulina en la diabetes mellitus pueden verse alterados en asociación con el uso de fendimetrazina tartrato y el régimen dietético concomitante.
Fendimetrazina tartrato puede disminuir el efecto hipotensor de la guanetidina. Se debe prescribir o dispensar la menor cantidad posible de una sola vez para minimizar la posibilidad de sobredosis.
Interacciones medicamentosas
No se ha estudiado la eficacia de fendimetrazina tartrato con otros agentes anorexígenos y el uso combinado puede tener el potencial de provocar problemas cardíacos graves.
Carcinogénesis, mutagénesis, alteración de la fertilidad
No se han realizado estudios con tartrato de fendimetrazina para evaluar el potencial carcinogénico, el potencial mutagénico o los efectos sobre la fertilidad.
Embarazo
Categoría C
No se han realizado estudios de reproducción en animales con tartrato de fendimetrazina. Tampoco se sabe si el tartrato de fendimetrazina puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar a la capacidad de reproducción.
Uso en el embarazo
No se ha establecido el uso seguro en el embarazo. Hasta que se disponga de más información, el tartrato de fendimetrazina no debe ser tomado por mujeres que estén o puedan quedar embarazadas, a menos que, en opinión del médico, los beneficios potenciales superen los posibles peligros.
Madres lactantes
Se desconoce si este medicamento se excreta en la leche humana. Debido a que muchos fármacos se excretan en la leche humana, el tartrato de fendimetrazina no debe ser tomado por mujeres que estén amamantando a menos que, en opinión del médico, los beneficios potenciales superen los posibles peligros.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes pediátricos.
Reacciones adversas
Cardiovasculares: Palpitaciones, taquicardia, elevación de la presión arterial, eventos isquémicos.
Se han notificado casos de valvulopatía asociados al uso de algunos agentes anorexígenos como la fenfluramina y la dexfenfluramina, tanto de forma independiente como especialmente cuando se utilizan en combinación con otros fármacos anorexígenos. Sin embargo, no se ha notificado ningún caso de esta valvulopatía cuando se ha utilizado tartrato de fendimetrazina solo.
Sistema nervioso central: Sobreestimulación, inquietud, insomnio, agitación, rubor, temblor, sudoración, mareo, dolor de cabeza, estado psicótico, visión borrosa.
Gastrointestinal: Sequedad de boca, náuseas, diarrea, estreñimiento, dolor de estómago.
Genitourinario: Frecuencia urinaria, disuria, cambios en la libido.
Abuso y dependencia de drogas
Sustancia controlada
Bontril® PDM (tartrato de fendimetrazina) es una sustancia controlada de la Lista lll.
Dependencia
El tartrato de fendimetrazina está relacionado química y farmacológicamente con las anfetaminas. Las anfetaminas y los fármacos estimulantes relacionados han sido objeto de un amplio abuso, y la posibilidad de abuso de la fendimetrazina debe tenerse en cuenta al evaluar la conveniencia de incluir un fármaco como parte de un programa de reducción de peso. El abuso de anfetaminas y drogas relacionadas puede estar asociado con una intensa dependencia psicológica y una severa disfunción social. Hay informes de pacientes que han aumentado la dosis hasta muchas veces la recomendada. La interrupción brusca tras la administración prolongada de dosis elevadas da lugar a una fatiga extrema y a una depresión mental; también se observan cambios en el electroencefalograma del sueño. Las manifestaciones de la intoxicación crónica con fármacos anorexígenos incluyen dermatosis graves, insomnio marcado, irritabilidad, hiperactividad y cambios de personalidad. La manifestación más grave de las intoxicaciones crónicas es la psicosis, a menudo clínicamente indistinguible de la esquizofrenia.
Sobredosis
La sobredosis aguda con tartrato de fendimetrazina puede manifestarse por los siguientes signos y síntomas: inquietud inusual, confusión, beligerancia, alucinaciones y estados de pánico. La fatiga y la depresión suelen seguir a la estimulación central. Los efectos cardiovasculares incluyen arritmias, hipertensión o hipotensión y colapso circulatorio. Los síntomas gastrointestinales incluyen náuseas, vómitos, diarrea y calambres abdominales. La intoxicación puede dar lugar a convulsiones, coma y muerte.
El tratamiento de la sobredosis es en gran medida sintomático. Incluye la sedación con un barbitúrico. Si la hipertensión es marcada, debe considerarse el uso de un nitrato o un agente bloqueador de los receptores alfa de acción rápida. La experiencia en hemodiálisis o diálisis peritoneal es inadecuada para permitir recomendaciones sobre su uso.
Dosis y administración de Bontril
Dosis habitual en adultos
1 comprimido (35 mg) dos veces al día o tres veces al día una hora antes de las comidas.
La dosis debe individualizarse para obtener una respuesta adecuada con la menor dosis eficaz. En algunos casos, ½ comprimido (17,5 mg) por dosis puede ser adecuado. La dosis no debe exceder de 2 comprimidos tres veces al día.
Cómo se presenta Bontril
Comprimido de tres capas de color verde, blanco y amarillo con «B 35» en la cara marcada y la letra «V» en la otra. Los comprimidos de Bontril® PDM que contienen 35 mg de tartrato de fendimetrazina están disponibles en frascos de 100 (NDC 0187-0497-01) y 1000 (NDC 0187-0497-02).
Almacenar a 25°C (77°F); se permiten excursiones a 15°C-30°C (59°F-86°F).
Se requiere formulario de pedido de la DEA.
Distribuido por:
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
Fabricado por:
Mallinckrodt, Inc.
Hobart, NY 13788
Impreso con tinta de calidad alimentaria.
MG #20886
Rev. 10/07
Número de pieza L2BB01
PANEL DE PRESENTACIÓN PRINCIPAL – Etiqueta de frasco de comprimidos de 35 mg
NDC 0187-0497-02
Sólo RX
CIII
Bontril® PDM
(comprimidos de tartrato de fendimetrazina, USP)
35 mg
Cada una de las tres capas
verde, blanco y amarillo
comprimido contiene 35 mg
de fendimetrazina
tartrato
1000
comprimidos
VALEANT™
| Bontril PDM fendimetrazina comprimido de tartrato |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Etiquetadora – Valeant Pharmaceuticals International (042230623)
| Establecimiento | |||
| Nombre | Dirección | ID/FEI | Operaciones |
| MALLINCKRODT INC | 957414238 | Fabricación(0187-0497) | |
Más información sobre Bontril de liberación lenta (fendimetrazina)
- Side Efectos
- Durante el embarazo
- Información sobre la dosis
- Imágenes del medicamento
- Interacciones con otros medicamentos
- 35 Reseñas
- Clase de medicamentos: anorexígenos
Recursos para el consumidor
- Información para el paciente
- Bontril (lectura avanzada)
- Bontril Slow-Release (Advanced Reading)
Recursos para profesionales
- Información de prescripción
- Fendimetrazina (Monografía SAF)
Otras marcas Fendique ER
Guías de tratamiento relacionadas
- Obesidad
Descargo de responsabilidad médica