Chemguide: Apoyo para el nivel CIE A de Química
Resultado de aprendizaje 11.2(f)
Este enunciado es sobre los coeficientes de partición.
Antes de continuar, debe encontrar y leer el enunciado en su copia del programa de estudios.
Partición
Si tienes dos líquidos inmiscibles como el éter y el agua, y los agitas en un embudo de separación, obviamente forman dos capas. El éter es menos denso que el agua, por lo que forma la capa superior.
Supongamos ahora que agitamos una mezcla de éter y agua que contiene una sustancia que es soluble en ambos. Supongamos que la sustancia, X, es más soluble en el éter que en el agua.
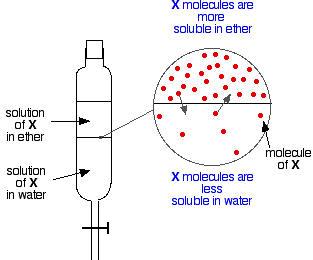
Partículas de X cruzarán la frontera entre las dos capas líquidas, y pronto se obtendrá un equilibrio dinámico. Por cada partícula que se mueva hacia la capa superior, una se moverá hacia la inferior.
Podrías escribir una ecuación para esto:
![]()
![]()
. . y como cualquier otro equilibrio, se puede encontrar una constante de equilibrio:
![]()
![]()
Esta constante de equilibrio se llama coeficiente de partición, y a menudo se le da el símbolo Kpc.
Al igual que otras constantes de equilibrio, los coeficientes de partición son constantes a una temperatura constante, pero también tienen algunas otras restricciones. Sólo funcionan correctamente para soluciones bastante diluidas, y el soluto debe estar en la misma forma química en ambos disolventes. No debe reaccionar, ni ionizarse, ni asociarse (unirse en dímeros, por ejemplo).
Cálculos del coeficiente de partición
Una nota sobre las unidades
Nótese que el coeficiente de partición es un simple cociente de dos concentraciones. No importa qué unidades de concentración utilices – siempre y cuando utilices las mismas arriba y abajo.
Podrías utilizar mol dm-3, pero lo más frecuente es que utilices g cm-3 – gramos por centímetro cúbico.
Técnicamente, los corchetes sólo pueden utilizarse para la concentración en mol dm-3, pero tanto el Cuaderno de Apoyo a la Aplicación como los esquemas de puntuación de CIE lo utilizan también para otras unidades.
No estoy dispuesto a hacerlo, por lo que utilizaré el término «concentración de X» en lugar de donde se utilizan unidades de concentración no estándar.
Calcular un coeficiente de partición
Cuando se agitó una solución de 1,00 g de X en 100 cm3 de agua con 10 cm3 de éter, se transfirieron 0,80 g de X a la capa de éter. Calcule el coeficiente de partición de X entre el éter y el agua.
Si se le pide que calcule un coeficiente de partición entre dos disolventes, la concentración del primer disolvente mencionado va encima de la expresión Kpc. Así que en este caso:
![]()
![]()
Tienes suficiente información para calcular ambas concentraciones en g cm-3.
![]() Concentración de X en el éter = 0,80/10 g cm-3
Concentración de X en el éter = 0,80/10 g cm-3
Si 0,80 g se transfirieron al éter, 1,00 – 0,80 g = 0.20 g se quedaron en el agua.
![]() Concentración de X en el agua = 0,20/100 g cm-3
Concentración de X en el agua = 0,20/100 g cm-3
Entonces:
![]()
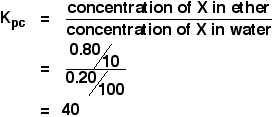
Obviamente, podrías calcular las concentraciones en el éter y en el agua como números reales antes de ponerlas en la expresión. Hazlo como te sientas más cómodo.
Los coeficientes de partición como este no tienen unidades – las unidades se cancelan porque son las mismas arriba y abajo.
Cálculos que implican coeficientes de partición
El programa de estudios del CIE dice específicamente que deberías ser capaz de calcular un coeficiente de partición (en otras palabras, lo que acabamos de hacer). No dice nada en absoluto sobre su uso para calcular otras cosas. Estos cálculos adicionales se discuten en el Folleto de Apoyo a la Aplicación y se han preguntado dos veces en los exámenes hasta junio de 2013 (ambos en 2009).
El Libro de Curso no los incluye (¡bien!) porque el programa de estudios no los menciona, y este libro ha sido avalado por los examinadores de CIE como una «cobertura completa y precisa» del programa de estudios. ¿Significa eso que CIE no hará más preguntas en el futuro? No cuente con ello
Un ejemplo básico
Utilizaremos el mismo caso que antes: los mismos disolventes, el mismo X y el mismo coeficiente de partición que acabamos de calcular.
Esta vez vamos a calcular cuánto se habría extraído en la capa de éter si hubiéramos agitado la solución original de 1,00 g de X en 100 cm3 de agua con sólo 5 cm3 de éter.
Intentamos calcular la masa de X extraída. Llamémoslo m.
Ahora elabora una expresión para la concentración de la solución de X en éter.
![]() Concentración de X en éter = m/5 g cm-3
Concentración de X en éter = m/5 g cm-3
¿Y el agua? Quedarán (1,00 – m) g de X en el agua. Entonces:
![]() concentración de X en el agua = (1,00 – m)/100 g cm-3
concentración de X en el agua = (1,00 – m)/100 g cm-3
Ahora puedes poner todo esto en la expresión del coeficiente de partición. Recuerda que ya hemos calculado que el coeficiente de partición de X entre el éter y el agua es de 40.
![]()
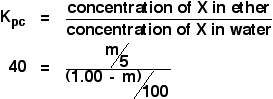
Entonces sólo tienes que enfrentarte a un simple, pero ligeramente tedioso, trozo de álgebra:
![]()
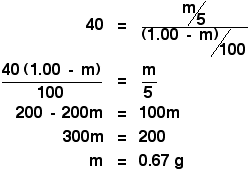
¡Más tedioso!
En el cálculo original para encontrar el coeficiente de partición, se te dijo que si agitabas la solución original de 1,00 g de X en 100 cm3 de agua con 10 cm3 de éter, extraías 0,80 g de X.
Al agitarla con 5 cm3 de éter, acabamos de calcular que extraerías 0,67 g de X.
Eso dejaría 0,33 g de X en los 100 cm3 de agua. Suponga que ha conservado cuidadosamente esta solución y que luego la agita con un segundo lote fresco de 5 cm3 de éter.
¿Cuánto de X extraería en total utilizando el éter como dos lotes separados de 5 cm3 en lugar de los 10 cm3 de una sola vez?
Llamemos n a la masa de X extraída por el segundo lote de éter – para no confundirnos.
Elabora una expresión para la concentración de la solución de X en éter.
![]() Concentración de X en éter = n/5 g cm-3
Concentración de X en éter = n/5 g cm-3
¿Y el agua? Quedarán (0,33 – n) g de X en el agua después de la segunda extracción. Entonces:
![]() concentración de X en el agua = (0,33 – n)/100 g cm-3
concentración de X en el agua = (0,33 – n)/100 g cm-3
Ahora puedes poner todo esto en la expresión del coeficiente de partición para X entre el éter y el agua como antes.
![]()

Esto significa que si se combinan los dos lotes de 5 cm3 de éter, se habría extraído un total de 0,67 + 0,22 g de X. Esto es 0.89 g.
Originalmente se le dijo que si sólo hubiera hecho esto una vez, utilizando el éter como un único lote de 10 cm3, sólo habría extraído 0,80 g.
Obtiene una extracción más eficiente dividiendo su disolvente en volúmenes más pequeños como se ha indicado anteriormente.
Usa este tipo de técnica durante la preparación de algunos compuestos orgánicos. Se extrae lo que se quiere hacer de una solución desordenada en agua para que acabe en un disolvente orgánico. A continuación, se elimina el disolvente mediante una cuidadosa destilación.
El CIE planteó una pregunta similar a ésta en el documento 4 de junio de 2009, P8. Había que calcular un valor para el coeficiente de partición, y luego utilizarlo en una extracción de dos pasos exactamente como la anterior. El cálculo valía 4 puntos. Esto puede ser tedioso y (aparte del cálculo del coeficiente de partición) no está en el programa de estudios, pero no puedes permitirte no ser capaz de hacerlo.