En su forma más simple, una celda electroquímica consiste en dos conductores de electrones separados por un conductor iónico y unidos por un conductor de electrones.
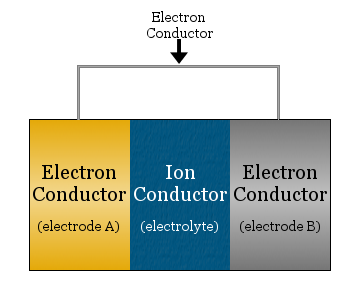
- El conductor iónico se denomina electrolito
- Los conductores de electrones separados por el electrolito se denominan electrodos
- El conductor de electrones utilizado para unir los electrodos suele ser un hilo metálico, como el cableado de cobre
Dos tipos de célula
Existen dos tipos fundamentales de célula electroquímica: la galvánica y la electrolítica.
La conversión de energía se consigue mediante reacciones redox espontáneas (ΔG < 0) que producen un flujo de electrones.
Un flujo de electrones impulsa reacciones redox no espontáneas (ΔG ≥ 0).
Ejemplos
- Una batería que alimenta algo es un ejemplo de célula galvánica.
- Las baterías recargables son ejemplos de ambos tipos de celdas: funcionan como celdas galvánicas cuando alimentan un dispositivo y como celdas electrolíticas cuando se recargan.
- Los ejemplos de celdas electrolíticas también incluyen las que se utilizan para dividir el agua en hidrógeno y oxígeno, y las que convierten el mineral de aluminio en aluminio metálico.
Una fuente de datos termodinámicos
Además de los usos prácticos, como los descritos anteriormente, las celdas electroquímicas proporcionan una excelente forma de recopilar datos termodinámicos.Por ejemplo, permiten determinar potenciales redox estándar, a partir de los cuales se pueden obtener cómodamente datos de entalpía estándar, entropía estándar y energía libre de Gibbs estándar para las reacciones.
Separar reacciones
Las celdas electroquímicas pueden:
- suministrar electricidad, o
- convertir minerales metálicos en el metal, o
- proveer datos termodinámicos,
porque las reacciones redox tienen lugar por separado.
Ejemplo: La célula Daniell
En las células electroquímicas, las reacciones tienen lugar en electrodos separados – y de hecho los propios electrodos pueden estar colocados en diferentes recipientes.Considere una de las primeras células galvánicas, la célula Daniell.
La fuente de energía de la célula Daniell es la reacción espontánea del zinc metálico con el sulfato de cobre para producir sulfato de zinc y cobre metálico.
ΔG° = -212.6 kJ mol-1
Cuando los materiales se juntan:
- en contacto directo en un recipiente, la energía potencial química se convierte en energía térmica y el recipiente de reacción se calienta
- en una celda electroquímica, la energía potencial química se convierte en energía eléctrica
La celda Daniell
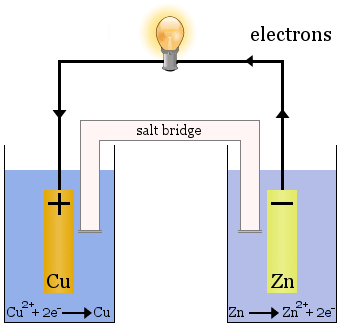
La celda Daniell está formada por dos semiceldas: los iones de cobre se reducen en una y el zinc se oxida en la otra.
Cuando la célula funciona, el Cu2+ se extrae de una célula y el Zn2+ se produce en la otra célula.El electrodo de cobre comienza a crecer a medida que se recubre con metal de cobre recién depositado, y el electrodo de zinc comienza a disminuir debido a la pérdida de zinc en forma de iones en la solución.
El puente salino en el caso anterior es un tubo de vidrio lleno de solución saturada de KNO3.Tiene fritas en los extremos que impiden la mezcla de las soluciones en cada una de las semiceldas, pero permite el paso de iones para completar el circuito eléctrico y mantener cada semicelda eléctricamente neutra.
La fuerza impulsora es la misma ΔG° = -212.6 kJ mol-1 que se obtiene cuando simplemente se mezclan los reactivos en un recipiente;al separar las dos semirreacciones, los electrones deben viajar a través del cable y podemos utilizar la energía eléctrica.
