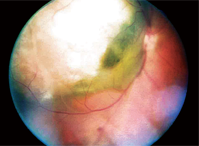
1. Una fotografía del fondo de ojo de nuestro paciente.
Un recluso blanco de 65 años se presentó en la clínica oftalmológica de un centro correccional estatal con una queja de «bichos» en la visión de su ojo izquierdo. Esto había estado ocurriendo durante unas tres semanas; negaba tener fotopsia. Los antecedentes sistémicos del paciente eran significativos en cuanto a hipertensión, problemas cardíacos (se había sometido a dos sustituciones valvulares) y diabetes de tipo 2 que se controlaba con medicamentos orales.
Su historial ocular era significativo por la ceguera «de larga duración» de su ojo derecho.
Al preguntarle más sobre esta ceguera de larga duración, nos enteramos de que, 15 años antes, el paciente había acudido a un especialista en retina, que le dijo que tenía una «peca» en el ojo. Informó de que había perdido la visión en el ojo derecho hacía unos 10 años, pero que no había acudido a un especialista desde aquella visita de hace 15 años.
Datos de diagnóstico
En la exploración, la agudeza visual del paciente era de sólo percepción de la luz O.D., y 20/25 O.S. Las pupilas medían 4mm O.D. y 3mm O.S. y eran redondas y reactivas, con un defecto aferente 3+ O.D. La evaluación del segmento anterior era notable por las cataratas escleróticas nucleares. Realizamos un examen de fondo de ojo con dilatación, y encontramos que la queja principal del paciente se debía a un desprendimiento de vítreo posterior O.S., que causaba una sinéresis vítrea densa y central. No encontramos roturas de retina ni nada más de importancia clínica en ese ojo.
El examen de fondo de ojo dilatado de su ojo derecho reveló una gran lesión elevada, de aproximadamente 12 diámetros de disco, que se extendía desde el disco óptico temporal -e incluso-, pasando por la mácula temporal y más allá de la arcada superior. Era de color blanco-grisáceo con lo que parecía ser algo de contenido líquido en el aspecto inferior-nasal (figura 1).
Diagnóstico
Hicimos un diagnóstico provisional de melanoma coroideo con desprendimiento de retina seroso, y lo documentamos con fotos de fondo de ojo.
Tratamiento y seguimiento
Remitimos a la paciente al oftalmólogo de plantilla del centro para que la evaluara y tratara. Unas dos semanas más tarde, el oftalmólogo lo vio y le hizo una angiografía con fluoresceína, así como una ecografía A y B-scan. Los informes de interpretación de estos procedimientos eran bastante rudimentarios; indicaban que las ecografías A y B revelaban una «masa sólida», y la fluoresceína mostraba que la masa se llenaba de tinte al principio y luego desaparecía lentamente. Tras estos estudios, el oftalmólogo planteó la diferenciación de melanoma maligno o degeneración macular disciforme. Derivó al paciente a un especialista en retina, que lo vio apenas unos días después de su consulta de oftalmología.
El especialista en retina diagnosticó inmediatamente un melanoma de coroides y envió al paciente a un especialista en oculoplástica ese mismo día para discutir el tratamiento. Los resultados de las pruebas diagnósticas del especialista en retina y del especialista en oculoplástica no estaban disponibles en el expediente de la paciente. También se solicitó una tomografía computarizada abdominal con contraste y una radiografía de tórax.
El paciente y el especialista en oculoplástica decidieron el tratamiento con enucleación, y el paciente fue programado para la cirugía la semana siguiente. La enucleación fue un éxito; sin embargo, el paciente lamentablemente experimentó dificultades con la anestesia y murió dos días después de la enucleación. El TAC abdominal y las radiografías de tórax aún no se habían completado.
Discusión
Los melanomas coroideos son relativamente raros, con una incidencia de aproximadamente cinco a seis casos por cada millón de personas, lo que equivale a unos 1.400 casos en los Estados Unidos cada año.1,2 Se encuentran sobre todo en adultos (con el pico alrededor de los 55 años), generalmente no son familiares y muestran una ligera predilección masculina en la mayoría de los grupos de edad.1,3,4 Se dan sobre todo en personas de piel clara con iris azul o verde, y rara vez se encuentran en negros o asiáticos.1,4
Los pacientes con melanomas coroideos suelen ser asintomáticos, pero pueden presentar disminución de la visión, defectos en el campo visual, moscas volantes, fotopsias o, en raras ocasiones, dolor.4,5 Si se produce dolor, suele ser el resultado de un glaucoma secundario o de una necrosis tumoral; los melanomas coroideos también pueden causar dolor al incidir en los nervios ciliares posteriores subyacentes, pero esto rara vez ocurre.3,5
Estas lesiones suelen ser elevadas y pueden tener un aspecto moteado, marrón oscuro, gris apagado, gris verdoso o amarillo (amelanótico).4-6 Pueden adoptar una forma de seta o cúpula con vasos sanguíneos congestionados dentro del tumor; esta configuración representa el 20% de los melanomas coroideos que brotan a través de la membrana de Bruch y el epitelio pigmentario de la retina (EPR).1,4,5
Los melanomas coroideos suelen mostrar una elevación abrupta desde la coroides, líquido subretiniano, pigmentación anaranjada sobre la superficie de la lesión y crecimiento en el tiempo.4 El líquido subretiniano con el consiguiente desprendimiento de retina seroso subyacente es el resultado de la ruptura del EPR. Estos desprendimientos serosos a menudo se desplazan y pueden parecer contener sangre si el tumor ha atravesado la membrana de Bruch.5
La pigmentación anaranjada subyacente es la lipofuscina; este pigmento está compuesto por proteínas, lípidos y pequeños cromóforos, y se acumula en el EPR como resultado de la degeneración celular y la digestión incompleta de los segmentos externos de los fotorreceptores.6,7 La lipofuscina no es específica de los melanomas; también puede estar asociada a los nevos coroideos o a otros tumores coroideos benignos. Sin embargo, la lipofuscina se observa con mucha más frecuencia en los melanomas que en sus homólogos benignos.5
Otros posibles signos asociados a los melanomas coroideos son las hemorragias vítreas o las células vítreas pigmentadas, las drusas en la superficie del tumor, las membranas neovasculares coroideas o incluso la proptosis si el tumor invade la órbita.4
Diagnósticos diferenciales
Hay una plétora de diagnósticos diferenciales para los melanomas coroideos melanóticos y amelanóticos, que varían en el continuo pronóstico de gravedad.
– Los nevos coroideos son un diferencial importante. Son tumores melanocíticos comunes y benignos y se encuentran en aproximadamente el 2% al 6,5% de la población blanca.8-10 Los nevos suelen ser de color gris pizarra y relativamente planos (menos de 2 mm de grosor), aunque hay un solapamiento de tamaño significativo entre los melanomas pequeños y los nevos más grandes.8,9 Al igual que los melanomas coroideos, también pueden mostrar drusas o lipofuscina superpuestas (figura 2). Estadísticamente, de cada 500 nevos coroideos, uno sufrirá una transformación maligna si se sigue durante 10 años; la tasa anual estimada de transformación maligna es de uno de cada 8.845.6,9
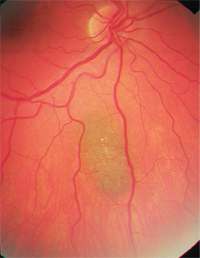
2. Nevo coroideo con drusas suprayacentes.
Existen múltiples factores de riesgo conocidos para dicha transformación (véase «Transformación maligna»).4,8 El más importante parece ser el grosor inicial del nevo de más de 2 mm, pero un diámetro grande de la base (mayor de 7 mm) también sugiere la premalignidad del nevo.8,9 La ausencia de drusas es un buen indicador de pronóstico.7
Mientras que los melanomas coroideos tienden a crecer con relativa rapidez, los nevos coroideos pueden aumentar de tamaño lentamente durante un período de varios años, lo que no indica necesariamente una transformación maligna. Este crecimiento no maligno es más común en pacientes jóvenes y tiende a estabilizarse con la edad.11 Por lo tanto, el crecimiento lento de los nevos coroideos no es invariablemente un signo de malignidad, especialmente en pacientes jóvenes sin otros factores de riesgo.11
Es interesante que las lesiones coroideas pigmentadas sin ninguno de los factores de riesgo mencionados tengan un 3% de probabilidades de crecer en cinco años; estas lesiones suelen ser nevos coroideos.9 La presencia de uno de los factores mencionados conlleva un 38% de posibilidades de crecimiento, y existe más de un 50% de posibilidades de crecimiento si están presentes dos o más factores de riesgo.9 El riesgo relativo de crecimiento aumenta de 1,9 veces a 27,1 veces para la presencia de uno frente a los cinco factores de riesgo.9
– La metástasis coroidea se refiere a un tumor que se ha extendido a la coroides a través de rutas hematógenas desde una neoplasia primaria en otra parte del cuerpo. Por lo tanto, no son tumores primarios como el melanoma coroideo; la mayoría de las veces son metástasis de un cáncer de mama o de pulmón. Estas lesiones suelen tener forma de cúpula y un color amarillo cremoso, y a menudo provocan desprendimientos de retina. Las metástasis coroideas suelen ser bilaterales o multifocales y no tienen forma de hongo, a diferencia de los melanomas amelonóticos.1
– La hipertrofia congénita del EPR se presenta como lesiones planas, únicas o multifocales, de pigmentación oscura, a menudo con lagunas hipopigmentadas. Son benignas, no suelen cambiar con el tiempo y no requieren tratamiento.1
El desprendimiento de retina seroso resultante y la elevación de la retina secundaria a la degeneración macular asociada a la edad (DMAE) exudativa plantea otro diferencial para el melanoma coroideo. La DMAE puede mostrar hemorragia subretiniana, exudación lipídica o turbia, edema macular de color gris sucio o amarillo, pliegues coroideos, desprendimientos del epitelio pigmentario o cicatrices disciformes.1 La angiografía con fluoresceína ayuda a diferenciar estas afecciones.
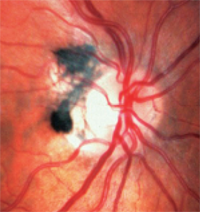
3. Los melanocitomas tienen una pigmentación oscura y se encuentran en el disco óptico o a su alrededor.
– Los melanocitomas tienen una pigmentación oscura y se encuentran en el disco óptico o a su alrededor (figura 3). A diferencia de los melanomas, son congénitos y suelen aparecer en individuos con pigmentos oscuros. Suelen ser inactivos, pero pueden crecer y rara vez se convierten en melanomas.1
– Los hemangiomas coroideos son dilataciones benignas de los vasos sanguíneos de la coroides y suelen estar asociados al síndrome de Sturge-Weber. Aparecen elevados y son de color rojo-anaranjado. Al igual que los melanomas coroideos, pueden inducir desprendimientos de retina serosos.1
– Los osteomas coroideos son masas placoideas de color amarillo anaranjado. Curiosamente, están compuestos por tejido óseo maduro. Pueden permitir el desarrollo de neovascularización coroidea y hemorragia subretiniana. Unos rasgos muy característicos hacen que sean fáciles de diferenciar de los melanomas coroideos mediante ultrasonografía o TC.1
– Otros factores diferenciales de los melanomas coroideos amelonóticos o melanóticos son el desprendimiento de coroides, el linfoma, el carcinoma metastásico, el hematoma subretiniano o sub-RPE, el hematoma supracoroideo localizado, la escleritis posterior nodular, la hiperplasia reactiva del EPR o la gliosis masiva de la retina.4,5
Pruebas adicionales
Varios instrumentos pueden ayudar en el diagnóstico de los melanomas coroideos.
La ecografía A y B-scan no sólo ayuda al diagnóstico, sino que también puede proporcionar medidas más precisas del tumor. El A-scan suele revelar una baja reflectividad interna dentro del tumor; la oscilación en la altura de los ecos dentro de la lesión puede corresponderse con el pulso del paciente, lo que indica la presencia de vascularidad intralesional.1,5
El B-scan muestra una masa sólida con un aspecto anterior acústicamente brillante con oscuridad interna y basal; la forma de la sección transversal suele ser biconvexa, pero puede parecer una seta. También puede observarse una excavación coroidea y un sombreado orbital.1,5
La angiografía con fluoresceína suele mostrar una hiperfluorescencia de los vasos del tumor y una tinción tardía difusa.1 Sin embargo, el patrón de fluoresceína depende del tamaño del tumor, la forma, la pigmentación, la integridad del EPR y la existencia de un desprendimiento de retina seroso correspondiente, entre otras variables.5 La angiografía con fluoresceína no arroja signos patognomónicos de melanoma coroideo.3
En este paciente en particular, el melanoma coroideo se diagnosticó sobre la base del examen fundoscópico, las ecografías A- y B-scan y la angiografía con fluoresceína (sin biopsia).
La presentación clínica de este paciente por sí sola era altamente sugestiva -básicamente inequívoca- de un melanoma coroideo. Poseía cuatro de los cinco factores de riesgo de malignidad antes mencionados: grosor > 2mm, líquido subretiniano, síntomas/pérdida visual y una localización < 3mm del disco óptico. Aunque no se dispone de las dimensiones de la lesión melanótica basadas en la ecografía, estaba claramente engrosada más de 2 mm y tenía un diámetro basal mayor de 7 mm (los límites superiores ampliamente aceptados de los nevos benignos).8,12
Además, la masa presentaba características claramente invasivas, como la invasión del disco óptico.8,12
Manejo y pronóstico
Cuando se encuentra una masa ocular sospechosa, es importante preguntar al paciente si ha tenido alguna cirugía o traumatismo ocular; antecedentes de cáncer; o cualquier síntoma sistémico de cáncer, como anorexia, pérdida de peso, fatiga general, malestar o enfermedad. Aunque el 98% de los pacientes con melanomas coroideos no tienen enfermedad metastásica detectable en el momento del diagnóstico, hay que descartar la existencia de metástasis.5 Lo más apropiado sería que se encargara de ello un oncólogo ocular, por lo que debería remitirse.
Las pruebas incluyen un recuento sanguíneo completo, enzimas hepáticas, TAC abdominal, resonancia magnética o ecografía y una radiografía de tórax.4,5 Existen varias opciones de tratamiento para los melanomas coroideos, pero muchas de ellas conllevan altos riesgos; por lo tanto, el médico tratante debe sopesar cuidadosamente muchas variables a la hora de seleccionar la modalidad de tratamiento adecuada para cada paciente en particular. Algunos factores a tener en cuenta son el tamaño y la localización del tumor, el estado de las metástasis, el estado visual tanto del ojo afectado como del no afectado, y la edad y el estado de salud general del paciente.5 Dependiendo de estos factores, la observación puede ser un plan de tratamiento viable si el paciente tiene problemas médicos concurrentes graves, pero generalmente no se aconseja.
Transformación maligna
Los factores de riesgo de transformación maligna de los nevos coroideos son:4
– Espesor > 2mm.
– Líquido subretiniano.
– Presencia de síntomas.
– Pigmento anaranjado prominente sobre la lesión.
– Localización < 3mm del disco óptico.
*Si se dan dos o más factores, la lesión es probablemente un melanoma coroideo.
Un tratamiento muy agresivo es la enucleación, pero conlleva riesgos importantes. La mitad de los pacientes tratados con enucleación acaban muriendo de melanoma metastásico. Esta opción de tratamiento invasivo se plantea con más frecuencia si el ojo afectado es ciego, doloroso, muestra afectación del disco óptico o si el tumor es muy grande.5
La mayoría de los melanomas coroideos pequeños se tratan con terapias localmente destructivas, como la termoterapia, la radioterapia o la irradiación.12 Se pueden utilizar varios tipos de radiación como tratamiento.4,5 La más común es la braquiterapia de placa, que utiliza una placa radiactiva que se sutura en la superficie del globo terráqueo exterior al tumor.
Esto se intenta más comúnmente con tumores más pequeños que están a 3 diámetros de disco o más lejos del disco y la fóvea. Aproximadamente entre el 10% y el 15% de los pacientes tratados de este modo experimentan una recaída local del tumor después del tratamiento. Tras el tratamiento, la visión del paciente suele ser la misma que antes del mismo, pero existe la posibilidad de que mejore. Sin embargo, la visión puede reducirse posteriormente debido a efectos secundarios, como retinopatía por radiación, papilopatía óptica, cataratas o glaucoma neovascular.
La fotocoagulación puede intentarse para tumores pequeños (< 3mm de grosor, < 7mm de diámetro basal).4,5 Al igual que la fotocoagulación por cualquier otro motivo, se producirá un escotoma permanente en las zonas fotocoaguladas. También pueden utilizarse otros tratamientos con láser, como la termoterapia transpupilar, que utiliza un láser infrarrojo de baja potencia y larga duración.5,12 Esta técnica puede utilizarse junto con la radioterapia en placa, pero no ha demostrado una mejora significativa en el control local del tumor.13
Otros tratamientos menos comunes incluyen la resección local, la terapia fotodinámica o la crioterapia.4,5 A menudo, se utilizan múltiples tratamientos como parte de un enfoque combinado.
Lamentablemente, el pronóstico de los pacientes con melanoma coroideo suele ser malo. A pesar del tratamiento, entre el 30% y el 50% de los pacientes acaban desarrollando enfermedad metastásica; ésta se produce preferentemente en el hígado, pero también en el pulmón, el hueso, la piel, los ganglios linfáticos o el sistema nervioso central.3,11,14 La misma proporción de pacientes morirá en los 10 años siguientes al diagnóstico, normalmente debido a la diseminación metastásica.3,11
Una vez que se produce la metástasis, la fatalidad es casi segura.11 La mayor incidencia de detección metastásica se produce en el año siguiente al diagnóstico del melanoma coroideo, aunque puede no producirse hasta años después. Varios factores se correlacionan con el aumento de la tasa de mortalidad, entre ellos el mayor tamaño del melanoma, la localización anterior, la extensión extraescleral, el crecimiento a través de la membrana de Bruch, la extensión al nervio óptico, la falta de pigmentación y el tipo de célula agresiva y/o la actividad mitótica.3
Es evidente que este paciente no recibió la atención adecuada en su primera cita con la clínica de optometría; sin embargo, a pesar de las derivaciones apropiadas tras su segunda cita, las posibilidades de un resultado satisfactorio se redujeron notablemente.
Aunque un retraso en la derivación de unos meses puede no haber alterado significativamente los resultados en este caso, esta situación enfatiza la importancia de una historia clínica exhaustiva y una comunicación eficaz entre médico y paciente. También subraya la importancia de las derivaciones apropiadas y los exámenes adicionales, independientemente de la naturaleza «antigua» de una enfermedad.
Aunque el pronóstico de los pacientes con melanoma coroideo puede parecer sombrío, los profesionales de la salud ocular deben instituir un tratamiento adecuado tan pronto como descubran dicha lesión para mejorar las posibilidades del paciente de tener resultados secundarios positivos, incluyendo la preservación de la visión.
El Dr. Weidmayer ejerce con un grupo de optometristas en Eye Center of Lenawee, P.C., en Adrian y Brooklyn, Mich.
1. Spaide RF. Enfermedades de la retina y el vítreo. 1st ed. Philadelphia: W.B. Saunders; 1999:262-65.
2. Margo CE. The collaborative ocular melanoma study: an overview. Cancer Control. 2004 Sep-Oct;11(5):304-9.
3. García-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Choroidal Melanoma EMedicine Ophthalmology. Medscape Reference. 24 de junio de 2009. http://emedicine.medscape.com/article/1190564-overview. Consultado el 17 de agosto de 2010.
4. Nevo coroideo y melanoma maligno de la coroides. En: Ehlers JP, Shah CP (eds). The Wills Eye Manual: Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. En: Yanoff M, Duker JS, eds. Ophthalmology. 1st ed. London: Mosby;1999:1052-63.
6. Jones WL. Ophthalmoscopy. En: Terry JE (ed). Ocular Disease: Detección, Diagnóstico y Tratamiento. 1st ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Fundus autofluorescence and optical coherence tomography findings in choroidal melanocytic lesions. Middle East Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Size overlap between benign melanocytic choroidal nevi and choroidal malignant melanomas. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Long term ultrasonic follow up of choroidal naevi and their transformation to melanomas. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Slow enlargement of choroidal nevi: a long-term follow-up study. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. Un ensayo de expresión multigénica preciso y clínicamente factible para predecir la metástasis en el melanoma uveal. J Mol Diagn. 2010 July;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Diagnostic transvitreal fine-needle aspiration biopsy of small melanocytic choroidal tumors in nevus versus melanoma category. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Radioterapia en placa para el melanoma coroideo yuxtapapilar: control del tumor en 650 casos consecutivos. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. Whole body PET/CT for initial staging of choroidal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1270-74.