- Artículo de revisión
- Fístula enterocutánea: Manejo basado en la evidencia
- Abstract
- Introducción
- Tabla 1
- Tabla 1: Clasificación.
- Tabla 2
- Tabla 2: Variables pronósticas del ECF.
- Clasificación
- Factores de pronóstico de la FEC
- Diagnóstico
- Figura 1
- Gestión
- Reanimación
- Control de la fuente
- Manejo del efluente
- Cuidado de las heridas
- Tabla 3
- Tabla 3: Tiempo hasta la gestión definitiva.
- Nutrición
- Conclusión
Artículo de revisión
Fístula enterocutánea: Manejo basado en la evidencia
Ryan P Dumas1*, Sarah A Moore1 y Carrie A Sims2
1Departamento de Traumatología, Cuidados Críticos Quirúrgicos &Cirugía de Emergencia, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Departamento de Cirugía, División de Traumatología, Cuidados Críticos Quirúrgicos & Cirugía de Emergencia, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Autor correspondiente: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
El manejo de la fístula enterocutánea (FCE) es una habilidad clínica que debería estar en el armamentario de todo cirujano general. Aunque el tratamiento definitivo a menudo se basa en el cierre quirúrgico, el cuidado y la diligencia preoperatorios son primordiales para garantizar un resultado satisfactorio. El cuidado de estos pacientes debe centrarse en cuatro fases clave. La primera fase se caracteriza por el reconocimiento y la reanimación adecuados. Durante la segunda fase, se realiza una evaluación y un plan nutricional completos. La evaluación radiográfica durante la tercera fase ayuda a definir la anatomía del ECF. Por último, la cuarta fase se caracteriza por el cierre definitivo en caso de que la fístula no se cure de forma espontánea.Esta revisión se centrará en los aspectos clave que definen cada fase y ayudarán al cirujano general a maximizar las posibilidades de un resultado positivo.
Introducción
El desarrollo de una fístula enterocutánea (FEC), definida como una conexión anómala entre la luz del intestino y la piel externa, es una fuente importante de morbilidad y mortalidad a pesar de los avances en la atención médica y quirúrgica. Sin embargo, la incidencia global de la FEC se desconoce y la mayoría de los datos relativos a la FEC proceden de grandes series institucionales retrospectivas o específicas de cirujanos. Sorprendentemente, sólo el 25% de los FEC son secundarios a una enfermedad inflamatoria intestinal, a una patología diverticular, a un traumatismo, a la radiación y a una neoplasia. Por el contrario, casi el 75% de todas las FEC son el resultado directo de la cirugía laparoscópica o abierta, siendo una fuga astomótica tras una enterectomía la responsable de más del 50% de estas fístulas. Las lesiones iatrogénicas involuntarias, como las enterotomías o las lesiones térmicas no reconocidas sufridas durante el curso de una operación, representan el resto de las fístulas. Dado que la FEC es un problema creado por el cirujano, la responsabilidad de la prevención, así como de la gestión, la planificación y el tratamiento definitivo adecuados, recae legítimamente en el cirujano.
La morbilidad y la mortalidad tras la FEC son extremadamente altas. Se calcula que el 90% de los pacientes experimentan una morbilidad relacionada con la FEC, que va desde la excoriación de la piel hasta la deshidratación y la sepsis, y que la mortalidad atribuible a la FEC oscila entre el 5 y el 20% y depende de varios factores, como la infección subyacente y la localización de la fístula. Dado que la principal causa de muerte en pacientes con FEC es la sepsis, el control de la fuente sigue siendo una de las piedras angulares del tratamiento. En series retrospectivas, se ha observado que la mortalidad se multiplica por 16 en caso de sepsis y por 22 en caso de infección no controlada. Por lo tanto, el tratamiento precoz y definitivo de las colecciones no drenadas junto con los antimicrobianos a corto plazo tiene el potencial de mejorar significativamente los resultados. En la mayoría de las series, la mortalidad también parece correlacionarse con la salida y la ubicación de la fístula. La mortalidad aumenta del 26% en las fístulas de bajo flujo al 50% en las de alto flujo, teniendo en cuenta los problemas de fluidos, electrolitos y nutrición asociados al tratamiento de la FEC. La mortalidad también está relacionada con la localización y disminuye con las fístulas más distales. Mientras que las fístulas yeyunales presentan la mayor mortalidad, con un 29%, y son mucho más difíciles de tratar, la mortalidad de la fístula colónica es la más baja, con un 6%. Se calcula que el coste del tratamiento de la FEC supera con creces los 500.000 dólares y requiere un equipo multidisciplinar de nutricionistas, enfermeras especializadas en heridas y cirujanos para garantizar un buen resultado. No hay que subestimar la importancia de los centros de tratamiento de alta especialización, que han demostrado reducir significativamente la mortalidad del 42% al 20%.
Tabla 1

| Anatómica | Proximal o distal | Gástrica, duodenal, yeyunal, ileal, colónica |
| Fisiológica | Salida alta, moderada, baja | Salida alta >500 cc/día Salida moderada 200-500cc/día Salida baja <200cc/día |
| Etiología | Iatrogénica vs. espontánea Traumática |
Maligna Radiación Enfermedad inflamatoria intestinal Diverticular |
Tabla 1: Clasificación.
Tabla 1
Clasificación.
Tabla 2

| FAVORABLE | NO FAVORABLE |
|---|---|
| Nutricionalmente repleto | Nutricionalmente agotado |
| – Albúmina >3.0 | Bajo nivel de albúmina, bajo nivel de transferrina |
| Tracto fistuloso largo (>2cm) | Fístula corta, fístulas múltiples y complejas |
| Fístula diverticular | Defecto enteral grande (>1cm), mucosa visible |
| Baja producción | Alta producción (>500cc/día) |
| Fístula única | Radiación previa |
| Continuidad intestinal | Múltiples operaciones previas |
| Operación de índice realizada en el mismo centro | Remisiones externas a un centro de altovolumen |
Tabla 2: Variables pronósticas del ECF.
Tabla 2
Variables pronósticas de las FEC.
Clasificación
No existe un esquema de clasificación universal o bien establecido para las FEC. En general, las fístulas se clasifican anatómicamente, fisiológicamente o por proceso patológico. Además, las fístulas pueden clasificarse en función de la cantidad de salida diaria. Es imperativo que la salida de la fístula se documente con precisión, ya que la cantidad puede dictar cambios en la gestión. La tabla 1 detalla tres paradigmas de clasificación diferentes.
Factores de pronóstico de la FEC
Los factores de pronóstico de la FEC han sido muy bien descritos y son coherentes con el dogma quirúrgico estándar. Los pacientes con una fístula proximal de alto flujo acompañada de una albúmina baja(. Por el contrario, los pacientes sin comorbilidades que tienen fístulas que son el resultado de un procedimiento quirúrgico y son de bajo flujo tienen una evolución más favorable con cierres espontáneos más altos. En la tabla 2 se detallan muchas de las variables que pueden predecir un resultado satisfactorio.
Nunca se insistirá lo suficiente en la importancia del apoyo institucional y la experiencia multidisciplinar como factor pronóstico positivo. Recientemente, la Asociación Canadiense de Terapia Enterostomal codificó la importancia de la atención multidisciplinar identificando a nueve miembros esenciales del equipo en sus recomendaciones de «Mejores Prácticas de ECF». Desde los cirujanos hasta los farmacéuticos y los capellanes, este enfoque de equipo integrado reconoce la experiencia que cada especialidad aporta al cuidado de estos complejos pacientes.
Diagnóstico
Una evolución postoperatoria complicada por el íleo y el desarrollo de una infección de la herida postoperatoria es un presagio de FEC. Una vez que se sospecha una fístula o se ha identificado en la exploración física, los estudios radiológicos son complementos necesarios y el 97% de todos los pacientes se someten a algún tipo de evaluación radiológica. La TC con contraste es esencial, ya que evalúa la presencia de un absceso asociado o una colección no drenada. Una vez optimizado el control de la fuente, la fistulografía fluoroscópica desempeña un papel importante en la definición de la anatomía de la fístula. Un fistulograma ayudará a localizar el origen, determinar la longitud, evaluar la presencia de obstrucción distal y determinar si la fístula está en continuidad con el resto del intestino. Una vez que se ha confirmado el diagnóstico de una FEC, la atención debe centrarse en el tratamiento.
Figura 1
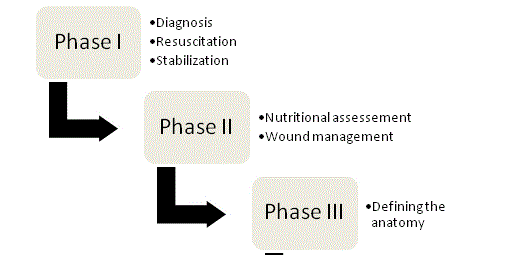
Figura 1
Cuatro fases de la gestión del ECF.
Gestión
Los principios de la gestión del ECF fueron defendidos por primera vez por Chapman y sus colegas en 1964 y hasta la fecha siguen siendo las piedras angulares de la terapia. En su artículo original, Chapman et al. identificaron cuatro factores clave: reanimación con líquidos, control de la fuente, gestión de los efluentes y protección de la piel. La importancia de la nutrición ha surgido recientemente como un quinto elemento clave. Debe adoptarse un enfoque organizado y sistemático con todos los pacientes con fístulas para optimizar las posibilidades de éxito, y el tratamiento puede dividirse en las cuatro fases (figura 1).
Reanimación
La reanimación de un paciente con una FCE recién diagnosticada sigue muchos de los mismos principios que la reanimación de los pacientes sépticos y los principios de la Campaña de Supervivencia a la Sepsis deben servir de marco. La atención inicial debe centrarse en la reanimación agresiva con líquidos, la evaluación rápida y la corrección de los desequilibrios electrolíticos y la normalización de la acidosis láctica. Los pacientes con FEC suelen estar hiponatrémicos, hipocalémicos y acidóticos debido a las continuas pérdidas gastrointestinales. A los pacientes con fístulas de alto gasto se les deben reponer las pérdidas de líquidos, electrolitos y bicarbonatos por vía intravenosa para evitar la deshidratación y la profunda inestabilidad metabólica durante el periodo de estabilización inicial. La monitorización cuidadosa de la diuresis y la reposición selectiva del efluente de la fístula cada 4 u 8 horas evitarán la deshidratación continua.
Control de la fuente
Una vez reanimado el paciente, la atención debe centrarse en establecer el control de la fuente. Como se ha mencionado anteriormente, una exploración por TAC con contraste es fundamental para identificar las acumulaciones y los abscesos no drenados. En los pacientes postoperatorios, lo más probable es que el control de la fuente se realice mediante radiología intervencionista. Sin embargo, ante colecciones inaccesibles o sepsis intraabdominal no controlada, puede ser inevitable una operación. Los antibióticos intravenosos de amplio espectro no deben utilizarse de forma rutinaria para tratar la ECF, a menos que haya evidencia de colecciones intraabdominales o infección de la herida con una celulitis asociada. Siempre que sea posible, los antibióticos deben dirigirse a datos de cultivo específicos y limitarse a menos de 2 semanas.
Manejo del efluente
El manejo del efluente del éxito puede tener un impacto significativo en el estado del volumen, el equilibrio electrolítico, la nutrición y la integridad de la piel.El uso de inhibidores de la bomba de protones puede lograr ambos objetivos y la dosis debe ser titulada hasta que el pH del efluente sea superior a 6 y el volumen de salida sea inferior a 1L/día. Aunque el psyllium puede ser muy útil para abultar el efluente y aumentar el tiempo de tránsito, los agentes antimotilidad y antisecretores, como la loperamida, el atropinedifenoxilato, la codeína, la tintura de opio e incluso la metadona, son el pilar de la reducción de volumen. Dado su papel como inhibidor universal de las hormonas gastrointestinales, se han llevado a cabo numerosas investigaciones para estudiar los efectos de la somatostatina exógena en pacientes con FEC. A pesar de un número significativo de ensayos controlados aleatorios, es difícil sacar conclusiones significativas debido al pequeño tamaño de la muestra y al diseño inconsistente de los estudios. La octreotida, un análogo de la somatostatina de mayor duración, también se ha investigado como complemento del FEC con resultados prometedores. La octreotida 100 mcg tres veces al día puede reducir el volumen del efluente y se ha demostrado que disminuye el tiempo hasta el cierre espontáneo en algunos estudios. Por lo tanto, puede estar justificado un ensayo del tratamiento con octreotida durante 72 horas con una estrecha vigilancia de la salida de la fístula, especialmente en los casos en los que otras terapias no han conseguido reducir el volumen de salida. Los efectos secundarios más comunes son hiperglucemia, cefaleas y colelitiasis.
Aunque los datos son claros en cuanto a que las fístulas de bajo volumen de salida tienen una mayor tasa de cierre espontáneo, no está tan claro que la disminución del volumen de salida mejore el cierre de la fístula. No obstante, la disminución del volumen de salida puede aliviar significativamente la carga del manejo de la fístula y tener un impacto positivo en el bienestar del paciente.
Cuidado de las heridas
Tal vez uno de los aspectos más desafiantes y que exigen más recursos del manejo de la FEC es el control local del efluente. El éxitoentérico puede romper rápidamente la piel y causar irritación que es difícil de tratar. Por ello, es fundamental un tratamiento adecuado de la piel con cremas de barrera, barreras contra la humedad, dispositivos de bolsa y dispositivos de succión. Las fístulas de alto rendimiento, en particular, a menudo requieren una intrincada red de drenajes, bolsas y succión para controlar adecuadamente el efluente. Los equipos altamente especializados en el cuidado de las heridas y los terapeutas enterostomales tienen un valor incalculable tanto para el tratamiento de las heridas como para la comodidad del paciente.
Con el uso omnipresente de la terapia de presión negativa (TPN) para el tratamiento de las heridas y los abdómenes abiertos, no es sorprendente que la TPN se haya convertido en parte del armamento quirúrgico para tratar la FEC. En la mayor serie hasta la fecha, Wainstein et al. informaron de su experiencia con 91 pacientes con fístulas de alto rendimiento tratados con una presión negativa que oscilaba entre -350 y -600 mmHg. Además de disminuir significativamente la salida de efluentes de un promedio de 1400 cc/día a 138 cc/día, se logró el cierre espontáneo en el 46% de los pacientes.En 2016, Misky et al. publicaron un metaanálisis que investigaba el uso de la TPN en la FCE. Utilizando diez estudios retrospectivos con un total de 151 pacientes, estos autores encontraron que la tasa media de cierre espontáneo fue del 65% (con un rango del 7% al 100%) con una mediana de tiempo hasta el cierre de 58 días. Estos investigadores también informaron de una tasa de nuevas fístulas del 4,4%, una complicación conocida que ha hecho reflexionar a algunos profesionales.Aunque es evidente que se necesita más investigación para determinar si la TNP puede mejorar definitivamente las tasas de cierre del ECF o disminuir el tiempo hasta el cierre espontáneo, no deben pasarse por alto los beneficios positivos de estos apósitos. Como mínimo, esta tecnología puede facilitar el manejo del ECF al controlar el efluente, proteger la piel y disminuir la frecuencia de los cambios de apósitos.
Tabla 3

| Investigadores | Práctica institucional |
|---|---|
| Hollington | 8 meses |
| Evenson | 4 meses |
| Rahbour | 12 Meses |
| Datta | 6 Meses |
| Lynch | 6 Meses |
| Li | 6 Meses |
| Mcintyre | 6 Meses |
Tabla 3: Tiempo hasta la gestión definitiva.
Tabla 3
Tiempo para el manejo definitivo.
Nutrición
EvaluaciónEl estado nutricional de un paciente con ECF es de suma importancia. Antes de la llegada de las fórmulas enterales a base de péptidos y de la nutrición parenteral total (NPT), las series históricas retrospectivas ponen de manifiesto la carga de la malnutrición en los pacientes con ECF. En una serie de 157 pacientes de los años 50 y 60, casi el 75% de los pacientes con fístulas proximales estaban desnutridos. Chapman et al. obtuvieron resultados similares y descubrieron que sólo una pequeña minoría de pacientes tenía una nutrición óptima y que, una vez que se mejoraba la nutrición, la mortalidad relacionada con la FCE caía en picado del 55% al 12-16%.
Se debe realizar una evaluación nutricional completa en todos los pacientes con una FCE. Aunque la ecuación de Harris-Benedict es un buen punto de partida para calcular las necesidades nutricionales, está ampliamente aceptado que los pacientes con ECF son catabólicos e hipermetabólicos. En general, estos pacientes necesitan un mayor apoyo calórico con al menos 25-30 kcal/kg/día en hidratos de carbono y grasas y 1,5 a 2 gramos de proteínas/kg/día. La albúmina preoperatoria, en particular, ha demostrado ser el principal factor de predicción de la mortalidad y la morbilidad después de la cirugía general, y la hipoalbuminemia sigue siendo un importante factor de predicción de los malos resultados en los pacientes con ECF. Sin embargo, la proteína más estudiada en el ECF es la transferrina, y los niveles superiores a 140 se han asociado a un aumento de las tasas de cierre espontáneo y a una reducción de la mortalidad. Aunque el balance de nitrógeno puede ser una herramienta útil, esta medida estándar puede ser difícil en pacientes con fístulas de alto rendimiento. En los casos más complejos que no responden a la atención estándar se pueden considerar pruebas adicionales como la calorimetría indirecta.
Nutrición parenteral frente a nutrición enteral
La nutrición parenteral ha desempeñado un papel fundamental en el tratamiento de la FCE, y su uso fue establecido firmemente por Dudrick en 1969.En su artículo centrado en la descripción del tratamiento óptimo de la NPT, Dudrick concluyó que: «con el uso exclusivo de la hiperalimentación parenteral se consigue regularmente un aumento de peso, un balance nitrogenado positivo, crecimiento y desarrollo» . Desde entonces, la NPT ha sido adoptada universalmente como medio para proporcionar nutrición al tiempo que se promueve el «descanso intestinal» y se simplifica la gestión de los efluentes.Mientras que la NPT reduce las secreciones gastrointestinales en un 30%-50%, reduciendo así la incidencia de la deshidratación y los desequilibrios electrolíticos, no existen estudios aleatorios que aborden el impacto de la NPT en la conversión anabólica, las tasas de cierre espontáneo o la mortalidad. No obstante, la NPT sigue siendo una modalidad de tratamiento a largo plazo muy popular, a pesar de sus graves complicaciones, como la infección y la disfunción hepática.
Sin embargo, recientemente, el uso de la nutrición enteral en la FCE ha ido ganando terreno. El uso de la nutrición enteral tiene una serie de beneficios, entre los que se incluyen un menor coste, menos infecciones y una mejor función inmunológica en comparación con la NPT. Además, incluso el suministro de tan sólo el 20% de las calorías por vía enteral puede ayudar a mantener la flora intestinal y disminuir la translocación bacteriana.
Varias series han informado del sorprendente éxito de la alimentación enteral en pacientes con FCE. En una serie retrospectiva de Li et al., el 86,4% de los 1.168 pacientes fueron tratados eficazmente con apoyo enteral. La nutrición enteral puede incluso utilizarse con éxito en el contexto de la fístula de alto rendimiento cuando se combina con fórmulas elementales, agentes antimotilidad y agentes voluminizadores de fibra. En una serie de 335 pacientes con fístulas de alto flujo, Levy et al. lograron la independencia de la NPT en el 85% de su cohorte utilizando la alimentación enteral. Curiosamente, a pesar de la nutrición enteral y la falta de «reposo intestinal», la mortalidad y las tasas de cierre espontáneo fueron similares a las de series anteriores.
En el contexto de una FEC de alto rendimiento con un miembro mucocutáneo distal, la fistuloclisis puede ser un complemento importante de la alimentación enteral estándar. La práctica de la fistuloclisis tiene su origen en la práctica de la alimentación con quimo en neonatos y puede referirse tanto a la realimentación del éxito como a la complementación de la alimentación enteral por sonda adicional a través de un catéter colocado en la extremidad distal de un ECF. Teubner et al. describieron por primera vez la fistuloclisis como terapia para la FCE en 2004 en una serie de casos de doce pacientes con fístulas proximales. Desde entonces, varios informes de casos y pequeñas series han demostrado la eficacia nutricional de esta técnica. En comparación con una cohorte emparejada de pacientes que recibieron RTE sin fistuloclisis, los pacientes con fístulas de alto flujo tratados con fistuloclisis mejoraron significativamente la función hepática y los parámetros nutricionales. La fistuloclisis puede ser especialmente útil en pacientes que desarrollan complicaciones relacionadas con la NPT, como infecciones, problemas de acceso venoso o insuficiencia hepática. Sin embargo, pueden producirse complicaciones, como la obstrucción en caso de que la actividad peristáltica del intestino delgado haga avanzar el catéter de la fístula hacia el interior del intestino delgado.
Las vitaminas y los minerales suelen estar agotados en los pacientes con ECF, siendo frecuentes las deficiencias de vitaminas liposolubles, mientras que las vitaminas hidrosolubles son raras, a menos que la fístula se encuentre en el yeyuno proximal. Además, dado que la vitamina B12 sólo se absorbe en los 50 a 60 cm finales del íleon, es posible que muchos pacientes con FEC necesiten vitamina B12 inyectable. El magnesio se desperdicia con frecuencia en las fístulas de alto rendimiento y debe reponerse con sulfato de magnesio intravenoso o cloruro de magnesio oral para mejorar la absorción enteral. Por último, se ha recomendado la repleción de altas dosis de zinc y vitamina C. Aunque el Omega-3 y el aceite de pescado se han estudiado en el entorno de los cuidados intensivos con algunos beneficios, estos suplementos nunca se han evaluado en pacientes con ECF y no se utilizan de forma rutinaria.
Consideraciones operativas
La tasa de cierre espontáneo del ECF varía entre el 15 y el 75% en la literatura. Esta amplia gama de tasas de cierre refleja probablemente las diferencias en las poblaciones de pacientes y los patrones de práctica institucional. Las fístulas tienen una probabilidad significativamente menor de cerrarse espontáneamente más allá de las 4 semanas, y sólo el 10% de las fístulas se cierran después de dos meses. Dado que las tasas de cierre espontáneo de la FEC son bajas, la intervención quirúrgica es a menudo la única estrategia de gestión definitiva.
La decisión de operar una FEC, sin embargo, no debe tomarse a la ligera, ya que las tasas de recurrencia tras la eliminación de la FEC oscilan entre el 13 y el 34%. Aunque los principios de la intervención quirúrgica para el ECF implican muchos de los principios básicos de la cirugía general, el momento de la operación es quizás el factor más importante a tener en cuenta. Fazio et al. demostraron la importancia de la conducta expectante cuando se trata de pacientes con ECF. Cuando la cirugía se realizaba a menos de 6 semanas del momento de la formación del ECF, la mortalidad superaba el 20%. Sin embargo, al retrasar la operación más de 6 semanas, la mortalidad disminuyó al 11%. En una serie de Lynch et al., los pacientes operados entre 2 y 12 semanas de formación del ECF tenían una tasa de recidiva del 28%, mientras que un retraso superior a 12 semanas reducía esta tasa al 15%. La tabla 3 muestra el tiempo que los autores expertos sugieren que se espere antes de considerar la intervención quirúrgica para un ECF que no cicatriza.
El tratamiento quirúrgico sólo debe llevarse a cabo con la plena inversión y comprensión del paciente y del cirujano. Los ECFs son casos largos y técnicamente desafiantes con el riesgo de complicaciones significativas. Dado que el 36% de las fístulas recurrentes son el resultado de lesiones creadas durante la operación de cierre del ECF, se debe tener mucho cuidado durante la lisis de las adherencias para evitar cualquier lesión inadvertida en el intestino sano. El tratamiento del intestino fistuloso debe incluir siempre una resección intestinal y una astomosis primaria. El exceso de costura o la resección del borde de la fístula siempre da lugar a una mayor recidiva (36% frente al 16%).
Conclusión
La fístula enterocutánea es una de las complicaciones más difíciles a las que se enfrenta el cirujano general. Utilizar un enfoque cuidadoso, sistemático y centrado en el paciente ayudará a maximizar los resultados clínicos exitosos. A pesar de la coherencia de los principios del tratamiento de la FEC en los distintos pacientes, cada fístula es única y su tratamiento se define en gran parte por su resultado, así como por su ubicación y las comorbilidades del paciente. Aunque tanto los cirujanos como los pacientes pueden tener un fuerte deseo de proceder al cierre quirúrgico, los pacientes se benefician de al menos 6 meses de tratamiento no quirúrgico. En última instancia, el cuidado a largo plazo de los pacientes con ECF requiere un tratamiento multidisciplinar coordinado a menudo por el cirujano.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Una experiencia de 11 años de fístula enterocutánea. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Tratamiento de las fístulas enterocutáneas: 30-year clinical experience. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: Una revisión de 132 casos. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Revisión de 404 pacientes con fístulas gastrointestinales. Impacto de la nutrición parenteral. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- González-Pinto I, González EM. Optimización del tratamiento de las fístulas gastrointestinales altas. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrition and management of enterocutaneous fistula. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Clasificación y fisiopatología de las fístulas enterocutáneas. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. The pathophysiology of enterocutaneous fistulas. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Fístula enterocutánea: ¿están mejorando los tratamientos? Surgery. 2006;140:570-6.
- Martínez JL, Luque-de-León E, Mier J, Blanco-Benavides R, Robledo F. Manejo sistemático de las fístulas enterocutáneas postoperatorias: factores relacionados con los resultados. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Un modelo multivariante para determinar los factores pronósticos en las fístulas gastrointestinales. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Perspectivas históricas en el cuidado de pacientes con fístula enterocutánea. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutaneous fistula complicating trauma laparotomy: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Fístula enterocutánea: estrategias probadas y actualizaciones. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Manejo actual de la fístula enterocutánea. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernández E, González D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. Una experiencia de diez años. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Fístulas externas que surgen del tracto gastrointestinal. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Soporte metabólico y nutricional del paciente con fístula enterocutánea: un enfoque en tres fases. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Nivel de albúmina sérica preoperatoria como predictor de mortalidad y morbilidad operatoria: resultados del Estudio Nacional de Riesgo Quirúrgico del VA. Arch Surg. 1999;134:36-42.
- Martínez JL, Luque-de-León E, Ballinas-Oseguera G, Méndez JD, Juárez-Oropeza MA, Román-Ramos R. Factores predictivos de recurrencia y mortalidad tras la reparación quirúrgica de la fístula enterocutánea. Revista de cirugía gastrointestinal : revista oficial de la Sociedad de Cirugía del Tracto Alimentario. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Puede la alimentación intravenosa como único medio de nutrición favorecer el crecimiento en el niño y restablecer la pérdida de peso en el adulto? Una respuesta afirmativa. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. La fistuloclisis puede sustituir con éxito la alimentación parenteral en el soporte nutricional de los pacientes con fístula enterocutánea. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. La fistuloclisis mejora la función hepática y el estado nutricional en pacientes con fístula entérica superior de alto rendimiento. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Manejo de las fístulas enterocutáneas. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Manejo quirúrgico de las fístulas enterocutáneas de alto gasto: una experiencia de 24 años. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative surgery for enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Clinical outcome and factors predictive of recurrence after enterocutaneous fistula surgery. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Manejo de las fístulas gastrointestinales externas. Ann Surg. 1978;188:460-7.