En la rama de la respuesta inmunitaria adaptativa mediada por células, los péptidos cortos se unen a las moléculas del complejo mayor de histocompatibilidad (MHC) de clase I y de clase II y se presentan en la superficie celular, donde son reconocidos por los receptores de antígenos de los linfocitos T. La unión de un receptor de células T (TCR) que reconoce un complejo MHC-péptido particular induce a los linfocitos ingenuos a diferenciarse en células efectoras (células T citotóxicas y auxiliares) que destruyen las células huésped infectadas o estimulan la producción de anticuerpos, y en células de memoria que proporcionan inmunidad protectora contra la reinfección.
Estructura y función de las moléculas MHC
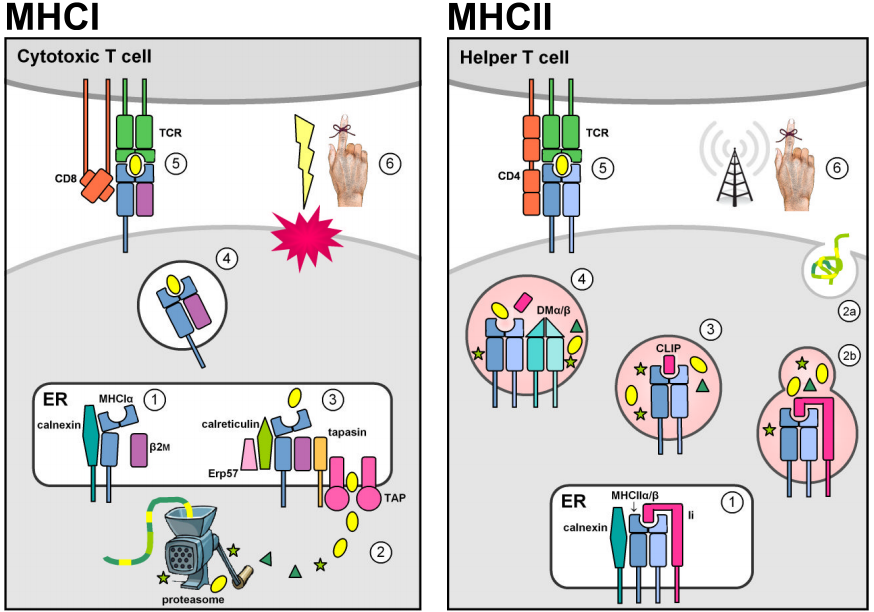
Dos familias multigénicas situadas en la región genómica del MHC codifican moléculas de unión a antígenos que presentan péptidos extraños en la superficie celular. En realidad, las moléculas MHC también presentan péptidos propios. Sin embargo, la selección tímica negativa contra las células T autoreactivas impide que los complejos de péptidos propios del CMH provoquen una respuesta inmunitaria. Las moléculas MHC de clase I se expresan en la mayoría de las células nucleadas y suelen presentar péptidos endógenos derivados de patógenos intracelulares que se replican en el citosol (por ejemplo, virus). Las proteínas citosólicas son degradadas en fragmentos peptídicos cortos por el proteasoma, y son transportadas primero al retículo endoplásmico (RE) por los transportadores dependientes de ATP TAP1 & 2 para la carga de MHCI, y luego a la superficie celular para su presentación a las células T citotóxicas circulantes CD8+ cuya función es inducir la apoptosis y la lisis de la célula diana infectada. (Las figuras están adaptadas de Murphy et al. (2008) Figs. 3.12, 3.25, 5.5, & 5.11.)
La expresión constitutiva de los loci del MHC de clase II está restringida a las células presentadoras de antígenos del sistema inmunitario (APCs, por ejemplo macrófagos, células dendríticas y linfocitos B). Las moléculas MHCII se estabilizan y se evita que se unan al antígeno mientras residen en el RE a través de la asociación con la cadena invariante de clase II (Ii, o CD74), y luego son redirigidas de la vía secretoria por defecto a la vía endocítica. Allí se encuentran con péptidos derivados de patógenos que se replican dentro de vesículas intracelulares o de patógenos y proteínas extracelulares que se transportan al interior de la célula. La unión estable del péptido es catalizada por el dímero no clásico MHCII DMα/β, y permite que los complejos MHCII-péptido escapen de la vía endocítica para presentarse en la superficie celular. El reconocimiento por parte de los linfocitos T CD4+ activa la célula huésped diana para estimular los mecanismos antibacterianos (en los macrófagos) o para desencadenar la producción de anticuerpos y la respuesta inmunitaria humoral.
Las similitudes estructurales de las moléculas MHCI y MHCII probablemente reflejan su descendencia de un ancestro común. Las moléculas MHC maduras son glicoproteínas de membrana integral de tipo I compuestas por un surco de unión a péptidos y por dominios similares a las inmunoglobulinas, transmembrana y citoplasma. Las porciones extracelulares de las moléculas MHC consisten en dos dominios distales de membrana que juntos forman una cavidad de unión a péptidos que está delimitada por dos hélices α interrumpidas que descansan sobre una hoja β antiparalela, y dos dominios similares a inmunoglobulinas (Ig) de membrana proximal que participan en la unión de coreceptores CD4 y CD8.
A pesar de estas similitudes estructurales, las subunidades de la proteína se codifican de forma diferente para las moléculas de clase I y II. Las moléculas MHCI son heterodímeros formados por la asociación no covalente entre una cadena pesada MHCIα y la β2-microglobulina (β2m), que está codificada por un locus ampliamente invariable situado fuera de la región genómica del MHC. La cadena pesada aporta tanto la hendidura de unión al péptido como uno de los dominios tipo Ig, mientras que la β2m sólo aporta una segunda región tipo Ig que carece de anclaje transmembrana. Las moléculas del MHC de clase II son heterodímeros formados por la asociación no covalente de una cadena α y otra β, las cuales aportan dominios individuales de unión a péptidos y anclaje de membrana tipo Ig, y cada una de ellas se transcribe a partir de un locus distinto que se encuentra típicamente dentro de la región del MHC.
Los miembros de la familia de genes del MHC pueden subdividirse a su vez en loci clásicos o no clásicos, además de pseudogenes no funcionales. Los loci clásicos del MHC Ia se expresan ampliamente y suelen estar asociados a una alta variabilidad de la secuencia y a una selección positiva que actúa sobre las sustituciones en los residuos de la región de unión a péptidos (PBR). En cambio, los loci MHC Ib no clásicos tienen una expresión reducida o una distribución tisular limitada, un menor polimorfismo y pueden tener funciones restringidas o modificadas. En el caso de los genes de clase II, el término «clásico» suele referirse a todos los loci de presentación de antígenos, mientras que el término «no clásico» se reserva para genes como el DMα/β que cumplen funciones accesorias en la vía de presentación de antígenos. Aunque esta categorización funcional de los miembros de la familia de genes proporciona un vocabulario de trabajo útil, el límite entre los loci clásicos y los no clásicos no siempre está claro en la práctica y algunos loci MHCI no clásicos son polimórficos, se expresan ampliamente o se unen a ligandos peptídicos de la manera tradicional de los genes clásicos.
El polimorfismo extremo a nivel de población y la evidencia de la selección de equilibrio indican que es probable que se necesite una variación alélica sustancial de los genes MHC para reconocer y responder a un conjunto diverso de patógenos. Sin embargo, a pesar de la extensa duplicación de genes en algunas especies, los individuos suelen expresar sólo un número moderado de loci MHC clásicos y la reversión a la herencia disómica también se observa en algunas especies poliploides de Xenopus. Se cree que las restricciones a la variación intraindividual del MHC (al menos para los loci clásicos altamente expresados) reflejan un compromiso funcional entre el aumento del repertorio alélico para presentar una mayor variedad de péptidos patógenos frente a la consiguiente reducción del repertorio de células T que sería necesaria para mantener la autotolerancia. Por lo tanto, las moléculas individuales del CMH deben ser capaces de unirse a péptidos permisivos para reconocer adecuadamente una amplia gama de antígenos extraños. Sin embargo, también es necesario generar complejos MHC-péptidos estables que persistan durante un tiempo suficiente para permitir el reconocimiento de las células T y que no intercambien péptidos en la superficie celular, lo que podría provocar la destrucción de las células no infectadas. Dicha estabilidad se asocia generalmente con interacciones intermoleculares de alta afinidad, y por tanto restrictivas.
Las moléculas del CMH concilian estos requisitos de unión contrapuestos a través de una elegante solución estructural: los contactos entre los residuos altamente conservados de la región de unión a péptidos (PBR) de la molécula del CMH y los átomos de la cadena principal del péptido estabilizan la unión promiscua de la mayoría de los ligandos peptídicos, mientras que los residuos polimórficos que recubren el surco de unión al péptido crean bolsillos irregulares con diferente estereoquímica que acomodan los residuos del péptido de forma dependiente de la secuencia. Las restricciones impuestas por los bolsillos de unión a cadenas laterales varían tanto entre alelos como entre bolsillos dentro de una misma molécula del CMH. Se dice que los bolsillos que imponen requisitos de unión más estrictos albergan residuos peptídicos de «anclaje primario», mientras que los «anclajes secundarios» son más flexibles en sus preferencias de unión. En conjunto, estas especificidades determinan el motivo de unión al péptido de un alelo particular del MHC para conferir selectividad a la presentación del antígeno.