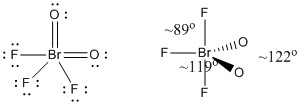Química Inorgánica Intermedia
Universidad de Rhode Island
Otoño 2013
Examen 1
1. Escriba la configuración electrónica (utilizando la notación de gases raros para las cáscaras cerradas) y el Símbolo de Término del estado fundamental para los siguientes: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Sólo el electrón 3d contribuye al símbolo del término: L = 2 y S = ½ dando 2D
b) Sc+
3d2
L = 3 y S = 1 dando 3F
c) Sc2+
3d1
L = 2 y S = ½ dando 2D
d) Sc3+
L = 0 y S = 0 dando 1S
d) Sc-
4s23d2
L = 3 y S = 1 dando 3F
2. Escriba la estructura de puntos de Lewis, dé las cargas formales de todos los átomos, prediga la geometría molecular, la estimación de todos los ángulos de enlace y dé el orbital híbrido probable para lo siguiente: a) BrO2-; b) BrO3-; c) BrO2F3.
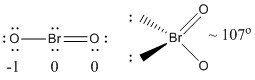
a) BrO2-
Estructura de Lewis:
Las cargas formales se dan en la estructura de Lewis
Estructura: plana doblada con un ángulo de enlace de ~107°
Orbital híbrido en Br: sp3
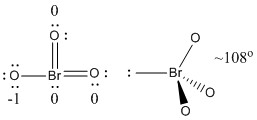
b) BrO3-
Estructura de Lewis:
Las cargas formales se dan en la estructura de Lewis
Estructura: piramidal con ángulos de enlace O-Br-O ~108°
Orbital híbrido en el Br: sp3
c) BrO2F3
Estructura de Lewis:
Las cargas formales se dan en la Estructura de Lewis
Estructura: bipiramidal trigonal con ángulos de enlace mostrados en la figura
Orbital híbrido en el Br: dsp3
3. La Dureza Absoluta de un átomo se define como η = ½(IP – EA), IP es el potencial de ionización y EA es la afinidad electrónica. Prediga las tendencias periódicas de η y razone su predicción.
Para casi todos los átomos IP >> EA, por lo que η seguirá las tendencias periódicas de IP: aumentando a medida que uno se desplaza hacia la derecha en la Tabla Periódica (siguiendo a Z*) y disminuyendo ligeramente a medida que uno se desplaza hacia abajo en la Tabla Periódica a medida que aumenta el radio atómico.
4. Cr2 tiene una configuración electrónica de σ2π4δ4δ*2. Cuál es el orden de enlace y cuántos espines no apareados se prevén? Esperarías que el Cr2 absorbiera la luz en la región visible del espectro? ¿Por qué o por qué no?
El orden de enlace = ½(2 + 4 + 4 – 2) = 4 con 2 espines no apareados (puesto que hay 2 orbitales δ también debe haber 2 orbitales δ*, que tienen un electrón cada uno según las reglas de Hund). El solapamiento lado a lado de los orbitales d para formar orbitales δ es pobre por lo que el desdoblamiento entre los orbitales δ y δ* será pequeño. Esto sugiere que la energía necesaria para mover un electrón del HOMO al LUMO es también pequeña, lo que predice una absorción en la parte visible del espectro.