Nom générique : tartrate de phendimétrazine
Formation posologique : comprimé
Médicalement examiné par Drugs.com. Dernière mise à jour le 22 juin 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Plus
Rx only
Le nom de marque Bontril Slow Release a été abandonné aux États-Unis.S. Si des versions génériques de ce produit ont été approuvées par la FDA, il peut y avoir des équivalents génériques disponibles.
- Déscription de Bontril
- Bontril – Pharmacologie clinique
- Indications et utilisation de Bontril
- Contre-indications
- Avertissements
- Précautions
- Interactions médicamenteuses
- Carcinogenèse, mutagenèse, altération de la fertilité
- Prégantie
- Utilisation pendant la grossesse
- Mères allaitantes
- Utilisation pédiatrique
- Réactions indésirables
- Abus de drogues et dépendance
- Substance contrôlée
- Dépendance
- Surdosage
- Dosage et administration du Pontril
- Dosage habituel chez l’adulte
- Comment est présenté Bontril
- Panneau d’affichage principal – Étiquette de flacon de comprimé de 35 mg
- Plus d’informations sur Bontril Slow Release (phendimetrazine)
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement associés
Déscription de Bontril
Le tartrate de phendimétrazine, en tant qu’isomère dextro, a pour nom chimique (2S,3S)-3,4-Diméthyl-2-phénylmorpholine L-(+)-tartrate (1:1).
La formule développée est :
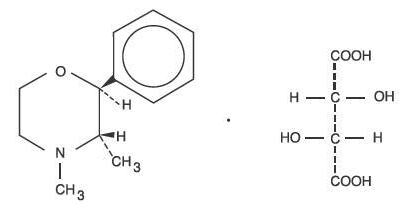
C12H17NO-C4H6O6 M.W. 341,36
Le tartrate de phendimétrazine est une poudre cristalline blanche, inodore. Il est librement soluble dans l’eau ; peu soluble dans l’alcool chaud, insoluble dans le chloroforme, l’acétone, l’éther et le benzène.
En outre, les ingrédients inactifs suivants sont présents : Sucre compressible, sucre de confiserie, D&C jaune #10, FD&C bleu #1, FD&C jaune #6, alcool isopropylique, lactose anhydre, stéarate de magnésium, cellulose microcristalline, povidone, eau purifiée, glycolate d’amidon sodique.
Bontril – Pharmacologie clinique
Le tartrate de phendimétrazine est une amine sympathomimétique ayant une activité pharmacologique similaire aux médicaments prototypes de cette classe utilisés dans l’obésité, les amphétamines. Les actions comprennent la stimulation du système nerveux central et l’élévation de la pression artérielle. Une tachyphylaxie et une tolérance ont été mises en évidence avec tous les médicaments de cette classe chez lesquels ces phénomènes ont été recherchés.
Les médicaments de cette classe utilisés dans l’obésité sont communément appelés « anorexigènes » ou « anorexigènes ». Il n’a cependant pas été établi que l’action de ces médicaments dans le traitement de l’obésité soit principalement une suppression de l’appétit. D’autres actions du système nerveux central ou des effets métaboliques, peuvent être impliqués par exemple.
Les sujets adultes obèses instruits dans la gestion diététique et traités avec des médicaments anorexigènes, perdent plus de poids en moyenne que ceux traités avec un placebo et un régime, comme déterminé dans des essais cliniques à relativement court terme.
L’ampleur de l’augmentation de la perte de poids des patients traités avec des médicaments par rapport aux patients traités avec un placebo est seulement une fraction de livre par semaine. Le taux de perte de poids est le plus élevé au cours des premières semaines de traitement, tant pour les sujets sous médicament que pour ceux sous placebo, et tend à diminuer au cours des semaines suivantes. L’origine possible de la perte de poids accrue due aux divers effets du médicament n’est pas établie. L’importance de la perte de poids associée à l’utilisation d’un médicament anorexigène varie d’un essai à l’autre, et la perte de poids accrue semble être liée en partie à des variables autres que le médicament prescrit, comme le médecin investigateur, la population traitée et le régime alimentaire prescrit. Les études ne permettent pas de conclure quant à l’importance relative du médicament et des facteurs non médicamenteux sur la perte de poids.
L’histoire naturelle de l’obésité se mesure en années, alors que les études citées se limitent à une durée de quelques semaines ; ainsi, l’impact total de la perte de poids induite par le médicament par rapport à celui du régime alimentaire seul doit être considéré comme cliniquement limité.
La principale voie d’élimination se fait par les reins où la plupart du médicament et des métabolites sont excrétés. Une partie du médicament est métabolisée en phenmetrazine et également en phendimetrazine-N-oxyde. La demi-vie moyenne d’élimination, lorsqu’elle est étudiée dans des conditions contrôlées, est d’environ 3,7 heures pour les formes à libération prolongée et à libération immédiate. La demi-vie d’absorption du médicament provenant des comprimés de phendimétrazine à libération immédiate de 35 mg est sensiblement plus rapide que le taux d’absorption du médicament provenant de la formulation à libération prolongée.
Indications et utilisation de Bontril
Bontril®PDM (tartrate de phendimétrazine) est indiqué dans la prise en charge de l’obésité exogène en tant qu’adjuvant à court terme (quelques semaines) dans un régime de réduction de poids basé sur la restriction calorique chez les patients ayant un indice de masse corporelle (IMC) initial de 30 kg/m2 ou plus qui n’ont pas répondu à un régime de réduction de poids approprié (régime et/ou exercice physique) seul. Vous trouverez ci-dessous un tableau de l’indice de masse corporelle (IMC) en fonction de différentes tailles et de différents poids. L’IMC est calculé en prenant le poids du patient, en kilogrammes (kg), divisé par la taille du patient, en mètres (m), au carré. Les conversions métriques sont les suivantes : livres ÷ 2,2 = kg ; pouces x 0,0254 = mètres.
| INDEX DE MASSE CORPORELLE (IMC), kg/m2 Taille (pieds, pouces) |
||||||
|---|---|---|---|---|---|---|
| Poids (livres) |
5’0″ | 5’3″ | 5’6″ | 5’9″ | 6’0″ | 6’3″ |
| 140 | 27 | 25 | 23 | 21 | 19 | 18 |
| 150 | 29 | 27 | 24 | 22 | 20 | 19 |
| 160 | 31 | 28 | 26 | 24 | 22 | 20 |
| 170 | 33 | 30 | 28 | 25 | 23 | 21 |
| 180 | 35 | 32 | 29 | 27 | 25 | 23 |
| 190 | 37 | 34 | 31 | 28 | 26 | 24 |
| 200 | 39 | 36 | 32 | 30 | 27 | 25 |
| 210 | 41 | 37 | 34 | 31 | 29 | 26 |
| 220 | 43 | 39 | 36 | 33 | 30 | 28 |
| 230 | 45 | 41 | 37 | 34 | 31 | 29 |
| 240 | 47 | 43 | 39 | 36 | 33 | 30 |
| 250 | 49 | 44 | 40 | 37 | 34 | 31 |
Le tartrate de phendimétrazine est indiqué en monothérapie uniquement.
Contre-indications
Réactions connues d’hypersensibilité ou idiosyncrasiques aux sympathomimétiques.
Artériosclérose avancée, maladie cardiovasculaire symptomatique, hypertension modérée et sévère, hyperthyroïdie et glaucome.
Patients très nerveux ou agités.
Patients ayant des antécédents de toxicomanie.
Patients prenant d’autres stimulants du SNC, y compris les inhibiteurs de la monoamine oxydase.
Avertissements
Le tartrate de phendimétrazine ne doit pas être utilisé en association avec d’autres agents anorexigènes, y compris les médicaments prescrits, les préparations en vente libre et les produits à base de plantes.
Dans une étude épidémiologique cas-témoins, l’utilisation d’agents anorexigènes, y compris le tartrate de phendimétrazine, a été associée à un risque accru de développer une hypertension pulmonaire, un trouble rare mais souvent fatal. L’utilisation d’agents anorexigènes pendant plus de trois mois était associée à un risque 23 fois plus élevé de développer une hypertension pulmonaire. Un risque accru d’hypertension pulmonaire lors de traitements répétés ne peut être exclu.
L’apparition ou l’aggravation d’une dyspnée d’effort, ou de symptômes inexpliqués d’angine de poitrine, de syncope ou d’œdème des membres inférieurs suggèrent la possibilité de survenue d’une hypertension pulmonaire. Dans ces circonstances, le tartrate de phendimétrazine doit être immédiatement interrompu et le patient doit être évalué pour la présence éventuelle d’une hypertension pulmonaire.
Une cardiopathie valvulaire associée à l’utilisation de certains agents anorexigènes tels que la fenfluramine et la dexfenfluramine a été rapportée. Les facteurs contributifs possibles incluent l’utilisation pendant des périodes prolongées, une dose plus élevée que celle recommandée, et/ou l’utilisation en association avec d’autres médicaments anorexigènes. Cependant, aucun cas de cette valvulopathie n’a été rapporté lorsque le tartrate de phendimétrazine a été utilisé seul.
Le risque potentiel d’effets indésirables graves possibles tels que la cardiopathie valvulaire et l’hypertension pulmonaire doit être évalué soigneusement par rapport au bénéfice potentiel de la perte de poids. Une évaluation cardiaque de base doit être envisagée pour détecter les cardiopathies valvulaires ou l’hypertension pulmonaire préexistantes avant l’initiation du traitement par la phendimétrazine. Le tartrate de phendimétrazine n’est pas recommandé chez les patients présentant un souffle cardiaque connu ou une cardiopathie valvulaire. Une échocardiographie pendant et après le traitement pourrait être utile pour détecter d’éventuels troubles valvulaires. Afin de limiter les expositions et les risques injustifiés, le traitement par le tartrate de phendimétrazine ne doit être poursuivi que si le patient présente une perte de poids satisfaisante au cours des 4 premières semaines de traitement (c’est-à-dire une perte de poids d’au moins 4 livres, ou selon la décision du médecin et du patient).
La tolérance à l’effet anorexigène de la phendimétrazine se développe en quelques semaines. Lorsque cela se produit, son utilisation doit être interrompue ; la dose maximale recommandée ne doit pas être dépassée.
L’utilisation du tartrate de phendimétrazine dans les 14 jours suivant l’administration d’inhibiteurs de la monoamine oxydase peut entraîner une crise hypertensive.
L’arrêt brutal de l’administration après un dosage élevé prolongé entraîne une fatigue extrême et une dépression. En raison de l’effet sur le système nerveux central, le tartrate de phendimétrazine peut altérer la capacité du patient à s’engager dans des activités potentiellement dangereuses telles que l’utilisation de machines ou la conduite d’un véhicule à moteur ; le patient doit donc être averti en conséquence.
Le tartrate de phendimétrazine n’est pas recommandé pour les patients ayant utilisé des agents anorexigènes au cours de l’année précédente.
Précautions
La prudence est de mise lors de la prescription de phendimétrazine chez les patients présentant une hypertension même légère.
Les besoins en insuline dans le diabète sucré peuvent être modifiés en association avec l’utilisation du tartrate de phendimétrazine et le régime alimentaire concomitant.
Le tartrate de phendimétrazine peut diminuer l’effet hypotenseur de la guanéthidine. La plus petite quantité réalisable doit être prescrite ou délivrée en une seule fois afin de minimiser la possibilité de surdosage.
Interactions médicamenteuses
L’efficacité du tartrate de phendimétrazine avec d’autres agents anorexigènes n’a pas été étudiée et l’utilisation combinée peut présenter un risque de problèmes cardiaques graves.
Carcinogenèse, mutagenèse, altération de la fertilité
Des études avec le tartrate de phendimétrazine n’ont pas été réalisées pour évaluer le potentiel cancérogène, le potentiel mutagène ou les effets sur la fertilité.
Prégantie
Catégorie de grossesse C
Des études de reproduction animale n’ont pas été réalisées avec le tartrate de phendimétrazine. On ne sait pas non plus si le tartrate de phendimétrazine peut causer des dommages au fœtus lorsqu’il est administré à une femme enceinte ou peut affecter la capacité de reproduction.
Utilisation pendant la grossesse
La sécurité d’emploi pendant la grossesse n’a pas été établie. Jusqu’à ce que davantage d’informations soient disponibles, le tartrate de phendimétrazine ne doit pas être pris par les femmes qui sont ou peuvent devenir enceintes, sauf si, de l’avis du médecin, les bénéfices potentiels l’emportent sur les dangers possibles.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Comme de nombreux médicaments sont excrétés dans le lait maternel, le tartrate de phendimétrazine ne doit pas être pris par les femmes qui allaitent, sauf si, de l’avis du médecin, les bénéfices potentiels l’emportent sur les dangers possibles.
Utilisation pédiatrique
La sécurité et l’efficacité chez les patients pédiatriques n’ont pas été établies.
Réactions indésirables
Cardiovasculaires : Palpitation, tachycardie, élévation de la pression artérielle, événements ischémiques.
Des cardiopathies valvulaires associées à l’utilisation de certains agents anorexigènes tels que la fenfluramine et la dexfenfluramine, à la fois indépendamment et surtout lorsqu’elles sont utilisées en association avec d’autres médicaments anorexigènes, ont été rapportées. Cependant, aucun cas de cette valvulopathie n’a été rapporté lorsque le tartrate de phendimétrazine a été utilisé seul.
Système nerveux central : Surstimulation, agitation, insomnie, agitation, bouffées vasomotrices, tremblements, transpiration, vertiges, céphalées, état psychotique, vision trouble.
Gastro-intestinal : Sécheresse de la bouche, nausées, diarrhée, constipation, douleurs d’estomac.
Génito-urinaire : Fréquence urinaire, dysurie, modifications de la libido.
Abus de drogues et dépendance
Substance contrôlée
Bontril® PDM (tartrate de phendimétrazine) est une substance contrôlée de l’annexe lll.
Dépendance
Le tartrate de phendimétrazine est lié chimiquement et pharmacologiquement aux amphétamines. Les amphétamines et les stimulants apparentés ont fait l’objet d’abus considérables, et la possibilité d’abus de phendimétrazine doit être gardée à l’esprit lors de l’évaluation de l’opportunité d’inclure un médicament dans le cadre d’un programme de réduction du poids. L’abus d’amphétamines et de drogues apparentées peut être associé à une dépendance psychologique intense et à un dysfonctionnement social grave. Il existe des rapports de patients qui ont augmenté la dose jusqu’à plusieurs fois celle recommandée. L’arrêt brutal après une administration prolongée de fortes doses entraîne une fatigue extrême et une dépression mentale ; des modifications sont également constatées sur l’EEG de sommeil. Les manifestations d’une intoxication chronique par des médicaments anorexigènes comprennent des dermatoses graves, une insomnie marquée, une irritabilité, une hyperactivité et des changements de personnalité. La manifestation la plus grave des intoxications chroniques est la psychose, souvent impossible à distinguer cliniquement de la schizophrénie.
Surdosage
Un surdosage aigu par le tartrate de phendimétrazine peut se manifester par les signes et symptômes suivants : agitation inhabituelle, confusion, belligérance, hallucinations et états de panique. La fatigue et la dépression suivent généralement la stimulation centrale. Les effets cardiovasculaires comprennent les arythmies, l’hypertension ou l’hypotension et le collapsus circulatoire. Les symptômes gastro-intestinaux comprennent les nausées, les vomissements, la diarrhée et les crampes abdominales. L’empoisonnement peut entraîner des convulsions, un coma et la mort.
La prise en charge du surdosage est largement symptomatique. Elle comprend une sédation avec un barbiturique. Si l’hypertension est marquée, l’utilisation d’un nitrate ou d’un alpha-bloquant d’action rapide doit être envisagée. L’expérience de l’hémodialyse ou de la dialyse péritonéale est insuffisante pour permettre des recommandations quant à son utilisation.
Dosage et administration du Pontril
Dosage habituel chez l’adulte
1 comprimé (35 mg) deux fois par jour ou trois fois par jour une heure avant les repas.
La posologie doit être individualisée afin d’obtenir une réponse adéquate avec la dose efficace la plus faible. Dans certains cas, ½ comprimé (17,5 mg) par dose peut être suffisant. La posologie ne doit pas dépasser 2 comprimés trois fois par jour.
Comment est présenté Bontril
Comprimé à trois couches vertes, blanches et jaunes avec « B 35 » sur la face sécable et la lettre « V » sur l’autre. Les comprimés Bontril® PDM contenant 35 mg de tartrate de phendimétrazine sont disponibles en flacons de 100 (NDC 0187-0497-01) et 1000 (NDC 0187-0497-02).
Conserver à 25°C (77°F) ; excursions autorisées entre 15°C et 30°C (59°F et 86°F).
Formulaire de commande de la DEA requis.
Distribué par :
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
Fabriqué par :
Mallinckrodt, Inc.
Hobart, NY 13788
Imprimé avec une encre de qualité alimentaire.
MG #20886
Rev. 10/07
Part No. L2BB01
Panneau d’affichage principal – Étiquette de flacon de comprimé de 35 mg
NDC 0187-0497-02
RX seulement
CIII
Bontril® PDM
(comprimés de tartrate de phendimétrazine, USP)
35 mg
Chaque comprimé à trois couches
vert, blanc et jaune
comprimé contient 35 mg
de phendimetrazine
tartrate
1000
Comprimés
VALEANT™
| Bontril PDM phendimetrazine tartrate comprimé |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Éditeur – Valeant Pharmaceuticals International (042230623)
| Etablissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| MALLINCKRODT INC | 957414238 | MANUFACTURE(0187-0497) | |
Plus d’informations sur Bontril Slow Release (phendimetrazine)
- Effets secondaires Effects
- During Pregnancy
- Dosage Information
- Drug Images
- Drug Interactions
- 35 Reviews
- Drug class : anorexigènes
Ressources pour les consommateurs
- Information pour les patients
- Bontril (Lecture avancée)
- Bontril à libération lente.Release (Advanced Reading)
Ressources professionnelles
- Informations posologiques
- Phendimétrazine (AHFS Monograph)
Autres marques Fendique ER
Guides de traitement associés
- Obésité
Avis médical
.