Chemguide : Support pour le CIE A level Chemistry
Résultat d’apprentissage 11.2(f)
Cet énoncé concerne les coefficients de partage.
Avant de continuer, vous devez trouver et lire l’énoncé dans votre copie du syllabus.
Partition
Si vous avez deux liquides non miscibles comme l’éther et l’eau, et que vous les agitez dans une ampoule à décanter, ils forment évidemment deux couches. L’éther est moins dense que l’eau, et forme donc la couche supérieure.
Supposons maintenant que vous agitez un mélange d’éther et d’eau contenant une substance qui est soluble dans les deux. Supposons que la substance, X, soit plus soluble dans l’éther que dans l’eau.
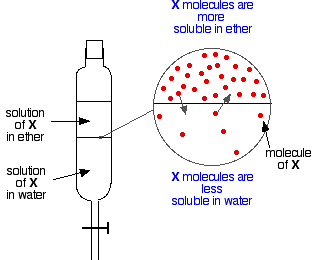
Des particules de X vont franchir la limite entre les deux couches liquides, et vous aurez bientôt un équilibre dynamique qui s’installe. Pour chaque particule qui se déplace dans la couche supérieure, une va redescendre dans la couche inférieure.
Vous pourriez écrire une équation pour cela :
![]()
![]()
…. . et comme tout autre équilibre, vous pouvez trouver une constante d’équilibre :
![]()
![]()
Cette constante d’équilibre est appelée coefficient de partage, et on lui donne souvent le symbole Kpc.
Comme les autres constantes d’équilibre, les coefficients de partage sont constants à une température constante, mais ils ont aussi quelques autres restrictions. Ils ne fonctionnent correctement que pour des solutions assez diluées, et le soluté doit être sous la même forme chimique dans les deux solvants. Il ne doit pas réagir, ni s’ioniser ou s’associer (se réunir en dimères, par exemple).
Calculs du coefficient de partage
Une note sur les unités
Notez que le coefficient de partage est un simple rapport de deux concentrations. Les unités de concentration que vous utilisez n’ont pas d’importance – tant que vous utilisez les mêmes en haut et en bas.
Vous pourriez utiliser mol dm-3, mais plus souvent vous utilisez g cm-3 – grammes par centimètre cube.
Techniquement, les crochets ne peuvent être utilisés que pour la concentration en mol dm-3, mais le livret d’aide à l’application et les schémas de notation de la CIE l’utilisent également pour les autres unités.
Je ne suis pas prêt à le faire, et j’utiliserai donc le terme « concentration de X » plutôt que lorsque des unités de concentration non standard sont utilisées.
Calcul d’un coefficient de partage
Lorsqu’une solution de 1,00 g de X dans 100 cm3 d’eau a été secouée avec 10 cm3 d’éther, 0,80 g de X a été transféré dans la couche d’éther. Calculez le coefficient de partage de X entre l’éther et l’eau.
Si on vous demande de calculer un coefficient de partage entre deux solvants, la concentration du premier solvant mentionné vient en tête de l’expression Kpc. Donc dans ce cas :
![]()
![]()
Vous avez suffisamment d’informations pour calculer les deux concentrations en g cm-3.
![]() concentration de X dans l’éther = 0,80/10 g cm-3
concentration de X dans l’éther = 0,80/10 g cm-3
Si 0,80 g étaient transférés dans l’éther, 1,00 – 0,80 g = 0.20 g sont restés dans l’eau.
![]() concentration de X dans l’eau = 0,20/100 g cm-3
concentration de X dans l’eau = 0,20/100 g cm-3
So:
![]()
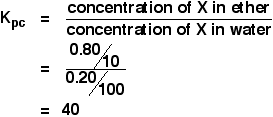
Evidemment, vous pourriez calculer les concentrations dans l’éther et dans l’eau comme des nombres réels avant de les mettre dans l’expression. Faites-le comme vous vous sentez le plus à l’aise.
Les coefficients de partage comme celui-ci n’ont pas d’unités – les unités s’annulent parce qu’elles sont les mêmes en haut et en bas.
Calculs impliquant des coefficients de partage
Le syllabus du CIE dit spécifiquement que vous devriez être capable de calculer un coefficient de partage (en d’autres termes, ce que nous venons de faire). Il ne dit absolument rien sur le fait de les utiliser pour calculer d’autres choses. Ces calculs supplémentaires sont discutés dans le livret de soutien à l’application et ont été demandés deux fois dans les examens jusqu’en juin 2013 (les deux fois en 2009).
Le manuel de cours ne les inclut pas (tout à fait correctement !) parce que le syllabus ne les mentionne pas, et ce livre a été approuvé par les examinateurs de la CIE comme une « couverture complète et précise » du syllabus. Cela signifie-t-il que le CIE ne posera plus de questions à l’avenir ? N’y comptez pas !
Un exemple de base
Nous allons utiliser le même cas que précédemment – les mêmes solvants, le même X et le même coefficient de partage que nous venons de calculer.
Cette fois, nous allons travailler sur la quantité qui aurait été extraite dans la couche d’éther si nous avions agité la solution originale de 1,00 g de X dans 100 cm3 d’eau avec seulement 5 cm3 d’éther.
Nous essayons de travailler sur la masse de X extraite. Appelons cela m.
Maintenant travaillez une expression pour la concentration de la solution de X dans l’éther.
![]() concentration de X dans l’éther = m/5 g cm-3
concentration de X dans l’éther = m/5 g cm-3
Qu’en est-il de l’eau ? Il restera (1,00 – m) g de X dans l’eau. Donc :
![]() concentration de X dans l’eau = (1,00 – m)/100 g cm-3
concentration de X dans l’eau = (1,00 – m)/100 g cm-3
Maintenant vous pouvez mettre tout cela dans l’expression du coefficient de partage. Rappelez-vous que nous avons déjà calculé le coefficient de partage de X entre l’éther et l’eau comme étant de 40.
![]()
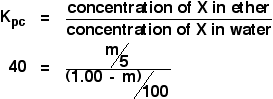
Vous êtes alors juste confrontés à un simple, mais légèrement fastidieux, morceau d’algèbre:
![]()
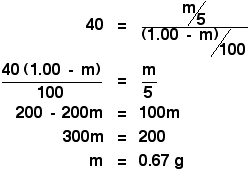
Plus fastidieux !
Dans le calcul original pour trouver le coefficient de partage, on vous a dit que si vous secouiez la solution originale de 1,00 g de X dans 100 cm3 d’eau avec 10 cm3 d’éther, vous extrayez 0,80 g de X.
En la secouant avec 5 cm3 d’éther, nous venons de calculer que vous extrairiez 0,67 g de X.
Ce qui laisserait 0,33 g de X derrière dans les 100 cm3 d’eau. Supposons que vous ayez soigneusement conservé cette solution, puis que vous l’ayez secouée avec un deuxième 5 cm3 frais d’éther.
Quelle quantité de X extrairiez-vous au total en utilisant l’éther en deux lots séparés de 5 cm3 au lieu des 10 cm3 en une seule fois ?
Appelons la masse de X extraite par le deuxième lot d’éther n – pour ne pas être confus.
Travaillez une expression pour la concentration de la solution de X dans l’éther.
![]() concentration de X dans l’éther = n/5 g cm-3
concentration de X dans l’éther = n/5 g cm-3
Qu’en est-il de l’eau ? Il restera (0,33 – n) g de X dans l’eau après la deuxième extraction. Donc :
![]() concentration de X dans l’eau = (0,33 – n)/100 g cm-3
concentration de X dans l’eau = (0,33 – n)/100 g cm-3
Maintenant vous pouvez mettre tout cela dans l’expression du coefficient de partage de X entre l’éther et l’eau comme précédemment.
![]()

Cela signifie que si vous deviez combiner les deux lots de 5 cm3 d’éther, vous auriez extrait un total de 0,67 + 0,22 g de X, soit 0.89 g.
On vous a dit à l’origine que si vous n’aviez fait cela qu’une seule fois, en utilisant l’éther comme un seul lot de 10 cm3, vous n’auriez extrait que 0,80 g.
Vous obtenez une extraction plus efficace en divisant votre solvant en plus petits volumes comme ci-dessus.
Vous utilisez ce genre de technique lors de la préparation de certains composés organiques. Vous extrayez ce que vous essayez de faire d’une solution désordonnée dans l’eau pour qu’elle se retrouve dans un solvant organique. Vous éliminez ensuite le solvant par une distillation prudente.
L’ECI a posé une question similaire à celle-ci dans l’épreuve 4 Q8 de juin 2009. Vous deviez calculer une valeur pour le coefficient de partage, et ensuite l’utiliser dans une extraction en deux étapes exactement comme ci-dessus. Le calcul valait 4 points. Cela peut être fastidieux et (à part le calcul du coefficient de partage) ne fait pas partie du programme, mais vous ne pouvez pas vous permettre de ne pas être capable de le faire.