Objectifs d’apprentissage
- Utiliser la notation des cellules pour décrire les cellules galvaniques
- Décrire les composants de base des cellules galvaniques
Les cellules galvaniques, également appelées cellules voltaïques, sont des cellules électrochimiques dans lesquelles les réactions spontanées d’oxydoréduction produisent de l’énergie électrique. Lors de l’écriture des équations, il est souvent pratique de séparer les réactions d’oxydation-réduction en demi-réactions pour faciliter l’équilibrage de l’équation globale et mettre en évidence les transformations chimiques réelles.
Considérez ce qui se passe lorsqu’un morceau de cuivre métallique propre est placé dans une solution de nitrate d’argent (figure 1). Dès que le cuivre métallique est ajouté, l’argent métallique commence à se former et les ions cuivre passent dans la solution. La couleur bleue de la solution à l’extrême droite indique la présence d’ions cuivre. La réaction peut être divisée en ses deux demi-réactions. Les demi-réactions séparent l’oxydation de la réduction, ainsi chacune peut être considérée individuellement.
L’équation de la demi-réaction de réduction devait être doublée pour que le nombre d’électrons « gagnés » dans la demi-réaction de réduction soit égal au nombre d’électrons « perdus » dans la demi-réaction d’oxydation.

Les cellules galvaniques ou voltaïques impliquent des réactions électrochimiques spontanées dans lesquelles les demi-réactions sont séparées (figure 2) afin que le courant puisse circuler dans un fil externe. Le bécher à gauche de la figure est appelé une demi-cellule et contient une solution 1 M de nitrate de cuivre (II) avec un morceau de cuivre métallique partiellement immergé dans la solution. Le cuivre métallique est une électrode. Le cuivre subit une oxydation ; par conséquent, l’électrode de cuivre est l’anode. L’anode est reliée à un voltmètre par un fil et l’autre borne du voltmètre est reliée à une électrode en argent par un fil. L’argent subit une réduction ; l’électrode d’argent est donc la cathode. La demi-cellule sur le côté droit de la figure est constituée de l’électrode d’argent dans une solution 1 M de nitrate d’argent (AgNO3). À ce stade, aucun courant ne circule, c’est-à-dire qu’il n’y a pas de mouvement significatif d’électrons dans le fil, car le circuit est ouvert. Le circuit est fermé à l’aide d’un pont salin, qui transmet le courant avec des ions en mouvement. Le pont salin est constitué d’une solution électrolytique concentrée et non réactive, telle que la solution de nitrate de sodium (NaNO3) utilisée dans cet exemple. Lorsque les électrons circulent de gauche à droite à travers l’électrode et le fil, les ions nitrate (anions) passent à travers le bouchon poreux de gauche dans la solution de nitrate de cuivre(II). Cela maintient le bécher de gauche électriquement neutre en neutralisant la charge des ions de cuivre(II) qui sont produits dans la solution lorsque le cuivre métallique est oxydé. En même temps que les ions nitrate se déplacent vers la gauche, les ions sodium (cations) se déplacent vers la droite, à travers le bouchon poreux, et dans la solution de nitrate d’argent à droite. Ces cations ajoutés « remplacent » les ions argent qui sont retirés de la solution lors de leur réduction en argent métallique, ce qui maintient le bécher de droite électriquement neutre. Sans le pont salin, les compartiments ne resteraient pas électriquement neutres et aucun courant significatif ne circulerait. Cependant, si les deux compartiments sont en contact direct, un pont salin n’est pas nécessaire. Au moment où le circuit est terminé, le voltmètre indique +0,46 V, c’est ce qu’on appelle le potentiel de la cellule. Le potentiel de la cellule est créé lorsque les deux métaux dissemblables sont connectés, et constitue une mesure de l’énergie par unité de charge disponible à partir de la réaction d’oxydation-réduction. Le volt est l’unité SI dérivée du potentiel électrique
Dans cette équation, A est le courant en ampères et C la charge en coulombs. Notez que les volts doivent être multipliés par la charge en coulombs (C) pour obtenir l’énergie en joules (J).
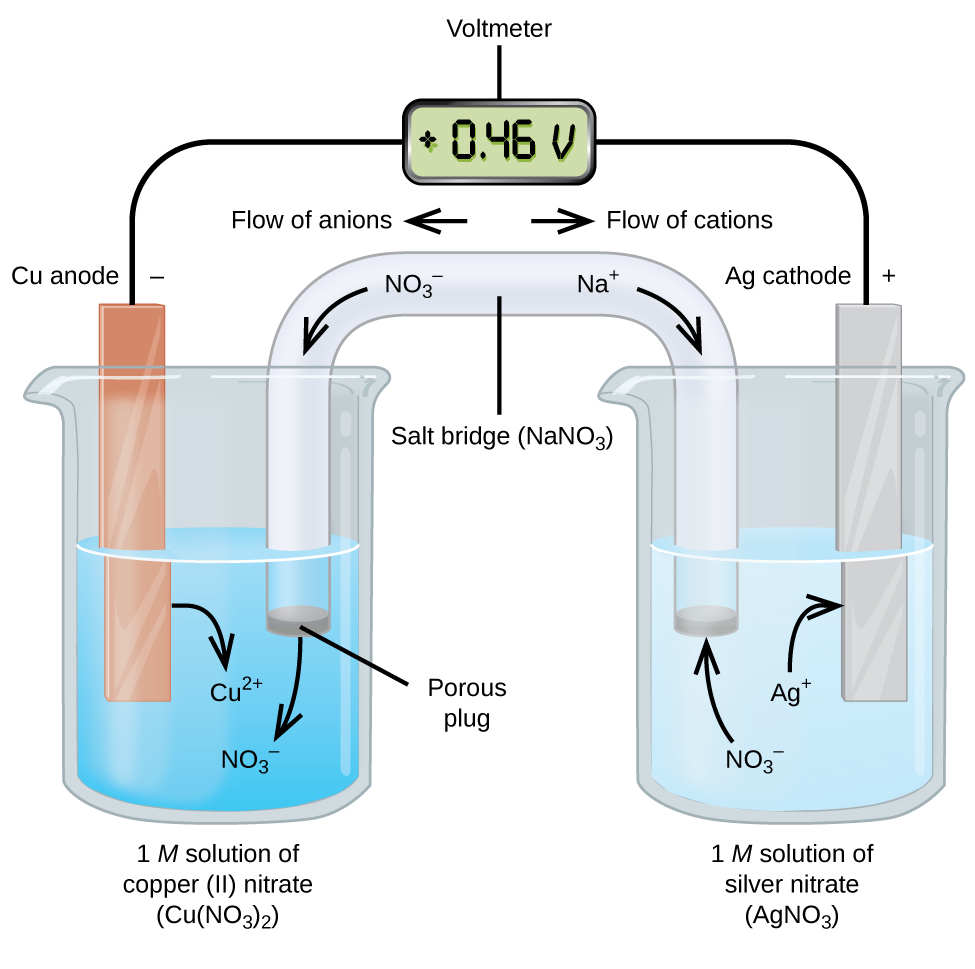
Lorsque la cellule électrochimique est construite de cette façon, un potentiel de cellule positif indique une réaction spontanée et que les électrons circulent de gauche à droite. Il se passe beaucoup de choses dans la figure 2, il est donc utile de résumer les choses pour ce système :
- Les électrons circulent de l’anode vers la cathode : de gauche à droite dans la cellule galvanique standard de la figure.
- L’électrode dans la demi-cellule de gauche est l’anode parce que l’oxydation se produit ici. Le nom fait référence au flux d’anions dans le pont salin vers elle.
- L’électrode dans la demi-cellule de droite est la cathode parce que la réduction se produit ici. Le nom fait référence au flux de cations dans le pont salin vers elle.
- L’oxydation se produit à l’anode (la demi-cellule de gauche dans la figure).
- La réduction se produit à la cathode (la demi-cellule de droite dans la figure).
- Le potentiel de la cellule, +0.46 V, dans ce cas, résulte des différences inhérentes à la nature des matériaux utilisés pour fabriquer les deux demi-cellules.
- Le pont salin doit être présent pour fermer (compléter) le circuit et une oxydation et une réduction doivent se produire pour que le courant circule.
Il existe de nombreuses cellules galvaniques possibles, c’est pourquoi une notation abrégée est généralement utilisée pour les décrire. La notation de la cellule (parfois appelée diagramme de cellule) fournit des informations sur les différentes espèces impliquées dans la réaction. Cette notation fonctionne également pour d’autres types de cellules. Une ligne verticale, │, désigne une frontière de phase et une double ligne, ‖, le pont salin. Les informations concernant l’anode sont écrites à gauche, suivies de la solution anodique, puis du pont salin (lorsqu’il est présent), puis de la solution cathodique et, enfin, des informations concernant la cathode à droite. La notation de la cellule galvanique de la figure 2 est donc
Notez que les ions spectateurs ne sont pas inclus et que la forme la plus simple de chaque demi-réaction a été utilisée. Lorsqu’elles sont connues, les concentrations initiales des différents ions sont généralement incluses.
L’une des piles les plus simples est la pile de Daniell. Il est possible de construire cette pile en plaçant une électrode de cuivre au fond d’un bocal et en recouvrant le métal d’une solution de sulfate de cuivre. On fait flotter une solution de sulfate de zinc sur la solution de sulfate de cuivre, puis on place une électrode de zinc dans la solution de sulfate de zinc. En connectant l’électrode de cuivre à l’électrode de zinc, on fait circuler un courant électrique. C’est un exemple de cellule sans pont salin, et les ions peuvent circuler à travers l’interface entre les deux solutions.
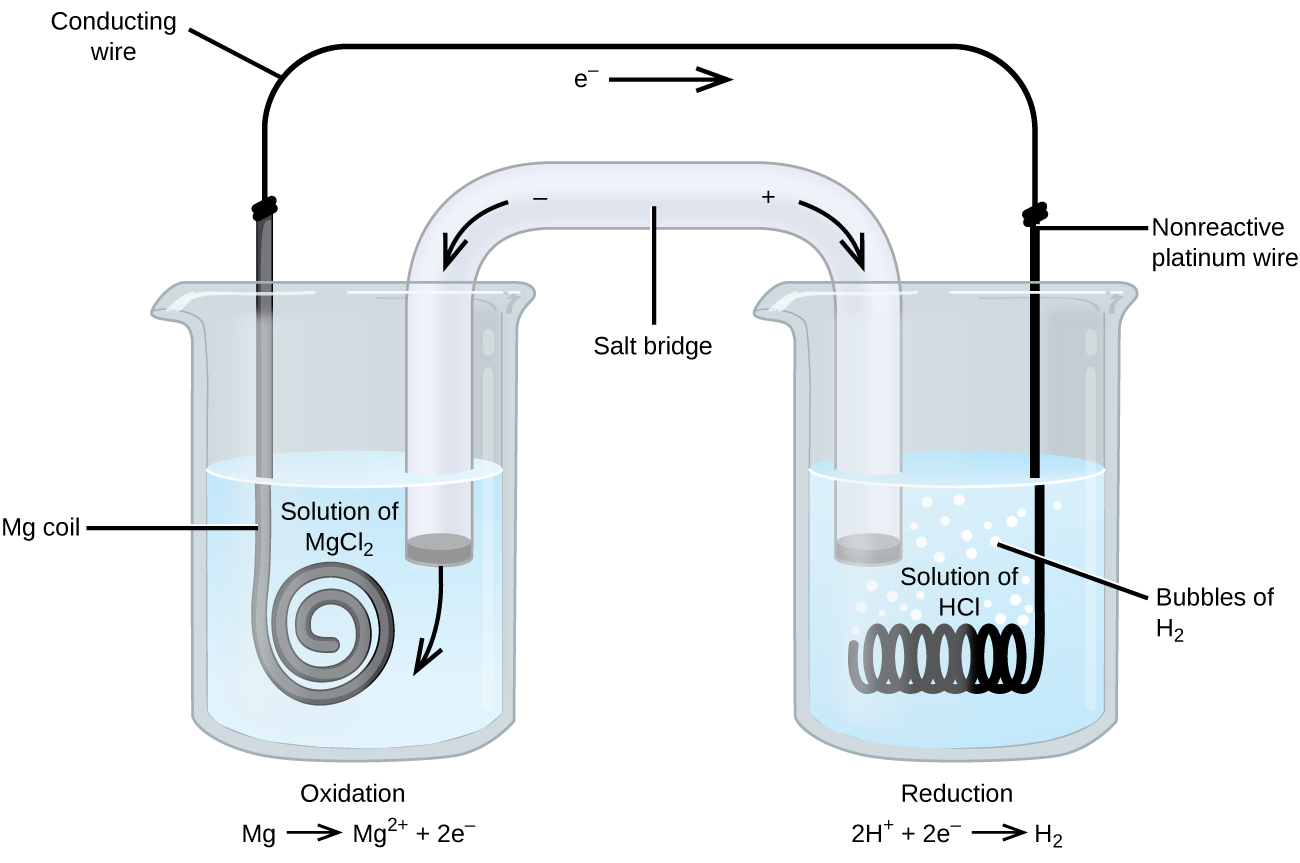
Certaines réactions d’oxydoréduction impliquent des espèces qui sont de mauvais conducteurs d’électricité, et on utilise donc une électrode qui ne participe pas aux réactions. On utilise donc une électrode qui ne participe pas aux réactions. Souvent, l’électrode est en platine, en or ou en graphite, qui sont tous inertes à de nombreuses réactions chimiques. Un tel système est illustré à la figure 3. Le magnésium subit une oxydation à l’anode située à gauche de la figure et les ions hydrogène subissent une réduction à la cathode située à droite. La réaction peut être résumée comme suit
La cellule utilise un fil de platine inerte pour la cathode, la notation de la cellule est donc
L’électrode de magnésium est une électrode active car elle participe à la réaction d’oxydoréduction. Les électrodes inertes, comme l’électrode de platine de la figure 3, ne participent pas à la réaction d’oxydoréduction et sont présentes pour que le courant puisse circuler dans la cellule. Le platine ou l’or font généralement de bonnes électrodes inertes car ils sont chimiquement non réactifs.
Exemple 1
Utiliser la notation de la cellule
Considérons une cellule galvanique constituée de
Ecrivez les demi-réactions d’oxydation et de réduction et écrivez la réaction en utilisant la notation de la cellule. Quelle réaction se produit à l’anode ? La cathode ?
Solution
Par inspection, Cr est oxydé lorsque trois électrons sont perdus pour former Cr3+, et Cu2+ est réduit lorsqu’il gagne deux électrons pour former Cu. En équilibrant la charge, on obtient
La notation des cellules utilise la forme la plus simple de chacune des équations, et commence par la réaction à l’anode. Aucune concentration n’a été spécifiée ainsi : \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). L’oxydation se produit à l’anode et la réduction à la cathode.
Utilisation de la notation des cellules
Considérons une cellule galvanique constituée de
Ecrivez les demi-réactions d’oxydation et de réduction et écrivez la réaction en utilisant la notation de la cellule. Quelle réaction se produit à l’anode ? La cathode ?
Solution
Par inspection, Fe2+ subit une oxydation quand un électron est perdu pour former Fe3+, et MnO4- est réduit quand il gagne cinq électrons pour former Mn2+. En équilibrant la charge, on obtient
La notation en cellule utilise la forme la plus simple de chacune des équations, et commence par la réaction à l’anode. Il est nécessaire d’utiliser une électrode inerte, comme le platine, car aucun métal n’est présent pour conduire les électrons de l’anode à la cathode. Aucune concentration n’a été spécifiée ainsi : \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). L’oxydation se produit à l’anode et la réduction à la cathode.
Vérifiez votre apprentissage
Utilisez la notation de la cellule pour décrire la cellule galvanique où les ions cuivre (II) sont réduits en cuivre métallique et le zinc métallique est oxydé en ions zinc.
Réponse:
D’après les informations données dans le problème:
\begin{array}{lr @{}\long flèche droite{}} l} \text{anode\ ;(oxydation):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \\N- \N – (réduction):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & & \text{Cu}(s) \\\N- \Nhline \N \N \N – \N – \N – \N dans l’ensemble:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
En utilisant la notation des cellules :
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Les cellules électrochimiques sont généralement constituées de deux demi-cellules. Les demi-cellules séparent la demi-réaction d’oxydation de la demi-réaction de réduction et rendent possible le passage du courant dans un fil externe. L’une des demi-cellules, normalement représentée sur le côté gauche d’une figure, contient l’anode. L’oxydation se produit à l’anode. L’anode est reliée à la cathode dans l’autre demi-cellule, souvent représentée sur le côté droit dans une figure. La réduction se produit à la cathode. L’ajout d’un pont salin complète le circuit et permet au courant de circuler. Les anions dans le pont salin s’écoulent vers l’anode et les cations dans le pont salin s’écoulent vers la cathode. Le mouvement de ces ions complète le circuit et maintient chaque demi-cellule électriquement neutre. Les cellules électrochimiques peuvent être décrites à l’aide de la notation des cellules. Dans cette notation, les informations concernant la réaction à l’anode apparaissent à gauche et celles concernant la réaction à la cathode à droite. Le pont salin est représenté par une double ligne, ‖. Les phases solide, liquide ou aqueuse au sein d’une demi-cellule sont séparées par une seule ligne, │. La phase et la concentration des différentes espèces sont incluses après le nom de l’espèce. Les électrodes qui participent à la réaction d’oxydoréduction sont appelées électrodes actives. Les électrodes qui ne participent pas à la réaction d’oxydoréduction mais qui sont là pour permettre au courant de circuler sont des électrodes inertes. Les électrodes inertes sont souvent fabriquées à partir de platine ou d’or, qui sont inchangés par de nombreuses réactions chimiques.
Chemistry End of Chapter Exercices
- Ecrivez les réactions équilibrées suivantes en utilisant la notation des cellules. Utilisez le platine comme électrode inerte, si nécessaire.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- Selon les notations des cellules suivantes, déterminer l’espèce oxydée, l’espèce réduite, l’agent oxydant et l’agent réducteur, sans écrire les réactions équilibrées.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- Pour les notations des cellules du problème précédent, écrivez les réactions équilibrées correspondantes.
- Equilibrez les réactions suivantes et écrivez les réactions en utilisant la notation des cellules. Ignorez toutes les électrodes inertes, car elles ne font jamais partie des demi-réactions.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(basic\;solution)}
- Identifiez l’espèce oxydée, l’espèce réduite, ainsi que l’agent oxydant et l’agent réducteur pour toutes les réactions du problème précédent.
- D’après les informations fournies, utilisez la notation des cellules pour décrire les systèmes suivants :
(a) Dans une demi-cellule, une solution de Pt(NO3)2 forme du Pt métal, tandis que dans l’autre demi-cellule, le Cu métal va dans une solution de Cu(NO3)2 avec toutes les concentrations de solutés 1 M.
(b) La cathode consiste en une électrode d’or dans une solution de 0,55 M Au(NO3)3 et l’anode est une électrode de magnésium dans 0.75 M de solution de Mg(NO3)2.
(c) Une demi-cellule est constituée d’une électrode d’argent dans une solution de AgNO3 1 M, et dans l’autre demi-cellule, une électrode de cuivre dans 1 M de Cu(NO3)2 est oxydée.
- Pourquoi un pont salin est-il nécessaire dans les cellules galvaniques comme celle de la figure 2 ?
- On a constaté qu’une électrode (métallique) active perdait de la masse lorsqu’on laissait la réaction d’oxydoréduction se dérouler. L’électrode faisait-elle partie de l’anode ou de la cathode ? Expliquez.
- Les électrodes actives participent à la réaction d’oxydoréduction. Comme les métaux forment des cations, l’électrode perdrait de la masse si les atomes métalliques qui la composent s’oxydaient et passaient en solution. L’oxydation se produit à l’anode.
- La masse de trois électrodes métalliques différentes, provenant chacune d’une cellule galvanique différente, a été déterminée avant et après que le courant généré par la réaction d’oxydoréduction dans chaque cellule ait pu circuler pendant quelques minutes. La première électrode métallique, appelée A, a vu sa masse augmenter ; la deuxième électrode métallique, appelée B, n’a pas changé de masse ; et la troisième électrode métallique, appelée C, a perdu de la masse. Faites une supposition éclairée pour savoir quelles électrodes étaient actives et quelles électrodes étaient inertes, et quelles étaient la ou les anodes et la ou les cathodes.
Glossary
électrode active électrode qui participe à la réaction d’oxydoréduction d’une cellule électrochimique ; la masse d’une électrode active change au cours de la réaction d’oxydoréduction électrode anode dans une cellule électrochimique au niveau de laquelle se produit l’oxydation ; les informations sur l’anode sont enregistrées sur le côté gauche du pont salin dans la notation de la cellule l’électrode cathodique dans une cellule électrochimique où se produit une réduction ; les informations sur la cathode sont enregistrées sur le côté droit du pont salin dans la notation de la cellule la notation de la cellule est une façon abrégée de représenter les réactions dans une cellule électrochimique la différence de potentiel électrique qui se produit lorsque des métaux dissemblables sont connectés ; force motrice pour le flux de charge (courant) dans les réactions d’oxydoréduction cellule galvanique cellule électrochimique qui implique une réaction spontanée d’oxydoréduction ; cellules électrochimiques avec des potentiels de cellule positifs ; également appelée cellule voltaïque électrode inerte électrode qui permet au courant de circuler, mais qui ne participe pas autrement à la réaction d’oxydoréduction dans une cellule électrochimique ; la masse d’une électrode inerte ne change pas pendant la réaction d’oxydoréduction ; les électrodes inertes sont souvent faites de platine ou d’or parce que ces métaux ne sont pas chimiquement réactifs. cellule voltaïque autre nom pour une cellule galvanique
Solutions
Réponses aux exercices de fin de chapitre de chimie
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Espèce oxydée = agent réducteur : (a) Al(s) ; (b) NO(g) ; (c) Mg(s) ; et (d) MnO2(s) ; Espèce réduite = agent oxydant : (a) Zr4+(aq) ; (b) Ag+(aq) ; (c) \text{SiO}_3^{\;\;2-}(aq) ; et (d) \text{ClO}_3^{\;\;-}(aq)
7. Sans le pont salin, le circuit serait ouvert (ou rompu) et aucun courant ne pourrait circuler. Avec un pont salin, chaque demi-cellule reste électriquement neutre et le courant peut circuler dans le circuit.
9. On a constaté qu’une électrode (métallique) active prenait de la masse lorsqu’on laissait la réaction d’oxydoréduction se dérouler. L’électrode faisait-elle partie de l’anode ou de la cathode ? Expliquez.