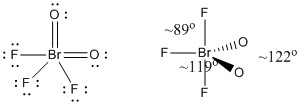Chimie inorganique intermédiaire
Université de Rhode Island
Automne 2013
Examen 1
1. Écrivez la configuration électronique (en utilisant la notation des gaz rares pour les coquilles fermées) et le symbole du terme de l’état fondamental pour les éléments suivants : a) Sc ; b) Sc+ ; c) Sc2+ ; d) Sc3+ ; e) Sc-.
a) Sc
4s23d1
Seul l’électron 3d contribue au symbole du terme : L = 2 et S = ½ donnant 2D
b) Sc+
3d2
L = 3 et S = 1 donnant 3F
c) Sc2+
3d1
L = 2 et S = ½ donnant . 2D
d) Sc3+
L = 0 et S = 0 donnant 1S
d) Sc-
4s23d2
L = 3 et S = 1 donnant 3F
2. Ecrivez la structure de Lewis, donnez les charges formelles sur tous les atomes, prédisez la géométrie moléculaire, l’estimation de tous les angles de liaison, et donnez l’orbitale hybride probable pour ce qui suit : a) BrO2- ; b) BrO3- ; c) BrO2F3.
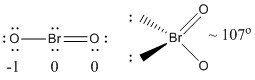
a) BrO2-
Structure de Lewis :
Les charges formelles sont données sur la structure de Lewis
Structure : plan coudé avec un angle de liaison de ~107°
Orbitale hybride sur Br : sp3
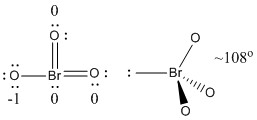
b) BrO3-
Structure de Lewis :
Les charges formelles sont données sur la structure de Lewis
Structure : pyramidale avec angles de liaison O-Br-O ~108°
Orbitale hybride sur Br : sp3
c) BrO2F3
Structure de Lewis :
Les charges formelles sont données sur la structure de Lewis
Structure : bipyramidale trigonale avec les angles de liaison indiqués sur la figure
Orbitale hybride sur Br : dsp3
3. La dureté absolue d’un atome est définie comme η = ½(IP – EA), IP est le potentiel d’ionisation et EA est l’affinité électronique. Prédisez les tendances périodiques de η et fournissez un raisonnement pour votre prédiction.
Pour presque tous les atomes, IP >> EA, donc η suivra les tendances périodiques de IP : augmentation au fur et à mesure que l’on se déplace vers la droite sur le tableau périodique (en suivant Z*) et légère diminution au fur et à mesure que l’on se déplace vers le bas du tableau périodique lorsque le rayon atomique augmente.
4. Cr2 a une configuration électronique de σ2π4δ4δ*2. Quel est l’ordre des liaisons et combien de spins non appariés sont prévus ? Vous attendriez-vous à ce que Cr2 absorbe la lumière dans la région visible du spectre ? Pourquoi ou pourquoi pas?
L’ordre de liaison = ½(2 + 4 + 4 – 2) = 4 avec 2 spins non appariés (puisqu’il y a 2 orbitales δ, il doit aussi y avoir 2 orbitales δ*, qui ont chacune un électron selon les règles de Hund). Le chevauchement côte à côte des orbitales d pour former des orbitales δ est faible, de sorte que le fractionnement entre les orbitales δ et δ* sera faible. Cela suggère que l’énergie nécessaire pour déplacer un électron de l’HOMO à la LUMO est également faible, ce qui prédit une absorption dans la partie visible du spectre.