Au plus simple, une cellule électrochimique est constituée de deux conducteurs d’électrons séparés par un conducteur ionique et reliés par un conducteur d’électrons.
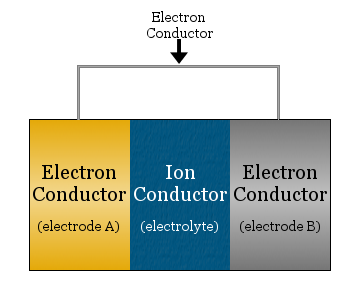
- Le conducteur ionique est appelé l’électrolyte
- Les conducteurs d’électrons séparés par l’électrolyte sont appelés électrodes
- Le conducteur d’électrons utilisé pour relier les électrodes est souvent un fil métallique, comme un câblage en cuivre
Deux types de cellule
Il existe deux types fondamentaux de cellule électrochimique : galvanique et électrolytique.
La conversion d’énergie est réalisée par des réactions d’oxydoréduction spontanées (ΔG < 0) produisant un flux d’électrons.
Un flux d’électrons entraîne des réactions d’oxydoréduction non spontanées (ΔG ≥ 0).
Exemples
- Une batterie alimentant quelque chose est un exemple de cellule galvanique.
- Les piles rechargeables sont des exemples des deux types de pile : elles fonctionnent comme des piles galvaniques lorsqu’elles alimentent un appareil et comme des piles électrolytiques lorsqu’elles sont rechargées.
- Les exemples de piles électrolytiques comprennent également celles utilisées pour séparer l’eau en hydrogène et en oxygène, et celles qui transforment le minerai d’aluminium en aluminium métal.
Une source de données thermodynamiques
En plus des utilisations pratiques, telles que celles décrites ci-dessus, les cellules électrochimiques constituent un excellent moyen de recueillir des données thermodynamiques.Par exemple, elles permettent de déterminer des potentiels d’oxydoréduction standard, à partir desquels les données d’enthalpie standard, d’entropie standard et d’énergie libre de Gibbs standard pour les réactions peuvent être obtenues de manière pratique.
Séparation des réactions
Les cellules électrochimiques peuvent :
- fournir de l’électricité, ou
- convertir des minerais métalliques en métal, ou
- fournir des données thermodynamiques,
car les réactions d’oxydoréduction ont lieu séparément.
Exemple : La cellule Daniell
Dans les cellules électrochimiques, les réactions ont lieu à des électrodes séparées – et d’ailleurs les électrodes elles-mêmes peuvent être placées dans des récipients différents.Considérons l’une des premières cellules galvaniques, la cellule Daniell.
La source d’énergie de la cellule de Daniell est la réaction spontanée du zinc métallique avec le sulfate de cuivre pour produire du sulfate de zinc et du cuivre métallique.
ΔG° = -212.6 kJ mol-1
Lorsque les matériaux sont mis en contact :
- en contact direct dans un récipient, l’énergie potentielle chimique est convertie en énergie thermique et le récipient de réaction se réchauffe
- dans une cellule électrochimique, l’énergie potentielle chimique est convertie en énergie électrique
La cellule de Daniell
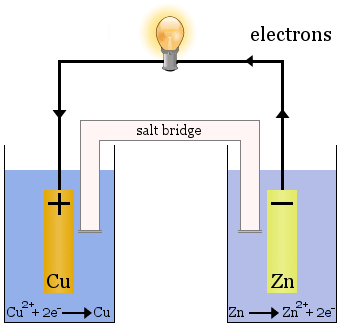
La cellule de Daniell est composée de deux demi-cellules : les ions cuivre sont réduits dans l’une et le zinc est oxydé dans l’autre.
Lorsque la cellule fonctionne, Cu2+ est retiré d’une cellule et Zn2+ est produit dans l’autre cellule.L’électrode de cuivre commence à croître car elle est plaquée avec du cuivre métallique fraîchement déposé, et l’électrode de zinc commence à diminuer en raison de la perte de zinc sous forme d’ions dans la solution.
Le pont salin dans le cas ci-dessus est un tube de verre rempli de solution saturée de KNO3.Il a des frittes aux extrémités qui empêchent le mélange des solutions dans chacune des demi-cellules, mais il permet aux ions de passer pour compléter le circuit électrique et maintenir chaque demi-cellule électriquement neutre.
La force motrice est la même ΔG° = -212.6 kJ mol-1 qui est obtenue lorsqu’on mélange simplement les réactifs dans un seul récipient;en séparant les deux demi-réactions, les électrons doivent voyager à travers le fil et nous pouvons utiliser l’énergie électrique.

.