- Article de synthèse
- Fistule entéro-cutanée : Gestion fondée sur des preuves
- Abstract
- Introduction
- Tableau 1
- Tableau 1 : Classification.
- Tableau 2
- Tableau 2 : Variables pronostiques de l’ECF.
- Classification
- Facteurs pronostiques de l’ECF
- Diagnostic
- Figure 1
- Gestion
- Réanimation
- Contrôle de la source
- Gestion de l’effluent
- Soins des plaies
- Tableau 3
- Tableau 3 : Délai de prise en charge définitive.
- Nutrition
- Conclusion
Article de synthèse
Fistule entéro-cutanée : Gestion fondée sur des preuves
Ryan P Dumas1*, Sarah A Moore1 et Carrie A Sims2
1Département de traumatologie, soins critiques chirurgicaux &chirurgie d’urgence, Perelman School of Medicine de l’Université de Pennsylvanie, Philadelphie, PA, USA
2Département de chirurgie, Division de traumatologie, soins chirurgicaux critiques &chirurgie d’urgence, Perelman School of Medicine at the University of Pennsylvania, Philadelphie, PA, USA
*Auteur correspondant : Ryan P Dumas, Département de traumatologie, Soins critiques chirurgicaux& Chirurgie d’urgence, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphie, PA 19104,USA
Abstract
La gestion de la fistule entéro-cutanée (FEC) est une compétence clinique qui devrait faire partie de l’arsenal de chaque chirurgien général. Bien que le traitement définitif repose souvent sur la fermeture chirurgicale, les soins préopératoires et la diligence sont primordiaux pour assurer un résultat positif. Le traitement de ces patients doit se concentrer sur quatre phases clés. La première phase est caractérisée par une reconnaissance et une réanimation appropriées. Au cours de la deuxième phase, une évaluation et un plan nutritionnels complets sont entrepris. L’évaluation radiographique au cours de la troisième phase permet de définir l’anatomie de l’ECF. Enfin, la quatrième phase est caractérisée par la fermeture définitive si la fistule ne guérit pas spontanément.Cette revue se concentrera sur les aspects clés qui définissent chaque phase et aideront le chirurgien général à maximiser les chances d’un résultat positif.
Introduction
Le développement d’une fistule entéro-cutanée (FEC), définie comme une connexion anormale entre la lumière intestinale et la peau externe, est une source importante de morbidité et de mortalité malgré les progrès des soins chirurgicaux et médicaux. L’incidence globale de l’ECF est cependant inconnue, la majorité des données concernant l’ECF provenant de grandes séries rétrospectives institutionnelles ou de séries spécifiques à un chirurgien. Il est remarquable de constater que seulement 25 % des ECF sont secondaires à une maladie inflammatoire de l’intestin, à une pathologie diverticulaire, à un traumatisme, à une irradiation ou à une tumeur maligne. En revanche, près de 75 % de toutes les FEC sont le résultat direct d’une chirurgie laparoscopique ou ouverte, une fuite astomotique consécutive à une éventrectomie étant responsable de plus de 50 % de ces fistules. Les blessures iatrogènes accidentelles telles que les entérotomies ou les blessures thermiques non reconnues subies au cours d’une opération sont responsables des fistules restantes. L’ECF étant le plus souvent un problème créé par le chirurgien, la responsabilité de la prévention, de la gestion appropriée, de la planification et du traitement définitif incombe à juste titre au chirurgien.
La morbidité et la mortalité après une ECF sont extrêmement élevées. On estime que 90 % des patients connaîtront une morbidité liée à l’ECF, allant de l’excoriation cutanée à la déshydratation, en passant par la septicémie. De plus, la mortalité attribuable à l’ECF varie de 5 à 20 % et dépend d’un certain nombre de facteurs, notamment l’infection sous-jacente et l’emplacement de la fistule. La septicémie étant la principale cause de décès chez les patients atteints de FEC, le contrôle de la source reste l’une des pierres angulaires du traitement. Dans des séries rétrospectives, on a constaté que la mortalité était multipliée par 16 en cas de septicémie et par 22 en cas d’infection non contrôlée. Ainsi, le traitement précoce et définitif des collections non drainées, associé à l’administration d’antimicrobiens à court terme, peut améliorer considérablement les résultats. Dans la plupart des séries, la mortalité semble également être en corrélation avec le débit de la fistule et son emplacement. La mortalité passe de 26 % pour les fistules à faible débit à 50 % pour les fistules à fort débit, compte tenu des défis liquidiens, électrolytiques et nutritionnels associés à la gestion de l’ECF. La mortalité est également corrélée à l’emplacement et diminue avec les fistules plus distales. Alors que les fistules jéjunales présentent le taux de mortalité le plus élevé (29 %) et sont beaucoup plus difficiles à gérer, la mortalité due aux fistules coliques est la plus faible (6 %).
Au delà de l’impact sur le patient, qui va de la physiologie à la psychologie, la gestion de l’ECF exerce une pression énorme sur les ressources de santé. On estime que le coût de la prise en charge de l’ECF dépasse largement les 500 000 dollars et nécessite une équipe pluridisciplinaire composée de nutritionnistes, d’infirmières spécialisées dans le traitement des plaies et de chirurgiens afin de garantir un bon résultat. L’importance des centres de traitement hautement spécialisés ne doit pas être sous-estimée et il a été démontré qu’ils réduisaient considérablement la mortalité de 42% à 20% .
Tableau 1

| Anatomique | Proximale ou distale | Gastrique, duodénale, jéjunale, iléale, colique |
| Physiologique | Débit élevé, modéré, faible | Débit élevé >500 cc/jour Modéré 200-500cc/jour Débit faible <200cc/jour |
| Etiologie | Itrogène vs. spontanée Traumatique |
Maligne Radiation Maladie inflammatoire de l’intestin Diverticulaire |
Tableau 1 : Classification.
Tableau 1
Classification.
Tableau 2

| Favorable. | INFAVORABLES |
|---|---|
| Riche en nutriments | Dépourvu en nutriments |
| – Albumine >3.0 | -Peu d’albumine, peu de transferrine |
| Long tractus fistuleux (>2cm) | Fistule courte, fistules multiples et complexes |
| Fistule diverticulaire | Grand défaut entéral (>1cm), muqueuse visible |
| Faible débit | Haut débit (>500cc/jour) |
| Fistule unique | Radiations antérieures |
| Fistule unique | Radiations antérieures |
| Continuité intestinale | Multiples opérations antérieures |
| Opération d’indexation effectuée dans le même centre | Références externes à un centre à hautvolume |
Tableau 2 : Variables pronostiques de l’ECF.
Tableau 2
Variables pronostiques des ECF.
Classification
Il n’existe pas de schéma de classification universel ou bien établi pour les ECF. Les fistules sont généralement classées anatomiquement, physiologiquement ou par processus pathologique . Les fistules peuvent également être classées en fonction de la quantité d’écoulement quotidien. Il est impératif que le débit de la fistule soit documenté avec précision car la quantité peut dicter des changements dans la prise en charge. Le tableau 1 détaille trois paradigmes de classification différents.
Facteurs pronostiques de l’ECF
Les facteurs pronostiques de l’ECF ont été très bien décrits et sont conformes au dogme chirurgical standard. A l’inverse, les patients sans comorbidité qui ont des fistules résultant d’une procédure chirurgicale et qui ont un faible débit s’en sortent plus favorablement avec des taux de fermeture spontanée plus élevés. Le tableau 2 détaille plusieurs des variables qui peuvent prédire une issue favorable.
On ne saurait trop insister sur l’importance du soutien institutionnel et de l’expertise multidisciplinaire en tant que facteur de pronostic positif.
De multiples études ont confirmé que l’expérience et le volume institutionnel sont des facteurs essentiels pour réduire la morbidité et améliorer la mortalité. Récemment, l’Association canadienne pour la thérapie entérostomique a codifié l’importance des soins multidisciplinaires en identifiant neuf membres essentiels de l’équipe dans ses recommandations sur les « meilleures pratiques » en matière d’ECF. Allant des chirurgiens aux pharmaciens en passant par les aumôniers, cette approche d’équipe intégrée reconnaît l’expertise que chaque spécialité apporte à la prise en charge de ces patients complexes.
Diagnostic
Un cours postopératoire fumant compliqué par un iléus et le développement d’une infection de la plaie postopératoire est un signe avant-coureur de FEC. Une fois qu’une fistule est suspectée ou a été identifiée à l’examen physique, les études radiologiques sont des compléments nécessaires et 97% de tous les patients subissent une forme d’évaluation radiologique . La tomodensitométrie améliorée par contraste est essentielle car elle permet d’évaluer la présence d’un abcès associé ou d’une collection non drainée. Une fois que le contrôle de la source a été optimisé, la fistulographie fluoroscopique joue un rôle important dans la définition de l’anatomie de la fistule. Une fistulographie aidera à localiser l’origine, à déterminer la longueur, à évaluer la présence d’une obstruction distale et à déterminer si la fistule est en continuité avec le reste de l’intestin. Une fois que le diagnostic d’une FEC a été confirmé, il faut se concentrer sur la prise en charge.
Figure 1
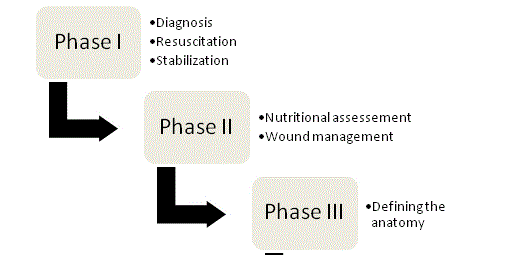
Figure 1
Quatre phases de la gestion des ECF.
Gestion
Les principes de la gestion de l’ECF ont été défendus pour la première fois parChapman et ses collègues en 1964 et à ce jour, ils restent les pierres angulaires de la thérapie. Dans leur article original, Chapman et al.ont identifié quatre facteurs clés : la réanimation liquidienne, le contrôle de la source, la gestion des effluents et la protection de la peau. L’importance de la nutrition est récemment apparue comme un cinquième élément clé. Une approche organisée et systématique devrait être entreprise avec chaque patient atteint d’une fistule afin d’optimiser les chances d’une issue favorable ; et la prise en charge peut finalement être décomposée en quatre phases (Figure 1).
Réanimation
La réanimation d’un patient atteint d’une FEC nouvellement diagnostiquée suit beaucoup de principes identiques à ceux de la réanimation des patients septiques et les principes de la campagne Surviving Sepsis devraient servir de cadre . Les soins initiaux doivent se concentrer sur une réanimation liquidienne agressive, une évaluation et une correction rapides des déséquilibres électrolytiques, et la normalisation de l’acidose lactique. Les patients souffrant d’ECF sont généralement hyponatrémiques, hypokaliémiques et acidotiques en raison des pertes gastro-intestinales continues. Les patients souffrant de fistules à haut débit doivent voir leurs pertes liquidiennes, électrolytiques et bicarbonatées remplacées par voie intraveineuse afin d’éviter la déshydratation et une profonde instabilité métabolique pendant la période initiale de stabilisation. Une surveillance attentive du débit urinaire et un remplacement ciblé de l’effluent de la fistule toutes les 4 à 8 heures permettront d’éviter une déshydratation continue.
Contrôle de la source
Une fois le patient réanimé, l’attention doit se porter sur l’établissement du contrôle de la source. Comme mentionné précédemment, une tomodensitométrie à contraste renforcé permet d’identifier les collections non drainées et les abcès. Chez les patients postopératoires, le contrôle de la source est très probablement réalisé par la radiologie interventionnelle. Cependant, face à des collections inaccessibles ou à une septicémie intra-abdominale incontrôlée, une opération peut être inévitable. Les antibiotiques à large spectre, empiriques et intraveineux, ne doivent pas être utilisés systématiquement pour traiter les ECF, à moins qu’il n’y ait des preuves de collections intra-abdominales ou d’infection de la plaie avec une cellulite associée. Dans la mesure du possible, les antibiotiques doivent être ciblés sur des données de culture spécifiques et limités à nomore de 2 semaines.
Gestion de l’effluent
La gestion de l’effluent de succès peut avoir un impact significatif sur le statut volumique, l’équilibre électrolytique, la nutrition et l’intégrité de la peau.L’utilisation d’inhibiteurs de la pompe à protons peut atteindre ces deux objectifs et la dose doit être ajustée jusqu’à ce que le pH de l’effluent soit supérieur à 6 et que le volume de sortie soit inférieur à 1L/jour. Bien que le psyllium puisse être extrêmement utile pour gonfler l’effluent et augmenter le temps de transit, les agents antimotilité et antisécrétoires, dont le lopéramide, l’atropinediphénoxylate, la codéine, la teinture d’opium et même la méthadone, constituent le pilier de la réduction du volume. Étant donné son rôle d’inhibiteur universel des hormones gastro-intestinales, de nombreuses recherches ont été consacrées à l’étude des effets de la somatostatine exogène sur les patients atteints de FEC. Malgré un nombre important d’essais contrôlés randomisés, il est difficile de tirer des conclusions significatives en raison de la petite taille de l’échantillon et de la conception incohérente des études. L’octréotide, un analogue de la somatostatine de plus longue durée, a également été étudié comme adjuvant de l’ECF avec des résultats prometteurs. L’octréotide à 100 mcg trois fois par jour peut réduire le volume de l’effluent et il a été démontré qu’il diminuait le délai de fermeture spontanée dans certaines études. Ainsi, un essai de traitement par octréotide pendant 72 heures avec une surveillance étroite du débit de la fistule peut être justifié, en particulier dans les cas où d’autres thérapies n’ont pas réussi à réduire le volume de l’effluent. Les effets secondaires courants comprennent l’hyperglycémie, les maux de tête et la cholélithiase.
Si les données indiquent clairement que les fistules à faible débit ont un taux plus élevé de fermeture spontanée, il est moins évident que la diminution du volume de sortie améliore la fermeture de la fistule. Néanmoins, la diminution du volume de sortie peut considérablement alléger le fardeau de la gestion des fistules et avoir un impact positif sur le bien-être des patients.
Soins des plaies
Peut-être l’un des aspects les plus difficiles et exigeant des ressources de la gestion de l’ECF est le contrôle local de l’effluent. Les effluents peuvent rapidement dégrader la peau et provoquer des irritations difficiles à traiter. C’est pourquoi une gestion appropriée de la peau avec des crèmes barrières, des barrières d’humidité, des appareils à poches et des dispositifs d’aspiration est primordiale. Les fistules à haut débit, en particulier, nécessitent souvent un réseau complexe de drains, de poches et d’aspiration pour contrôler correctement l’effluent. Des équipes hautement spécialisées dans le traitement des plaies et des thérapeutes entérostomiques sont d’une valeur inestimable pour le traitement des plaies et le confort du patient.
Avec l’utilisation omniprésente de la thérapie par pression négative (TPN) pour le traitement des plaies et des abdominaux ouverts, il n’est pas surprenant que la TPN fasse désormais partie de l’arsenal chirurgical pour traiter les FEC. Dans la plus grande série à ce jour, Wainstein et al. ont rapporté leur expérience avec 91 patients souffrant de fistules à haut débit et traités avec une pression négative allant de -350 à -600 mmHg. Outre la réduction significative du débit d’effluents, qui est passé d’une moyenne de 1 400 cc/jour à 138 cc/jour, une fermeture spontanée a été obtenue chez 46 % des patients.En 2016, Misky et al. ont publié une méta-analyse portant sur l’utilisation de la TPN dans l’ECF. En 2016, Misky et al ont publié une méta-analyse sur l’utilisation de la NPT dans l’ECF. En utilisant dix études rétrospectives avec un total de 151 patients, ces auteurs ont constaté que le taux médian de fermeture spontanée était de 65 % (allant de 7 % à 100 %) avec un temps médian de fermeture de 58 jours. Ces chercheurs ont également signalé un taux de nouvelles fistules de 4,4 % – une complication connue qui a donné à certains praticiens une certaine hésitation.Bien que des recherches supplémentaires soient clairement nécessaires pour déterminer si les NPT peuvent définitivement améliorer les taux de fermeture des ECF ou réduire le délai de fermeture spontanée, les avantages positifs de ces pansements ne doivent pas être négligés. Au minimum, cette technologie peut faciliter la gestion des ECF en contrôlant l’effluent, en protégeant la peau et en diminuant la fréquence des changements de pansement.
Tableau 3

| Investigateurs | Pratique institutionnelle |
|---|---|
| Hollington | 8 mois |
| Evenson | 4 mois |
| Rahbour | 12 mois |
| Datta | 6 mois |
| Lynch | 6 mois |
| Li | 6 mois |
| Mcintyre | 6 mois |
Tableau 3 : Délai de prise en charge définitive.
Tableau 3
Temps jusqu’à la prise en charge définitive.
Nutrition
ÉvaluationL’état nutritionnel d’un patient atteint de FEC est d’une importance capitale. Avant l’avènement des formules entérales à base de peptides et de la nutrition parentérale totale (NPT), des séries historiques rétrospectives mettent en évidence le poids de la malnutrition chez les patients atteints de FEC. Dans une série de 157 patients dans les années 1950 et 1960, près de 75 % des patients souffrant de fistules proximales étaient mal nourris. Des résultats similaires ont été rapportés par Chapman et al. qui ont constaté que seule une petite minorité de patients avait une nutrition optimale et qu’une fois la nutrition améliorée, la mortalité liée à l’ECF chutait de 55% à 12-16%.
Une évaluation nutritionnelle complète doit être effectuée sur chaque patient avec une ECF. Bien que l’équation de Harris-Benedict constitue un bon point de départ pour calculer les besoins nutritionnels, il est largement admis que les patients atteints d’ECF sont cataboliques et hypermétaboliques.
En général, ces patients ont besoin d’un soutien calorique accru avec au moins 25-30 kcal/kg/jour en glucides et en graisses et 1,5 à 2 grammes de protéines/kg/jour.
Le statut nutritionnel et les progrès doivent être réévalués régulièrement. L’albumine préopératoire, en particulier, s’est avérée être le plus fort prédicteur de mortalité et de morbidité après une chirurgie générale et l’hypoalbuminémie reste un prédicteur significatif de mauvais résultats chez les patients atteints d’ECF. Cependant, la protéine la plus étudiée dans l’ECF est peut-être la transferrine, et des taux supérieurs à 140 ont été associés à une augmentation des taux de fermeture spontanée et à une réduction de la mortalité. Bien que le bilan azoté puisse être un outil utile, cette mesure standard peut être difficile à réaliser chez les patients souffrant de fistules à haut débit. Des tests supplémentaires, tels que la calorimétrie indirecte, peuvent être envisagés dans les cas plus complexes qui ne répondent pas aux soins standard.
Nutrition parentérale vs nutrition entérale
La nutrition parentérale a joué un rôle essentiel dans la gestion de l’ECF, son utilisation ayant été fermement établie par Dudrick en 1969.Dans son article sentinelle décrivant la gestion optimale de la TPN,Dudrick a conclu que : « Dans son article décrivant la gestion optimale de la NPT, Dudrick a conclu qu’avec l’utilisation exclusive de l’hyperalimentation parentérale, le gain de poids, l’équilibre positif de l’azote, la croissance et le développement sont régulièrement atteints. Bien que la NPT réduise les sécrétions gastro-intestinales de 30 à 50 %, réduisant ainsi l’incidence de la déshydratation et des déséquilibres électrolytiques, il n’existe aucune étude randomisée traitant de l’impact de la NPT sur la conversion anabolique, les taux de fermeture spontanée ou la mortalité. Néanmoins, la NPT reste une modalité de traitement à long terme populaire malgré de sérieuses complications, notamment l’infection et le dysfonctionnement hépatique.
Plus récemment, cependant, l’utilisation de la nutrition entérale dans l’ECF a gagné du terrain. L’utilisation de la nutrition entérale présente un certain nombre d’avantages, notamment la réduction des coûts, la diminution des infections et l’amélioration de la fonction immunologique par rapport à la NPT. De plus, le fait de ne fournir que 20 % des calories par voie entérale peut contribuer à maintenir la flore intestinale et à réduire la translocation bactérienne.
Plusieurs séries ont rapporté des succès surprenants avec la nutrition entérale chez les patients atteints d’ECF. La nutrition entérale peut même être utilisée avec succès dans le cas d’une fistule à haut débit lorsqu’elle est associée à des formules élémentaires, des agents antimotilité et des agents de gonflement des fibres. Dans une série de 335 patients souffrant de fistules à haut débit, Levy et al. ont réussi à atteindre l’indépendance vis-à-vis de la NPT chez 85% de leur cohorte en utilisant des aliments entéraux. Il est intéressant de noter que, malgré la nutrition entérale et l’absence de « repos intestinal », la mortalité et les taux de fermeture spontanée étaient similaires à ceux des séries précédentes.
Dans le cadre d’une FEC à haut débit avec un mucocutané distal, la fistuloclyse peut être un complément important à l’alimentation entérale standard. La pratique de la fistuloclyse est née de la pratique de la réalimentation du chyme chez les nouveau-nés et peut se référer soit à la réalimentation de la réussite, soit à l’ajout d’une alimentation entérale supplémentaire par sonde via un cathéter placé dans le membre distal d’un ECF. Teubner et al. ont décrit pour la première fois la fistuloclyse comme une thérapie pour les ECF en 2004 dans une série de cas de douze patients présentant des fistules proximales. Depuis lors, un certain nombre de rapports de cas et de petites séries ont démontré l’efficacité nutritionnelle de cette technique. Comparés à une cohorte appariée de patients recevant un RTE sans fistuloclyse, les patients souffrant de fistules à haut débit et traités par fistuloclyse présentaient une amélioration significative de la fonction hépatique et des paramètres nutritionnels. La fistuloclyse peut être particulièrement utile chez les patients qui développent des complications liées à la NPT, notamment des infections, des problèmes d’accès veineux ou une insuffisance hépatique. Des complications peuvent toutefois survenir et inclure une obstruction si l’activité péristaltique de l’intestin grêle fait avancer le cathéter de la fistule de manière distale dans l’intestin grêle.
Les vitamines et les minéraux sont souvent épuisés chez les patients atteints d’ECF.
Les carences en vitamines liposolubles sont courantes, tandis que les carences en vitamines hydrosolubles sont rares, sauf si la fistule se trouve dans le jéjunum proximal. De plus, la vitamine B12 n’étant absorbée que dans les 50 à 60 cm terminaux de l’iléon, la vitamine B12 injectable peut être nécessaire chez de nombreux patients atteints d’ECF. Le magnésium est fréquemment gaspillé dans les fistules à haut débit et doit être réapprovisionné avec du sulfate de magnésium par voie intraveineuse ou du chlorure de magnésium par voie orale pour améliorer l’absorption entérale. Enfin, il a été recommandé d’administrer des doses élevées de zinc et de vitamine C . Alors que les oméga-3 et l’huile de poisson ont été étudiés dans le cadre des soins intensifs avec un certain bénéfice, ces suppléments n’ont jamais été évalués chez les patients atteints d’ECF et ne sont pas utilisés de manière routinière.
Préoccupations opérationnelles
Le taux de fermeture spontanée de l’ECF varie entre 15 et 75 % dans la littérature. Cette large gamme de taux de fermeture reflète probablement des différences dans les populations de patients et les modèles de pratiques institutionnelles . Les fistules sont nettement moins susceptibles de se fermer spontanément au-delà de 4 semaines, avec seulement 10% des fistules se fermant après deux mois. Comme les taux de fermeture spontanée des ECF sont faibles, l’intervention chirurgicale est souvent la seule stratégie de prise en charge définitive.
La décision d’opérer un ECF ne doit cependant pas être prise à la légère car les taux de récidive après l’ablation d’un ECF varient de 13 à 34% . Bien que les principes de l’intervention chirurgicale pour l’ECF impliquent de nombreux principes fondamentaux de la chirurgie générale, le moment de l’opération est peut-être le facteur le plus important à considérer. Fazio et al ont démontré l’importance de la gestion de l’attente pour les patients atteints d’ECF. Lorsque la chirurgie avait lieu moins de 6 semaines après la formation de l’ECF, la mortalité dépassait 20 %. En retardant l’opération de plus de 6 semaines, cependant, la mortalité a diminué à 11 %.En outre, une opération précoce peut entraîner un risque accru de récidive. Dans une série de Lynch et al. les patients opérés entre 2 et 12 semaines de formation de l’ECF avaient un taux de récidive de 28%, alors qu’un délai supérieur à 12 semaines a réduit ce taux à 15%. Le tableau 3 montre le temps que les auteurs experts suggèrent d’attendre avant d’envisager une intervention chirurgicale pour une ECF qui ne guérit pas.
La prise en charge chirurgicale ne doit être poursuivie qu’avec le plein investissement et la compréhension du patient et du chirurgien. Les fermetures d’ECF sont des cas longs, techniquement difficiles avec le risque de complications significatives. Les opérations nécessitent souvent une mobilisation complète de l’intestin depuis le ligament de Treitz jusqu’au rectum.Étant donné que 36% des fistules récurrentes sont le résultat de blessures créées pendant l’opération de fermeture de l’ECF, une grande attention doit être prise tout au long de la lyse des adhérences pour éviter toute blessure accidentelle à l’intestin sain. La gestion de l’intestin fistuleux doit toujours comporter une résection intestinale et une astomose primaire. La résection de la fistule par-dessus la couture ou le bord entraîne invariablement une récidive plus élevée (36% contre 16%) .
Conclusion
La fistule entéro-cutanée est l’une des complications les plus difficiles auxquelles est confronté le chirurgien général. L’utilisation d’une approche prudente, systématique et centrée sur le patient aidera à maximiser les résultats cliniques réussis. Malgré la cohérence des principes de la gestion de l’ECF pour tous les patients, chaque fistule est unique et sa gestion est définie en grande partie par son débit ainsi que par sa localisation et les comorbidités du patient. L’expérience des chirurgiens et des institutions souligne l’importance d’une intervention tardive. Bien que les chirurgiens et les patients puissent avoir un fort désir de procéder à une fermeture chirurgicale, les patients sont mieux servis par une gestion non opératoire d’au moins 6 mois. En fin de compte, la prise en charge à long terme des patients atteints d’ECF nécessite une approche multidisciplinaire souvent coordonnée par le chirurgien.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Une expérience de 11 ans de fistule entérocutanée. Br J Surg. 2004 ; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Management of enterocutaneous fistulas : 30 ans d’expérience clinique. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Gestion des fistules entérocutanées : A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Examen de 404 patients atteints de fistules gastro-intestinales. Impact de la nutrition parentérale. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing : development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimiser le traitement des fistules gastro-intestinales supérieures. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrition et gestion de la fistule entérocutanée. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Classification et pathophysiologie des fistules entérocutanées. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. La physiopathologie des fistules entéro-cutanées. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Fistule entéro-cutanée : les traitements s’améliorent-ils ? Chirurgie. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Gestion systématique des fistules entéro-cutanées postopératoires : facteurs liés aux résultats. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. Une revue systématique de la littérature sur l’utilisation de la fermeture assistée par le vide pour la fistule entérocutanée. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Un modèle multivarié pour déterminer les facteurs pronostiques des fistules gastro-intestinales. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. Fistules externes à haut débit de l’intestin grêle : gestion par nutrition entérale continue. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Perspectives historiques dans la prise en charge des patients atteints de fistule entérocutanée. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Soutien métabolique du patient atteint de fistule entéro-cutanée. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Fistule entérocutanée compliquant une laparotomie pour traumatisme : A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Fistules entériques : principes de gestion. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Fistule entérocutanée : stratégies éprouvées et mises à jour. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Association canadienne pour la thérapie entérostomique ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Résumé des recommandations de meilleures pratiques pour la gestion des fistules entérocutanées de l’Association canadienne pour la thérapie entérostomique ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Gestion actuelle de la fistule entérocutanée. Journal de la chirurgie gastro-intestinale : journal officiel de la Société de chirurgie du tube digestif. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Gestion des fistules intestinales. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign : international guidelines for management of severe sepsis and septic shock : 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Rôle de la somatostatine-14 et de ses analogues dans la prise en charge des fistules gastro-intestinales : données cliniques. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. A ten-year experience. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr, Williams GM, Welch CE. Fistules externes découlant du tractus gastro-intestinal. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Soutien métabolique et nutritionnel du patient souffrant d’une fistule entérocutanée : une approche en trois phases. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Le taux d’albumine sérique préopératoire comme prédicteur de la mortalité et de la morbidité opératoires : résultats de l’étude nationale sur le risque chirurgical des VA. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Facteurs prédictifs de récidive et de mortalité après réparation chirurgicale de fistule entérocutanée. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63 ; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. L’alimentation intraveineuse comme seul moyen de nutrition peut-elle soutenir la croissance chez l’enfant et restaurer la perte de poids chez l’adulte ? An affirmative answer. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients : an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. La fistuloclyse peut remplacer avec succès l’alimentation parentérale dans le soutien nutritionnel des patients atteints de fistule entérocutanée. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis : case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. La fistuloclyse améliore la fonction hépatique et l’état nutritionnel des patients atteints de fistule entérique supérieure à haut débit. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Prise en charge des fistules entéro-cutanées. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Gestion chirurgicale des fistules entérocutanées à haut débit : une expérience de 24 ans. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Chirurgie opératoire pour la fistule entérocutanée. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Résultat clinique et facteurs prédictifs de récidive après une chirurgie de fistule entérocutanée. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Résultat de 132 opérations reconstructives consécutives pour fistule intestinale–une opération par étapes sans anastomose primaire a amélioré le résultat dans une analyse rétrospective. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Gestion des fistules gastro-intestinales externes. Ann Surg. 1978;188:460-7.