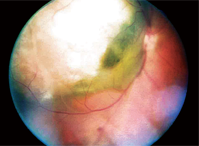
1. Photographie du fond d’œil de l’œil droit de notre patient.
Un détenu de race blanche âgé de 65 ans s’est présenté à la clinique ophtalmologique d’un établissement correctionnel d’État en se plaignant de « bugs » dans la vision de son œil gauche. Cela se produisait depuis environ trois semaines ; il a nié toute photopsie. Les antécédents systémiques du patient étaient significatifs : hypertension, problèmes cardiaques (ayant subi deux remplacements de valves) et diabète de type 2 contrôlé par des médicaments oraux.
Ses antécédents oculaires étaient significatifs d’une cécité « de longue date » de son œil droit.
En l’interrogeant davantage sur cette cécité de longue date, nous avons appris que, 15 ans auparavant, le patient avait consulté un spécialiste de la rétine, qui lui avait dit qu’il avait une « tache de rousseur » dans l’œil. Il a déclaré qu’il avait perdu la vision de l’œil droit il y a environ 10 ans, mais qu’il n’avait pas vu de spécialiste depuis cette visite il y a 15 ans.
Données diagnostiques
À l’examen, l’acuité visuelle du patient était une perception de la lumière seulement O.D., et 20/25 O.S. Les pupilles mesuraient 4mm O.D. et 3mm O.S. et étaient à la fois rondes et réactives, avec un défaut d’afférence 3+ O.D. L’évaluation du segment antérieur était remarquable pour des cataractes nucléaires sclérosées. Nous avons effectué un examen du fond d’œil dilaté et constaté que la plainte principale du patient était due à un décollement postérieur du vitré en O.S., qui a provoqué une synérèse dense et centrale du vitré. Nous n’avons pas trouvé de cassure rétinienne ou autre chose d’importance clinique dans cet œil.
L’examen du fond d’œil dilaté de son œil droit a révélé une grande lésion surélevée, d’une taille d’environ 12 diamètres de disque, s’étendant de – et incluant – la papille optique temporale, au-delà de la macula temporale et au-delà de l’arcade supérieure. Elle était de couleur gris-blanc avec ce qui semblait être un contenu liquide dans la face inféro-nasale (figure 1).
Diagnostic
Nous avons posé un diagnostic provisoire de mélanome choroïdien avec décollement séreux de la rétine, et l’avons documenté par des photos du fond d’œil.
Traitement et suivi
Nous avons adressé le patient à l’ophtalmologiste du personnel de l’établissement pour une évaluation et un traitement supplémentaires. Environ deux semaines plus tard, l’ophtalmologiste l’a vu et a effectué une angiographie à la fluorescéine ainsi qu’une échographie à balayage A et B. Les rapports d’interprétation de ces procédures étaient assez rudimentaires ; ils indiquaient que les balayages A et B révélaient une « masse solide », et que la fluorescéine montrait que la masse était remplie de colorant au début, puis disparaissait lentement. Après ces études, l’ophtalmologiste a posé des différentiels de mélanome malin ou de dégénérescence maculaire disciforme. Il a adressé le patient à un spécialiste de la rétine, qui l’a vu quelques jours seulement après sa consultation en ophtalmologie.
Le spécialiste de la rétine a immédiatement diagnostiqué un mélanome choroïdien et a envoyé le patient chez un spécialiste en oculoplastie le jour même pour discuter du traitement. Les résultats des tests diagnostiques du spécialiste de la rétine et du spécialiste en oculoplastie n’étaient pas à notre disposition dans le dossier du patient. Un scanner abdominal avec contraste et une radiographie pulmonaire ont également été demandés.
Le patient et le spécialiste en oculoplastie ont décidé d’un traitement par énucléation, et le patient a été programmé pour une chirurgie la semaine suivante. L’énucléation a été réussie ; cependant, le patient a malheureusement eu des difficultés avec l’anesthésie et est décédé deux jours après l’énucléation. Le scanner abdominal et les radiographies du thorax n’avaient pas encore été réalisés.
Discussion
Les mélanomes choroïdiens sont relativement rares, avec une incidence d’environ cinq à six cas pour un million de personnes, ce qui équivaut à environ 1 400 cas aux États-Unis chaque année.1,2 Ils se retrouvent surtout chez les adultes (avec un pic autour de 55 ans), ne sont généralement pas familiaux et montrent une légère prédilection masculine pour la plupart des groupes d’âge1,3,4. Ils surviennent surtout chez les personnes à la peau claire et aux iris bleus ou verts, et sont rarement observés chez les Noirs ou les Asiatiques.1,4
Les patients atteints de mélanomes choroïdiens sont souvent asymptomatiques, mais peuvent présenter une baisse de la vision, des anomalies du champ visuel, des flotteurs, des photopsies ou, dans de rares cas, une douleur.4,5 Si une douleur survient, elle est généralement le résultat d’un glaucome secondaire ou d’une nécrose tumorale ; les mélanomes choroïdiens peuvent également provoquer une douleur en empiétant sur les nerfs ciliaires postérieurs sous-jacents, mais cela se produit rarement3,5.
Ces lésions sont généralement surélevées et peuvent apparaître tachetées, brun foncé, gris terne, gris-vert ou jaunes (amélanosiques).4-6 Elles peuvent prendre la forme d’un champignon ou d’un dôme avec des vaisseaux sanguins congestionnés à l’intérieur de la tumeur – cette configuration représente les 20 % de mélanomes choroïdiens qui font éruption à travers la membrane de Bruch et l’épithélium pigmentaire rétinien (EPR).1,4,5
Les mélanomes choroïdiens présentent souvent une élévation abrupte de la choroïde, du liquide sous-rétinien, une pigmentation orange sur la surface de la lésion et une croissance au fil du temps4. Le liquide sous-rétinien et le décollement séreux sous-jacent de la rétine qui en résulte résultent de la dégradation de l’EPR. Ces décollements séreux se déplacent souvent et peuvent sembler contenir du sang si la tumeur a traversé la membrane de Bruch.5
La pigmentation orange sous-jacente est la lipofuscine ; ce pigment est composé de protéines, de lipides et de petits chromophores, et il s’accumule dans l’EPR à la suite de la dégénérescence cellulaire et de la digestion incomplète des segments externes des photorécepteurs6,7. La lipofuscine n’est pas spécifique aux mélanomes ; elle peut également être associée aux naevus choroïdiens ou à d’autres tumeurs choroïdiennes bénignes. Cependant, la lipofuscine est beaucoup plus fréquemment observée avec les mélanomes qu’avec les homologues bénins.5
Les autres signes possibles associés aux mélanomes choroïdiens comprennent des hémorragies vitréennes ou des cellules vitréennes pigmentées, des drusen à la surface de la tumeur, des membranes néovasculaires choroïdiennes, voire une proptose si la tumeur envahit l’orbite4.
Diagnostics différentiels
Il existe une pléthore de diagnostics différentiels pour les mélanomes choroïdiens mélanotiques et amélanotiques, qui varient sur le continuum pronostique de gravité.
– Les nævus choroïdiens constituent un différentiel majeur. Ce sont des tumeurs mélanocytaires bénignes et courantes, que l’on trouve chez environ 2 % à 6,5 % de la population blanche.8-10 Les nævus sont généralement gris ardoise et relativement plats (moins de 2 mm d’épaisseur), bien qu’il existe un chevauchement de taille significatif entre les petits mélanomes et les nævus plus grands.8,9 Comme les mélanomes choroïdiens, ils peuvent également présenter des drusen ou de la lipofuscine sus-jacents (figure 2). Statistiquement, sur 500 nævus choroïdiens, un subira une transformation maligne s’il est suivi pendant 10 ans ; le taux annuel estimé de transformation maligne est de un sur 8 845.6,9
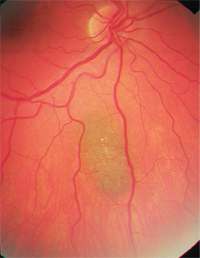
2. Naevus choroïdien avec drusen sus-jacent.
Il existe de multiples facteurs de risque connus pour une telle transformation (voir « Transformation maligne. »).4,8 Le plus important semble être une épaisseur initiale du naevus supérieure à 2 mm, mais un diamètre de base important (supérieur à 7 mm) suggère également une pré-malignité du naevus.8,9 L’absence de drusen est un bon indicateur de pronostic.7
Alors que les mélanomes choroïdiens ont tendance à se développer relativement rapidement, les nævus choroïdiens peuvent s’agrandir lentement sur une période de plusieurs années, ce qui n’indique pas nécessairement une transformation maligne. Une telle croissance non maligne est plus fréquente chez les patients plus jeunes et tend à se stabiliser avec l’âge.11 Ainsi, la croissance lente des nævus choroïdes n’est pas invariablement un signe de malignité, en particulier chez les patients plus jeunes sans autres facteurs de risque.11
Il est intéressant de noter que les lésions choroïdes pigmentées sans aucun des facteurs de risque ci-dessus ont 3 % de chances de croître en cinq ans ; ces lésions sont généralement des nævus choroïdes.9 La présence d’un des facteurs ci-dessus entraîne 38 % de chances de croissance, et plus de 50 % de chances de croissance existent si deux facteurs de risque ou plus sont présents.9 Le risque relatif de croissance grimpe de 1,9 fois à 27,1 fois pour la présence d’un seul facteur de risque par rapport aux cinq facteurs de risque.9
– Les métastases choroïdiennes désignent une tumeur qui s’est propagée à la choroïde par voie hématogène à partir d’une tumeur maligne primaire située ailleurs dans le corps. Il ne s’agit donc pas de tumeurs primaires comme le mélanome choroïdien – le plus souvent, ce sont des métastases d’un cancer du sein ou du poumon. Ces lésions ont généralement la forme d’un dôme, sont de couleur jaune crème et provoquent souvent des décollements de la rétine. Les métastases choroïdiennes sont souvent bilatérales ou multifocales et n’ont pas l’aspect d’un champignon, contrairement aux mélanomes amélonieux.1
– L’hypertrophie congénitale de l’EPR se présente sous la forme de lésions plates, uniques ou multifocales, de pigmentation foncée, souvent accompagnées de lacunes hypopigmentées. Elles sont bénignes, ne changent généralement pas avec le temps et ne nécessitent aucun traitement.1
Le décollement séreux de la rétine qui en résulte et l’élévation de la rétine secondaire à la dégénérescence maculaire liée à l’âge (DMLA) exsudative posent un autre différentiel pour le mélanome choroïdien. La DMLA peut présenter une hémorragie sous-rétinienne, une exsudation lipidique ou turbide, un œdème maculaire gris sale ou jaune, des plis choroïdiens, des décollements de l’épithélium pigmentaire ou des cicatrices disciformes.1 L’angiographie à la fluorescéine aide à différencier ces affections.
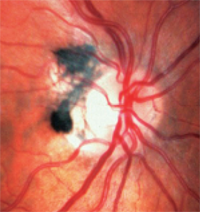
3. Les mélanocytomes ont une pigmentation foncée et se trouvent sur ou autour du disque optique.
– Les mélanocytomes ont une pigmentation foncée et se trouvent sur ou autour du disque optique (figure 3). Contrairement aux mélanomes, ils sont congénitaux et surviennent souvent chez des individus aux pigments foncés. Ils sont généralement inactifs, mais peuvent croître et se transforment rarement en mélanomes.1
– Les hémangiomes choroïdiens sont des dilatations bénignes des vaisseaux sanguins choroïdiens et sont souvent associés au syndrome de Sturge-Weber. Ils apparaissent surélevés et sont de couleur rouge-orange. Comme les mélanomes choroïdiens, ils peuvent induire des décollements séreux de la rétine.1
– Les ostéomes choroïdiens sont des masses placoïdes jaune-orange. Il est intéressant de noter qu’ils sont composés de tissu osseux mature. Ils peuvent laisser se développer une néovascularisation choroïdienne et une hémorragie sous-rétinienne. Des traits très caractéristiques les rendent faciles à différencier des mélanomes choroïdiens à l’aide d’une échographie ou d’un scanner1.
– Les autres éléments différentiels pour les mélanomes choroïdiens amélonétiques ou mélanotiques comprennent le décollement choroïdien, le lymphome, le carcinome métastatique, l’hématome sous-rétinien ou sous-ERP, l’hématome supra-choroïdien localisé, la sclérite postérieure nodulaire, l’hyperplasie réactive de l’ERP ou la gliose massive de la rétine4,5.
Tests complémentaires
Divers instruments peuvent aider au diagnostic des mélanomes choroïdiens.
L’échographie à balayage A et B aide non seulement au diagnostic, mais peut également fournir des mesures plus précises de la tumeur. L’échographie A révèle généralement une faible réflectivité interne au sein de la tumeur ; l’oscillation de la hauteur des échos au sein de la lésion peut correspondre au pouls du patient, ce qui indique la présence d’une vascularisation intralésionnelle.1,5
L’échographie B montre une masse solide avec un aspect antérieur acoustiquement clair avec une obscurité interne et basale ; la forme en coupe transversale est généralement biconvexe, mais peut apparaître comme un champignon. Une excavation choroïdienne et une ombre orbitale peuvent également être observées.1,5
L’angiographie à la fluorescéine montre généralement une hyperfluorescence des vaisseaux de la tumeur et une coloration tardive diffuse.1 Cependant, le schéma de fluorescéine dépend de la taille, de la forme et de la pigmentation de la tumeur, de l’intégrité de l’EPR et de la présence ou non d’un décollement séreux de la rétine correspondant, entre autres variables.5 L’angiographie à la fluorescéine ne donne pas de signes pathognomoniques de mélanome choroïdien.3
Dans ce patient particulier, le mélanome choroïdien a été diagnostiqué sur la base d’un examen fundoscopique, d’échographies A- et B-scan et d’une angiographie à la fluorescéine (sans biopsie).
La présentation clinique de ce patient était à elle seule très évocatrice – fondamentalement sans équivoque – d’un mélanome choroïdien. Il possédait quatre des cinq facteurs de risque de malignité susmentionnés : épaisseur > 2mm, liquide sous-rétinien, symptômes/perte visuelle, et une localisation < 3mm du disque optique. Bien que les dimensions de la lésion mélanotique basée sur l’échographie ne soient pas disponibles, elle était clairement épaissie de plus de 2mm et avait un diamètre basal supérieur à 7mm (les limites supérieures largement acceptées des naevus bénins).8,12
De plus, la masse présentait des caractéristiques invasives flagrantes, comme l’empiètement sur le disque optique.8,12
Gestion et pronostic
Lorsqu’une masse oculaire suspecte est découverte, il est important de demander au patient s’il a subi une chirurgie ou un traumatisme oculaire, s’il a des antécédents de cancer ou s’il présente des symptômes systémiques de cancer, tels qu’une anorexie, une perte de poids, une fatigue générale, un malaise ou une maladie. Bien que 98% des patients atteints de mélanomes choroïdiens n’aient pas de maladie métastatique détectable au moment du diagnostic, les métastases doivent être exclues.5 Cette situation serait traitée de manière plus appropriée par un oncologue oculaire, de sorte qu’une telle référence doit être faite.
Les tests comprennent un hémogramme complet, des enzymes hépatiques, un scanner abdominal, une IRM ou une échographie, et une radiographie pulmonaire.4,5 Plusieurs options de traitement sont disponibles pour les mélanomes choroïdiens, mais beaucoup d’entre elles comportent des risques élevés ; par conséquent, le praticien traitant doit peser soigneusement de nombreuses variables lors du choix de la modalité de traitement appropriée pour chaque patient particulier. Quelques facteurs à prendre en compte sont la taille et l’emplacement de la tumeur, le statut des métastases, l’état visuel des yeux affectés et non affectés, ainsi que l’âge et l’état de santé général du patient.5 En fonction de ces facteurs, l’observation peut être un plan de gestion viable si le patient a de graves problèmes médicaux concomitants, mais elle n’est généralement pas conseillée.
Transformation maligne
Les facteurs de risque de transformation maligne des nævus choroïdiens comprennent :4
– Épaisseur > 2mm.
– Liquide sous-rétinien.
– Présence de symptômes.
– Pigment orange proéminent recouvrant la lésion.
– Localisation < 3mm du disque optique.
*Si deux facteurs ou plus sont présents, la lésion est probablement un mélanome choroïdien.
Un traitement très agressif est l’énucléation, mais il comporte des risques importants. La moitié des patients qui sont traités par énucléation finissent par mourir d’un mélanome métastatique. Cette option de traitement invasive est plus souvent discutée si l’œil atteint est aveugle, douloureux, présente une atteinte de la papille optique ou si la tumeur est très grande.5
La plupart des petits mélanomes choroïdiens sont traités par des thérapies destructives locales, telles que la thermothérapie, la radiothérapie ou l’irradiation12. Divers types de rayonnement peuvent être utilisés comme traitement.4,5 Le plus courant est la curiethérapie par plaque, qui utilise une plaque radioactive suturée à la surface du globe à l’extérieur de la tumeur.
Ce type de traitement est plus souvent tenté avec des tumeurs plus petites qui sont à 3 diamètres de disque ou plus loin du disque et de la fovéa. Environ 10 à 15 % des patients traités de cette manière connaissent une rechute de la tumeur locale après le traitement. Après le traitement, la vision du patient reste généralement la même qu’avant le traitement, mais il est possible qu’elle s’améliore. Cependant, la vision peut être réduite par la suite en raison d’effets secondaires, tels que la rétinopathie radique, la papillopathie optique, la cataracte ou le glaucome néovasculaire.
La photocoagulation peut être tentée pour les petites tumeurs (< 3 mm d’épaisseur, < 7 mm de diamètre basal).4,5 Comme pour la photocoagulation pour toute autre raison, un scotome permanent se produira dans les zones photocoagulées. D’autres traitements au laser peuvent également être utilisés, notamment la thermothérapie transpupillaire, qui utilise un laser infrarouge de faible puissance et de longue durée.5,12 Cette technique peut être utilisée conjointement avec la radiothérapie de plaque, mais n’a pas montré d’amélioration significative du contrôle local de la tumeur13.
Les autres traitements, moins courants, comprennent la résection locale, la thérapie photodynamique ou la cryothérapie.4,5 Souvent, plusieurs traitements sont utilisés dans le cadre d’une approche combinée.
Malheureusement, le pronostic des patients atteints de mélanome choroïdien est souvent mauvais. Malgré le traitement, 30 à 50 % des patients finissent par développer une maladie métastatique ; cela se produit préférentiellement dans le foie, mais aussi dans les poumons, les os, la peau, les ganglions lymphatiques ou le système nerveux central.3,11,14 La même proportion de patients décédera dans les 10 ans suivant le diagnostic, généralement en raison d’une propagation métastatique.3,11
Une fois métastasé, la fatalité est presque certaine.11 L’incidence la plus élevée de détection métastatique est dans l’année suivant le diagnostic de mélanome choroïdien, bien qu’elle puisse ne se produire que des années plus tard. Plusieurs facteurs sont en corrélation avec l’augmentation du taux de mortalité, notamment la taille plus importante du mélanome, sa localisation antérieure, son extension extrasclérale, sa croissance à travers la membrane de Bruch, l’extension du nerf optique, l’absence de pigmentation et le type cellulaire agressif et/ou l’activité mitotique.3
Il est évident que ce patient n’a pas reçu de soins adéquats lors de son premier rendez-vous à la clinique d’optométrie ; cependant, malgré des orientations appropriées après son deuxième rendez-vous, les chances d’une issue favorable ont nettement diminué.
Bien qu’un retard dans l’aiguillage de quelques mois n’ait peut-être pas modifié de façon significative les résultats dans ce cas, cette situation souligne l’importance d’une anamnèse approfondie et d’une communication efficace entre le médecin et le patient. Elle met également en évidence l’importance d’un aiguillage approprié et de bilans supplémentaires, quelle que soit la nature « ancienne » d’une affection.
Alors que le pronostic des patients atteints de mélanome choroïdien peut sembler sombre, les professionnels de la vue doivent instaurer un traitement approprié dès qu’ils découvrent une telle lésion afin d’améliorer les chances du patient d’avoir des résultats secondaires positifs, notamment la préservation de la vision.
Le Dr Weidmayer exerce avec un groupe d’optométristes au Eye Center of Lenawee, P.C., à Adrian et à Brooklyn, Mich.
1. Spaide RF. Maladies de la rétine et du vitré. 1ère éd. Philadelphie : W.B. Saunders ; 1999:262-65.
2. Margo CE. L’étude collaborative sur le mélanome oculaire : un aperçu. Lutte contre le cancer. 2004 Sep-Oct;11(5):304-9.
3 Garcia-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Choroidal Melanoma EMedicine Ophtalmologie. Référence Medscape. 24 juin 2009. http://emedicine.medscape.com/article/1190564-overview. Consulté le 17 août 2010.
4. nævus choroïdien et mélanome malin de la choroïde. Dans : Ehlers JP, Shah CP (eds). The Wills Eye Manual : Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5th ed. Philadelphie : Lippincott Williams & Wilkins ; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In : Yanoff M, Duker JS, eds. Ophthalmology. 1st ed. London : Mosby;1999:1052-63.
6. Jones WL. Ophthalmoscopy. In : Terry JE (ed). Ocular Disease : Detection, Diagnosis, and Treatment. 1st ed. Boston : Butterworth Publishers ; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Résultats de l’autofluorescence du fond d’œil et de la tomographie par cohérence optique dans les lésions mélanocytaires choroïdiennes. Middle East Afr J Ophthalmol. 2010 Jul;17(3) : 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Size overlap between benign melanocytic choroidal nevi and choroidal malignant melanomas. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Long term ultrasonic follow up of choroidal naevi and their transformation to melanomas. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Slow enlargement of choroidal nevi : a long-term follow-up study. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. Un test d’expression multigénique précis et cliniquement réalisable pour prédire les métastases dans le mélanome uvéal. J Mol Diagn. 2010 juillet;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Biopsie diagnostique par aspiration à l’aiguille fine transvitréenne de petites tumeurs choroïdiennes mélanocytaires dans la catégorie naevus versus mélanome. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Radiothérapie par plaques pour le mélanome choroïdien juxtapapillaire : contrôle tumoral dans 650 cas consécutifs. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. PET/CT du corps entier pour la stadification initiale du mélanome choroïdien. Br J Ophthalmol. 2005 Oct;89(10):1270-74.