Dans le bras à médiation cellulaire de la réponse immunitaire adaptative, de courts peptides sont liés par des molécules du complexe majeur d’histocompatibilité (CMH) de classe I et de classe II et présentés à la surface cellulaire où ils sont reconnus par les récepteurs antigéniques des lymphocytes T. La liaison d’un récepteur des cellules T (TCR) qui reconnaît un complexe CMH-peptide particulier induit les lymphocytes naïfs à se différencier en cellules effectrices (cellules T cytotoxiques et auxiliaires) qui détruisent les cellules hôtes infectées ou stimulent la production d’anticorps, et en cellules mémoires qui assurent une immunité protectrice contre la réinfection.
Structure et fonction des molécules du CMH
Deux familles multigéniques situées dans la région génomique du CMH codent pour des molécules de liaison aux antigènes qui présentent les peptides étrangers à la surface des cellules. En réalité, les molécules du CMH présentent également des peptides auto-dérivés. Cependant, la sélection thymique négative contre les cellules T autoréactives empêche les complexes CMH-peptides propres de déclencher une réponse immunitaire. Les molécules du CMH de classe I sont exprimées sur la plupart des cellules nucléées et présentent généralement des peptides endogènes dérivés d’agents pathogènes intracellulaires se répliquant dans le cytosol (par exemple, des virus). Les protéines cytosoliques sont dégradées en courts fragments peptidiques par le protéasome, et sont d’abord transportées dans le réticulum endoplasmique (RE) par les transporteurs ATP-dépendants TAP1 & 2 pour le chargement du MHCI, puis à la surface cellulaire pour la présentation aux cellules T CD8+ cytotoxiques circulantes dont la fonction est d’induire l’apoptose et la lyse de la cellule cible infectée. (Les figures sont adaptées de Murphy et al. (2008) Figs. 3.12, 3.25, 5.5, & 5.11.)
L’expression constitutive des loci du CMH de classe II est limitée aux cellules présentatrices d’antigènes du système immunitaire (CPA, par exemple les macrophages, les cellules dendritiques et les lymphocytes B). Les molécules MHCII sont stabilisées et empêchées de se lier à l’antigène lorsqu’elles résident dans le RE par association avec la chaîne invariante de classe II (Ii, ou CD74), puis elles sont redirigées de la voie sécrétoire par défaut vers la voie endocytique. Là, ils rencontrent des peptides dérivés d’agents pathogènes se répliquant dans des vésicules intracellulaires ou d’agents pathogènes extracellulaires et de protéines qui sont transportés dans la cellule. La liaison stable des peptides est catalysée par le dimère non classique MHCII DMα/β, et permet aux complexes MHCII-peptides de s’échapper de la voie endocytique pour être présentés à la surface des cellules. La reconnaissance par les cellules T CD4+ active la cellule hôte cible pour stimuler les mécanismes antibactériens (dans les macrophages) ou pour déclencher la production d’anticorps et la réponse immunitaire humorale.
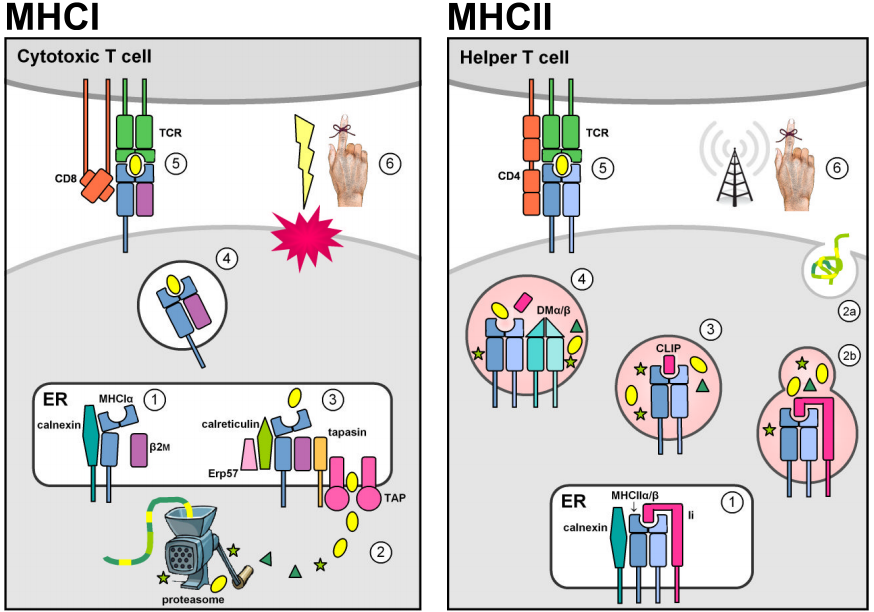
Les similitudes structurelles des molécules MHCI et MHCII reflètent probablement leur descendance d’un ancêtre commun. Les molécules MHC matures sont des glycoprotéines membranaires intégrales de type I composées d’un sillon de liaison aux peptides et de domaines de type immunoglobuline, transmembranaires et cytoplasmiques. Les parties extracellulaires des molécules du CMH sont constituées de deux domaines distaux de la membrane qui forment ensemble une cavité de liaison peptidique délimitée par deux hélices α interrompues reposant au sommet d’une feuille β antiparallèle, et de deux domaines de type immunoglobuline (Ig-like) proches de la membrane qui participent à la liaison des corécepteurs CD4 et CD8.
Malgré ces similitudes structurelles, les sous-unités protéiques sont codées différemment pour les molécules de classe I et II. Les molécules MHCI sont des hétérodimères formés par une association non covalente entre une chaîne lourde MHCIα et la β2-microglobuline (β2m), qui est codée par un locus largement invariant situé en dehors de la région génomique du CMH. La chaîne lourde contribue à la fois à la fente de liaison au peptide et à l’un des domaines de type Ig, tandis que la β2m fournit uniquement une deuxième région de type Ig dépourvue d’ancrage transmembranaire. Les molécules du CMH de classe II sont des hétérodimères formés par l’association non covalente d’une chaîne α et d’une chaîne β, qui apportent toutes deux des domaines de type Ig à ancrage membranaire et à liaison peptidique unique, et dont chacune est transcrite à partir d’un locus distinct se trouvant généralement dans la région du CMH.
Les membres de la famille des gènes du CMH peuvent être subdivisés en loci classiques ou non classiques, en plus des pseudogènes non fonctionnels. Les loci classiques du CMH Ia sont largement exprimés et sont généralement associés à une grande variabilité de séquence et à une sélection positive agissant sur les substitutions des résidus de la région de liaison aux peptides (RLP). Les loci du CMH Ib non classiques ont au contraire une expression réduite ou une distribution tissulaire limitée, un polymorphisme plus faible et peuvent avoir des fonctions restreintes ou modifiées. Pour les gènes de classe II, le terme » classique » désigne généralement tous les loci de présentation de l’antigène, tandis que le terme » non classique » est réservé aux gènes tels que DMα/β qui jouent des rôles accessoires dans la voie de présentation de l’antigène. Bien que cette catégorisation fonctionnelle des membres de la famille de gènes fournisse un vocabulaire de travail utile, la frontière entre les loci classiques et non classiques n’est pas toujours claire dans la pratique et certains loci non classiques du CMH sont polymorphes, largement exprimés ou lient des ligands peptidiques de la manière traditionnelle des gènes classiques.
Un polymorphisme extrême au niveau de la population et des preuves de sélection équilibrante indiquent qu’une variation allélique substantielle des gènes du CMH est probablement nécessaire pour reconnaître et répondre à un assemblage diversifié de pathogènes. Cependant, malgré une duplication importante des gènes chez certaines espèces, les individus n’expriment généralement qu’un nombre modéré de loci du CMH classique et une réversion vers un héritage disomique est également observée chez certaines espèces polyploïdes de Xenopus. On pense que les contraintes à la variation intra-individuelle du CMH (au moins pour les loci classiques fortement exprimés) reflètent un compromis fonctionnel entre l’augmentation du répertoire allélique pour présenter une plus grande variété de peptides pathogènes et la réduction concomitante du répertoire de cellules T qui serait nécessaire pour maintenir l’autotolérance. Les molécules individuelles du CMH doivent donc être capables de se lier à des peptides permissifs pour reconnaître de manière adéquate une large gamme d’antigènes étrangers. Cependant, il est également nécessaire de générer des complexes CMH-peptide stables qui persisteront pendant une durée suffisante pour permettre la reconnaissance des cellules T et qui n’échangeront pas de peptides à la surface des cellules, ce qui pourrait entraîner la destruction des cellules non infectées. Une telle stabilité est généralement associée à des interactions intermoléculaires de haute affinité, et donc restrictives.
Les molécules du CMH concilient ces exigences de liaison concurrentes grâce à une solution structurelle élégante : les contacts entre les résidus hautement conservés de la région de liaison peptidique (PBR) de la molécule du CMH et les atomes de la chaîne principale du peptide stabilisent la liaison promiscuous de la plupart des ligands peptidiques, tandis que les résidus polymorphes qui tapissent le sillon de liaison peptidique créent des poches irrégulières avec une stéréochimie différente qui accueillent les résidus peptidiques d’une manière qui dépend de la séquence. Les restrictions imposées par les poches de liaison des chaînes latérales varient à la fois entre les allèles et entre les poches au sein d’une même molécule de CMH. Les poches imposant des exigences de liaison plus strictes sont dites accueillir des résidus peptidiques « d’ancrage primaire », tandis que les « ancres secondaires » sont plus flexibles dans leurs préférences de liaison. Ensemble, ces spécificités déterminent le motif de liaison peptidique d’un allèle particulier du CMH pour conférer une sélectivité lors de la présentation de l’antigène.