Ion azide : Structure, propriétés et réactions de substitution
L’ion azide (N3- ) fait partie de ces entités chimiques qui ont tout simplement l’air bizarre.

- Trois nitrogènes à la suite ? vérifiez
- Deux charges négatives et une charge positive, pour une charge nette de -1 ? vérifiez
- Stable ? vérifiez (tant qu’il est traité avec douceur).
Il se trouve que l’ion azide peut être extrêmement utile pour former des liaisons C-N dans les réactions de substitution nucléophile.
Table des matières
- L’ion azide est un excellent nucléophile
- Les azides organiques comme amines « masquées »
- Explosion sur la rampe de lancement
- Substitution acylique nucléophile avec des sels d’azide : Les azides d’acyle
- Réarrangement des azides d’acyle : Le réarrangement de Curtius
- Plus d’exemples de nucléophiles azides : Ouverture époxyde et addition conjuguée
- Notes
- (Avancé) Références et lectures complémentaires
- 1. L’ion azide est un excellent nucléophile dans les réactions SN2
- 2. Les azides organiques comme « amines masquées »
- Explosion sur la rampe de lancement
- 4. La substitution nucléophile d’acyle avec des sels d’azide produit des azides d’acyle
- 5. Réarrangement des azides d’acyle : Le réarrangement de Curtius
- Plus d’exemples de nucléophiles azides : Ouverture d’époxyde et addition conjuguée
- Notes
- (Advanced) Références et lectures complémentaires
1. L’ion azide est un excellent nucléophile dans les réactions SN2
L’ion azide est la base conjuguée de l’acide hydrazoïque, HN3. Bien qu’il ne soit que faiblement basique (le pKa de HN3 n’est que de 4,6), N3 est un extrêmement bon nucléophile – selon une mesure, plus nucléophile que n’importe quelle amine (voir post : Nucléophilie des amines). Il n’est pas difficile de comprendre pourquoi il en est ainsi lorsque l’on y réfléchit. Avec quatre paires solitaires nucléophiles confinées dans un très petit volume, la probabilité d’une collision avec un électrophile qui entraîne une réaction est beaucoup plus élevée qu’elle ne le serait pour une amine avec des groupes alkyle volumineux, pour ne prendre qu’un exemple.
Vous pouvez penser à N3- comme à un missile maigre, méchant, à pointe d’azote qui livre sa charge utile sur le carbone rapidement, efficacement et sans réactions secondaires significatives.
Dans les réactions SN2, les halogénures et sulfonates d’alkyle primaires et secondaires sont facilement déplacés par N3- , ce qui donne des azides d’alkyle :
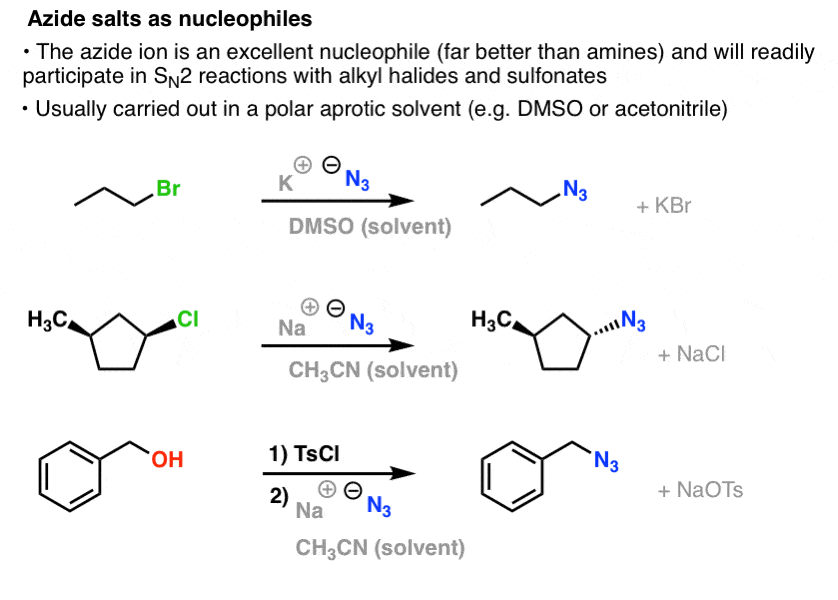
La procédure habituelle consiste à utiliser un sel d’azide tel que NaN3 ou KN3 avec l’halogénure d’alkyle approprié dans un solvant polaire aprotique tel que l’acétonitrile (CH3CN) ou le diméthylsulfoxyde (DMSO).
Les produits azotés organiques sont raisonnablement stables, même s’ils ont un aspect un peu bizarre. Certains ont même trouvé une utilité comme produits pharmaceutiques (par exemple l’AZT, ci-dessous à droite) ou comme sondes utiles pour étudier la biologie chimique. .
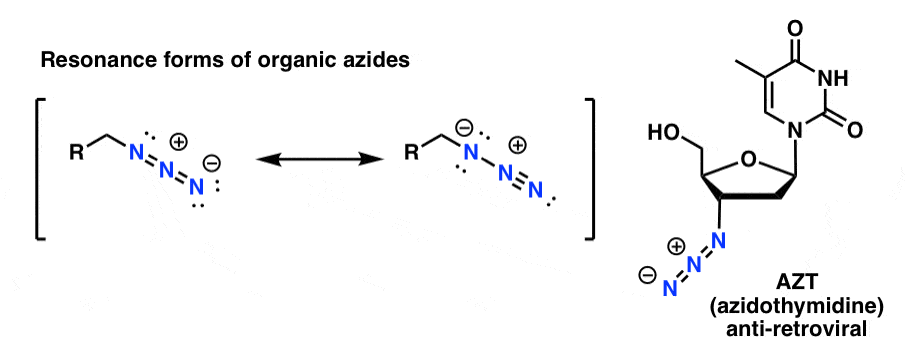
Pour notre propos, la propriété la plus utile des azides organiques est qu’ils servent d’amines « masquées ».
2. Les azides organiques comme « amines masquées »
Notez la forme de résonance ci-dessus avec une triple liaison azote-azote. S’ils sont traités avec un agent réducteur, comme LiAlH4 ou même une hydrogénation catalytique (Pd/C , H2), les azides organiques peuvent être réduits en amines primaires, libérant N2 dans le processus.
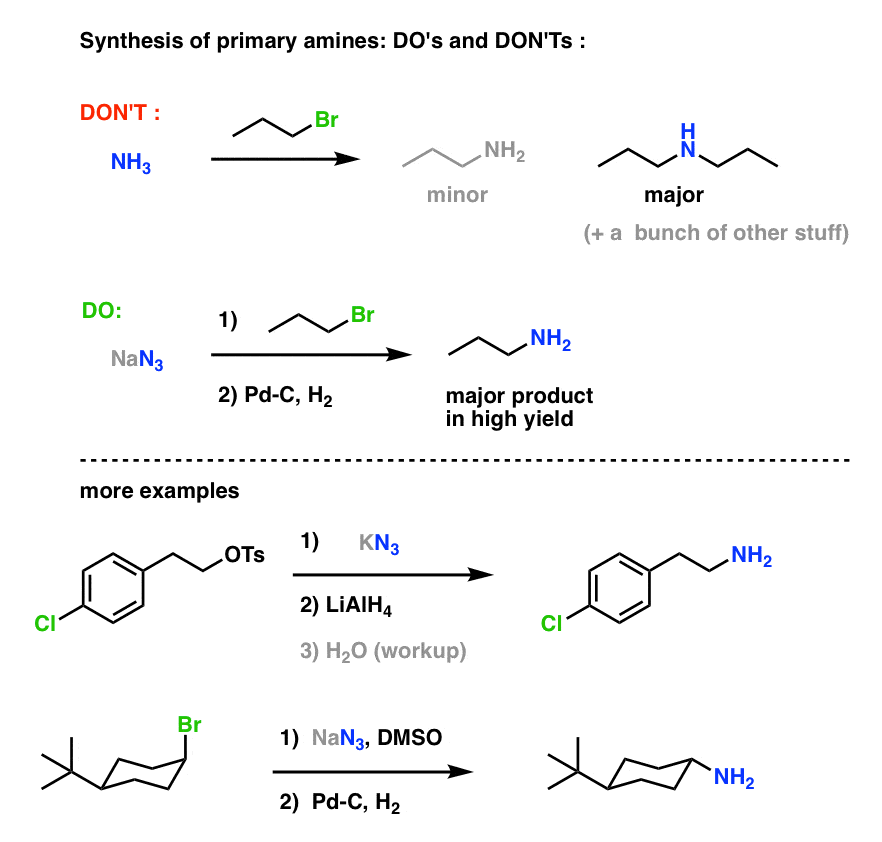
Cela constitue une voie très utile pour obtenir des amines primaires à partir d’halogénures d’alkyle !
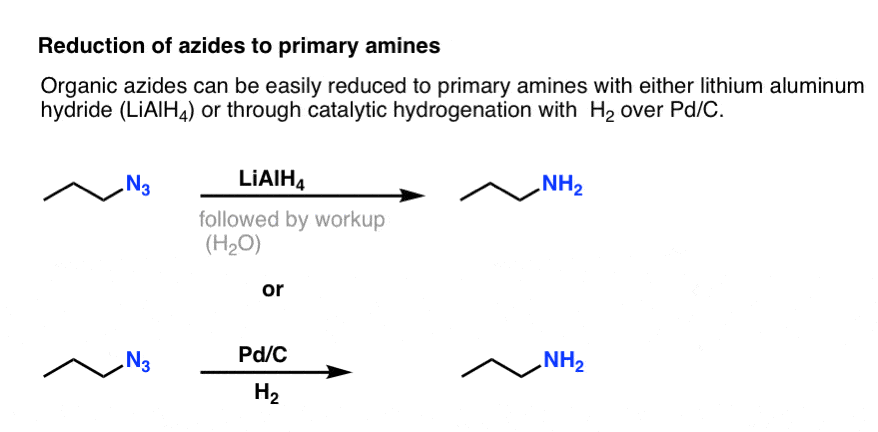
Nous avons précédemment exploré la synthèse de Gabriel comme voie d’accès aux amines primaires , mais cette voie est supérieure car l’azide peut être réduit en amine dans des conditions douces (par exemple, l’hydrogénation). Pas de ce clivage à haute température du phtalimide avec l’hydrazine à s’inquiéter.
Nous avons également vu que la fabrication d’amines primaires par traitement direct des halogénures d’alkyle avec NH3 ne donne souvent pas le produit désiré, parce que des amines ont une tendance Cookie-Monster à réagir plusieurs fois avec les halogénures d’alkyle : puisque les produits aminés ont tendance à être plus nucléophiles que les réactifs, il est difficile d’obtenir des amines de s’arrêter à la mastication d’un seul halogénure d’alkyle.
Explosion sur la rampe de lancement
Si N3 est un « missile à pointe d’azote », comme nous l’avons commenté plus haut, il est utile de rappeler ce qui se passe quand un missile n’est pas manipulé avec soin : c’est essentiellement une bombe.
NaN3 et KN3 sont des poudres blanches qui peuvent être stockées indéfiniment à température ambiante et ramassées à la pelle à la paillasse sans aucun problème.
Mais lorsqu’elles sont chauffées ou soumises à un choc – tout s’arrête. Il en va de même pour l’exposition de ces sels d’azoture à un acide, qui forme du HN3 potentiellement explosif.
Et NaN3 et KN3 sont les gentils azotures ! Si on les mélange avec des sels métalliques de plomb, de mercure, de cadmium, de zinc ou d’argent, on obtient des composés azides encore plus explosifs. Ces azides métalliques sont des explosifs de contact, dont certains sont si sensibles qu’ils explosent si quelqu’un pète à vingt pieds dans le couloir. Certains chimistes fous font même exprès de fabriquer ces choses, mais nous n’irons nulle part près du rayon d’explosion de ce sujet sur ce blog, à aucun moment, jamais.
NaN3 et KN3 doivent être utilisés à des concentrations raisonnablement diluées, derrière un écran anti-souffle à l’échelle préparative, et accessoirement jamais utilisés avec le solvant CH2Cl2, qui peut donner du diazidométhane hautement explosif.
Maintenant, il y a des moments où une explosion soudaine d’azote gazeux est utile – et potentiellement salvatrice. Vous avez peut-être déjà passé une partie de votre journée à proximité de l’azide de sodium sans même vous en rendre compte. C’est parce que le NaN3 est l’un des nombreux propulseurs qui trouvent une utilisation dans les airbags ; une fois déclenchée par un accéléromètre, la détonation du NaN3 expulse du gaz N2 à plus de 200 mph, gonflant le sac en 1/25 de seconde.
Vive les sels d’azide!
via GIPHY
(Mais ne soyez pas ce type):
via GIPHY
La ligne de fond : Les réactions SN2 entre les halogénures d’alkyle ou les sulfonates avec les azides sont probablement la meilleure façon unique de synthétiser des amines primaires à partir d’halogénures d’alkyle. C’est certainement mieux que la synthèse de Gabriel.
4. La substitution nucléophile d’acyle avec des sels d’azide produit des azides d’acyle
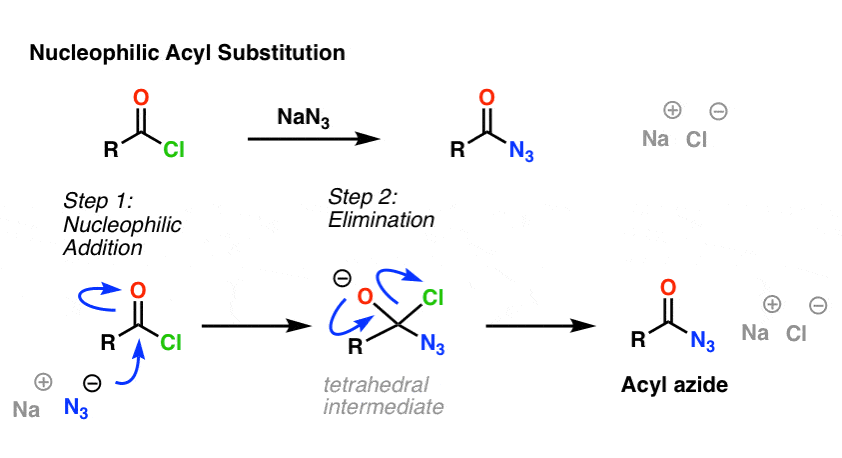
La réaction SN2 n’est pas le seul type de réaction de substitution que nous avons exploré. Il y a aussi la substitution acylique nucléophile. Un carbonyle attaché à un bon groupe partant (comme un chlorure ou un anhydride d’acide) subira une substitution lorsqu’un nucléophile approprié est ajouté.
Dans la première étape du mécanisme, le nucléophile (Nu) attaque le carbone du carbonyle, formant C-Nu et cassant C-O (pi). Cela donne lieu à un intermédiaire tétraédrique. Dans la deuxième étape, la liaison C-O pi est reformée, et la liaison carbone-(groupe partant) est rompue, ce qui donne le produit de substitution acylique nucléophile.
Voici un exemple de réaction de substitution acylique nucléophile entre un chlorure d’acide et l’ion N3 pour donner un azide d’acyle :
5. Réarrangement des azides d’acyle : Le réarrangement de Curtius
L’utilisation la plus courante des azides d’acyle est qu’en chauffant, ils se réarrangent pour donner des isocyanates dans une réaction connue sous le nom de réarrangement de Curtius.
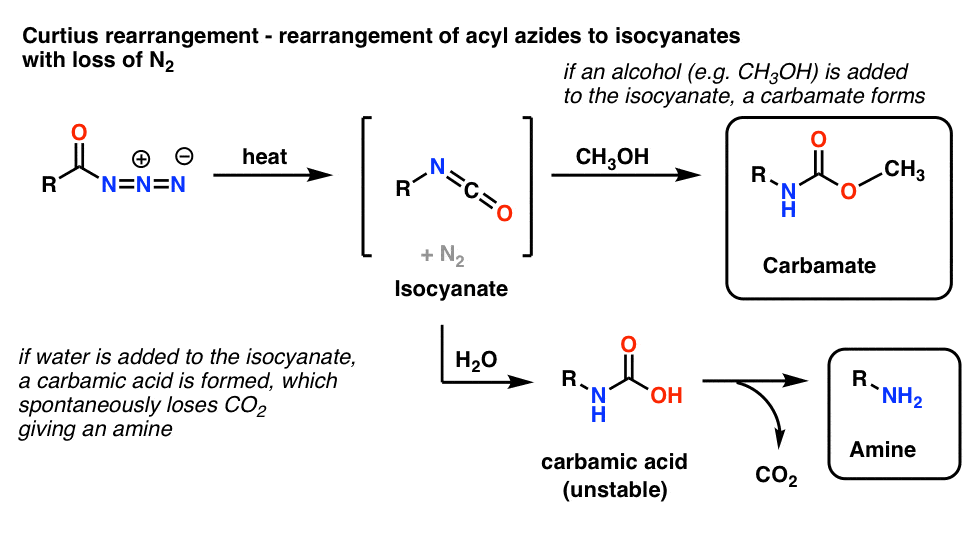
- Si le Curtius est effectué en présence d’un alcool tel que le méthanol, un carbamate est formé.
- Si l’on ajoute de l’eau à la place, un acide carbamique instable est brièvement formé, qui perd ensuite du dioxyde de carbone pour donner une amine primaire.
Pourquoi cela pourrait-il être utile ? Voici une façon.
Il y a beaucoup de méthodes pour fabriquer des acides carboxyliques aromatiques, mais pas tant de grandes façons de former des liaisons C-N sur des cycles aromatiques. Disons que vous avez un acide benzoïque (comme l’acide p-méthylbenzoïque) mais que vous avez besoin de former une amine aromatique (protégée). Le protocole de Curtius représente une belle façon de former une nouvelle liaison C-N sur le cycle sans avoir à recourir à la nitration + réduction.
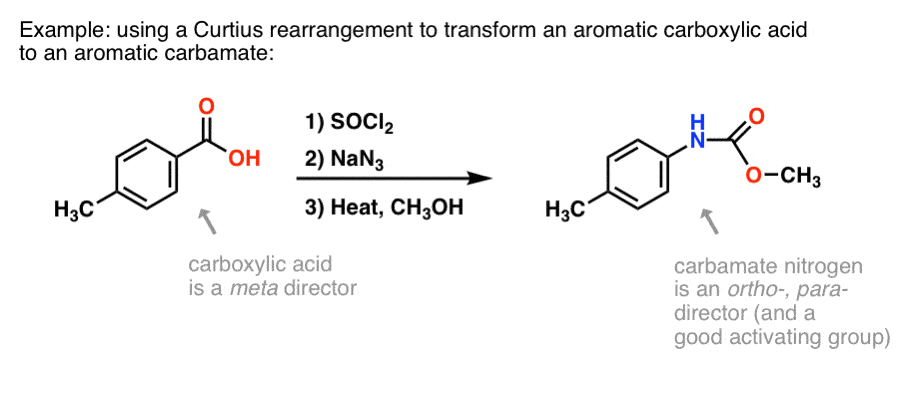
(De cette façon, c’est un peu analogue à un équivalent azoté de l’oxydation de Baeyer-Villiger. )
Plus d’exemples de nucléophiles azides : Ouverture d’époxyde et addition conjuguée
Deux autres applications de l’ion azide en tant que nucléophile incluent l’ouverture d’époxydes (dans ce qui est essentiellement un processus SN2 – notez l’inversion de configuration) et aussi l’addition conjuguée sur des cétones alpha,bêta insaturées :
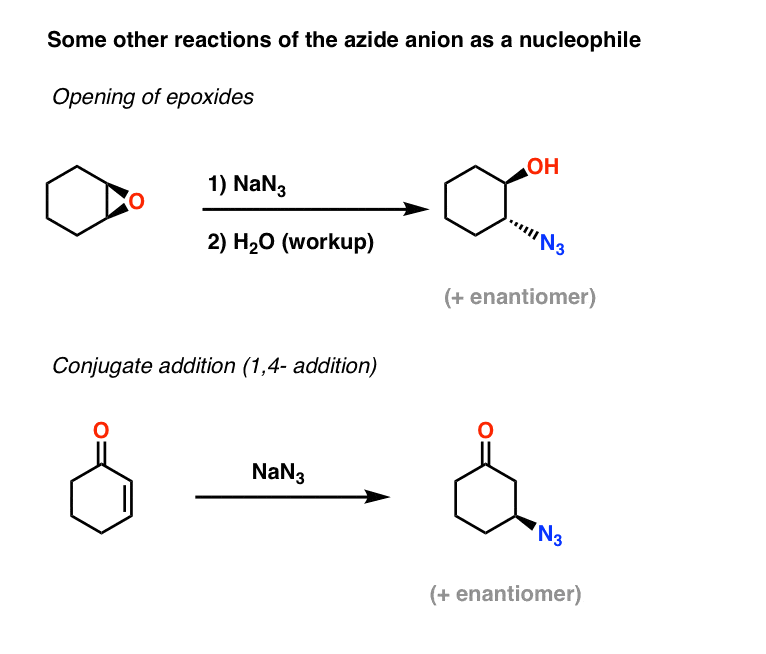
Les alkylazides résultants peuvent ensuite être réduits en amines primaires en utilisant les méthodes couvertes ci-dessus.
Notes
Note de bas de page : Cycloadditions azide-alcyne, alias. « Click » chemistry
Une application intéressante et utile des azides organiques qui n’a pas encore fait son entrée dans les manuels d’introduction à la chimie organique (mais qui le fera probablement dans un avenir proche) est un processus techniquement appelé « cycloaddition azide-alkyne catalysée par le cuivre », mais plus communément appelé simplement « réaction click alcyne-azide ».
Lorsqu’un alcyne terminal est traité par un catalyseur au cuivre en présence d’un azide organique, il en résulte rapidement une cycloaddition qui conduit à la formation d’un 1,2,3-triazole.
Nous n’entrerons pas dans les détails, mais cette réaction de formation de cycle implique 6 électrons pi et est une cousine de la réaction de Diels-Alder (les pinailleurs noteront à juste titre que la version catalysée par le cuivre n’est pas techniquement un processus concerté, mais que la version non catalysée l’est)
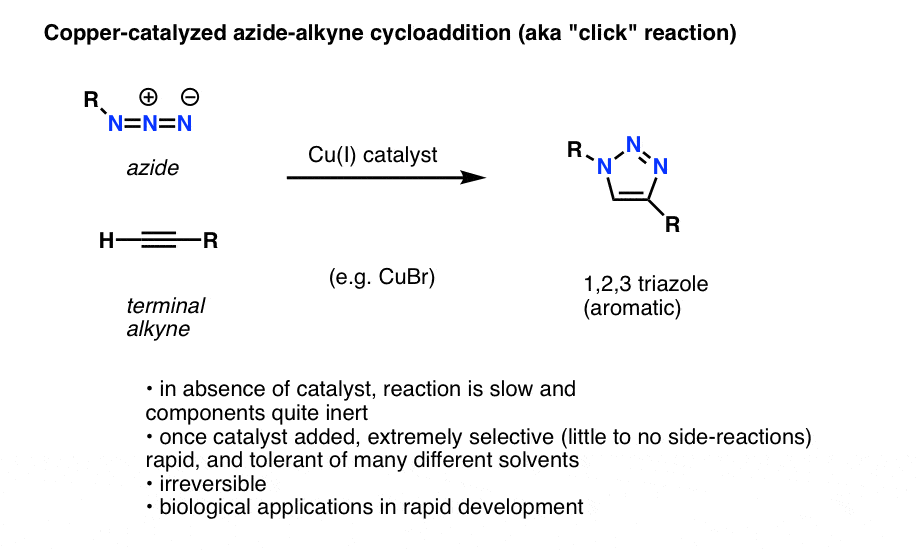
La réaction est remarquable pour quelques raisons :
- les partenaires réactifs (alcyne terminal et azide organique) sont relativement inertes en l’absence de catalyseur dans la plupart des conditions.
- Une fois le cuivre ajouté, la réaction se produit extrêmement rapidement dans des conditions douces et dans une variété de solvants (y compris l’eau).
- C’est extrêmement sélectif dans ces conditions,les partenaires alcyne et azide ne réagissent qu’entre eux, de manière irréversible.
- le produit, un cycle triazole, est aromatique et stable
On l’a appelée réaction « click » par l’un de ses initiateurs, Barry Sharpless, parce que c’est l’une des choses les plus proches que les chimistes ont d’une réaction qui est comme le « clic » doux de deux blocs lego complémentaires.
Ce qui a rendu cette réaction particulièrement utile ces derniers temps, c’est que les partenaires azide et alcyne peuvent être installés dans des molécules d’intérêt biologique, et « cliqués » ensemble quand on le souhaite.
Par exemple :
- Poser un acétylène en position 5′ d’un sucre et un azide en position 3′ a été utilisé pour faire de l’ADN « cliqué », où le triazole remplace l’organophosphate.
- Incroyable, un groupe a fabriqué de l’ADN « cliqué », l’a mis dans des cellules humaines et a réussi à le faire transcrire par l’ARN messager.
- L’AZT contenant de l’azide (ci-dessus) fonctionne en gommant la machinerie de transcription. Des gens astucieux ont trouvé un moyen d’appliquer la réaction de clic azide-alkyne vers le séquençage rapide du génome, une technique connue sous le nom de ClickSeq.
Takata a utilisé l’azide de sodium au début des années 1990, puis est passé au tétrazole et ensuite au nitrate d’ammonium.
From « Sixty Million Car Bombs : Inside Takata’s Air Bag Crisis ».
Le nitrate d’ammonium était environ un dixième du prix du tétrazole, selon Upham, qui a également examiné les brevets de l’industrie. Mais le nitrate d’ammonium présentait un défaut critique qui, selon lui, a conduit les autres fabricants d’airbags à renoncer à ce produit : Le nitrate d’ammonium présente cinq phases de densité variable, ce qui le rend difficile à maintenir stable dans le temps. Un agent propulseur fabriqué à partir de nitrate d’ammonium gonfle et se rétracte en fonction des changements de température, et finit par se décomposer en poudre. L’eau et l’humidité accélèrent le processus. La poudre brûle plus rapidement qu’un comprimé, de sorte qu’un airbag dont le gaz propulseur s’est désagrégé risque de se déployer de manière trop agressive. L’explosion contrôlée ne serait qu’une explosion. « Tout le monde a suivi une certaine voie, et seul Takata a suivi une autre voie », déclare Jochen Siebert, qui suit l’industrie des coussins gonflables depuis les années 1990 et est aujourd’hui directeur général de JSC Automotive Consulting. Si vous lisez les documents de conférence de l’époque, vous pouvez voir que les gens disaient : « Non, vous ne devriez pas. C’est dangereux.’ «
Les éclats des airbags défectueux ont tué 13 personnes dans le monde, et en ont blessé plus de 100.
Le 25 juin 2017, face à un passif de plus de 11 milliards de dollars, Takata a déposé le bilan.
Synthèse d’amine primaire « Do’s and Don’ts » :
(Advanced) Références et lectures complémentaires
Les azides sont utiles en synthèse organique, et un point fort de la chimie des azides est donné dans les références ci-dessous.
- Réactivité nucléophile de l’ion azide dans divers solvants
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI : 10.1002/poc.1063
Le professeur Herbert Mayr (LMU, Munich, Allemagne) a passé sa carrière à contribuer à la chimie organique physique fondamentale en quantifiant l’électrophilicité et la nucléophilicité, et en développant des échelles pour comparer la réactivité de divers nucléophiles et électrophiles. - Les déplacements SN2 aux brosylates de 2-norbornyle
Klaus Banert et Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI : 1021/ja00377a057 - Une synthèse améliorée de l’azidothymidine
I. Balagopala, A. P. Ollapally, &H. J. Lee
Nucléosides, Nucléotides &Acides nucléiques 1996, 4, 899-906
DOI : 10.1080/07328319608002136
Les azides peuvent être utilisés comme nucléophiles dans les réactions SN2. La réf. #3 montre l’utilisation de l’ion azide dans la synthèse de l’AZT (azidothymidine). La conversion de 1 en 5 via 3 dans la réf. #3 utilise la réaction de Mitsunobu, qui permet le déplacement d’un groupe -OH avec un nucléophile avec inversion de configuration. - Réduction des azides organiques en amines primaires avec l’hydrure de lithium et d’aluminium
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI : 10.1021/ja01156a507
La réduction des azides organiques en amines primaires est une méthode commode pour la synthèse des amines primaires, qui sont autrement difficiles à synthétiser sélectivement par des méthodes standard. - La sensibilité explosive des azides métalliques aux chocs
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI : 10.1016/0022-4596(70)90043-5
Une enquête sur la sensibilité au choc de NaN3, TlN3 et Pb(N3)2. - La réaction de Curtius
Smith, P. A. S. React. 1946, 3, 336
DOI : 10.1002/0471264180.or003.09
Une revue ancienne mais complète de la réaction de Curtius, qui comprend l’histoire de la découverte de ce réarrangement, la portée du substrat, les limites, la comparaison avec d’autres réactions similaires et les procédures expérimentales. - Méthodes et réactions de synthèse. 121. Préparation catalysée par l’iodure de zinc d’azides d’aroyle à partir de chlorures d’aroyle et d’azide de triméthylsilyle
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, et George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI : 10.1021/jo00167a051b
Une procédure pratique pour la préparation d’azides d’aryle aromatiques du professeur George A. Olah, lauréat du prix Nobel. Ceux-ci peuvent ensuite être utilisés pour les réarrangements de Curtius.
Ouverture d’époxyde et addition conjuguée :
- CYCLOHEXENE IMINE (7-AZA-BICYCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh et Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI : 10.15227/orgsyn.087.0161
C’est une procédure particulièrement utile, car c’est une réaction de Staudinger pour convertir les époxydes en NH-aziridines (l’analogue azoté des époxydes). La synthèse peut être délicate, mais beaucoup de détails ont été fournis ici afin que cela puisse être reproduit, comme s’adapte une procédure dans Organic Syntheses. - Addition catalysée par les amines de l’ion azide aux composés carbonylés α,β-insaturés
David J. Guerin, Thomas E. Horstmann, et Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI : 10.1021/ol9909076
Cet article est intéressant car il représente une forme précoce d’organocatalyse et procède probablement par un intermédiaire imine ou ion iminium. Malheureusement, ce terme n’est utilisé nulle part dans l’article – ces auteurs auraient pu devancer le professeur MacMillan ! - La chimie du clic : Fonction chimique diversifiée à partir de quelques bonnes réactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI : 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
La cycloaddition catalysée par le Cu d’azides avec des alcynes a été surnommée réaction « click » par le lauréat du prix Nobel, le Prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) en raison de sa simplicité, de ses rendements élevés, de sa cinétique rapide et de sa compatibilité avec un large éventail de conditions et de substrats. Des réactions sans cuivre sont également possibles si des alcynes sous tension sont utilisés (par exemple, des cyclooctynes).