L’hydrogénation des alcènes en alcanes est exothermique. La quantité d’énergie libérée lors d’une réaction d’hydrogénation, appelée chaleur d’hydrogénation, est inversement proportionnelle à la stabilité de l’alcène de départ : plus l’alcène est stable, plus sa chaleur d’hydrogénation est faible. L’examen des chaleurs d’hydrogénation de divers alcènes révèle que la stabilité augmente avec la quantité de substitution.
| Nom du composé | Structure | Chaleur molaire d’hydrogénation | Degré de substitution | |
|---|---|---|---|---|
| en kJ/mol | en kcal/mol | |||
| Ethylène | H 2 C = CH 2 {\displaystyle {\ce {H2C=CH2}}}
 |
137 | 32,8 | Non substitué |
| 1-Butène |
|
127 | 30.3 | Monosubstitué |
| trans-2-Butène |
|
116 | 27.6 | Disubstitué |
| 2-Méthyl-2-butène |
 |
113 | 26.9 | Trisubstitué |
| 2,3-Diméthyl-2-butène |
 |
111 | 26.6 | Tétrasubstitué |
L’augmentation de la stabilité associée à des substitutions supplémentaires est le résultat de plusieurs facteurs. Les groupes alkyles sont donneurs d’électrons par effet inductif, et augmentent la densité électronique sur la liaison sigma de l’alcène. De plus, les groupes alkyle sont stériquement grands, et sont plus stables lorsqu’ils sont éloignés les uns des autres. Dans un alcane, la séparation maximale est celle de l’angle de liaison tétraédrique, 109,5°. Dans un alcène, l’angle de liaison augmente jusqu’à près de 120°. Par conséquent, la séparation entre les groupes alkyle est la plus grande dans l’alcène le plus substitué.
L’hyperconjugaison, qui décrit l’interaction stabilisatrice entre l’HOMO du groupe alkyle et le LUMO de la double liaison, permet également d’expliquer l’influence des substitutions d’alkyle sur la stabilité des alcènes. En ce qui concerne l’hybridation orbitale, une liaison entre un carbone sp2 et un carbone sp3 est plus forte qu’une liaison entre deux carbones hybridés sp3. Les calculs révèlent un effet dominant d’hyperconjugaison stabilisante de 6 kcal/mol par groupe alkyle.
Effets stériquesEdit
Dans les réactions d’élimination E2, une base abstrait un proton qui est bêta à un groupe partant, tel qu’un halogénure. L’enlèvement du proton et la perte du groupe partant se produisent en une seule étape concertée pour former une nouvelle double liaison. Lorsqu’une petite base non encombrée – comme l’hydroxyde de sodium, le méthoxyde de sodium ou l’éthoxyde de sodium – est utilisée pour une élimination E2, le produit de Zaitsev est généralement favorisé par rapport à l’alcène le moins substitué, connu sous le nom de produit de Hofmann. Par exemple, le traitement du 2-bromo-2-méthylbutane avec de l’éthoxyde de sodium dans l’éthanol produit le produit de Zaitsev avec une sélectivité modérée.

En raison d’interactions stériques, une base volumineuse – comme le t-butoxyde de potassium, la triéthylamine ou la 2,6-lutidine – ne peut pas facilement abstraire le proton qui conduirait au produit de Zaitsev. Dans ces situations, un proton moins stériquement encombré est de préférence abstrait. Par conséquent, le produit de Hofmann est généralement favorisé lors de l’utilisation de bases volumineuses. Lorsque le 2-bromo-2-méthylbutane est traité avec du t-butoxyde de potassium au lieu de l’éthoxyde de sodium, le produit de Hofmann est favorisé.

Les interactions stériques au sein du substrat empêchent également la formation du produit de Zaitsev. Ces interactions intramoléculaires sont pertinentes pour la distribution des produits dans la réaction d’élimination de Hofmann, qui convertit les amines en alcènes. Dans l’élimination de Hofmann, le traitement d’un sel d’iodure d’ammonium quaternaire avec l’oxyde d’argent produit l’ion hydroxyde, qui agit comme une base et élimine l’amine tertiaire pour donner un alcène.
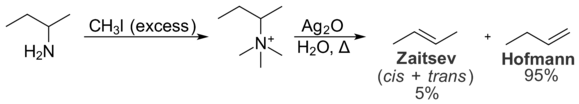
Dans l’élimination de Hofmann, l’alcène le moins substitué est généralement favorisé en raison des interactions stériques intramoléculaires. Le groupe ammonium quaternaire est grand et les interactions avec les groupes alkyle du reste de la molécule sont indésirables. Par conséquent, la conformation nécessaire à la formation du produit Zaitsev est moins favorable sur le plan énergétique que la conformation nécessaire à la formation du produit Hofmann. En conséquence, le produit de Hofmann est formé de manière préférentielle. L’élimination de Cope est très similaire à l’élimination de Hofmann en principe, mais se produit dans des conditions plus douces. Elle favorise également la formation du produit de Hofmann, et pour les mêmes raisons.
StéréochimieEdit
Dans certains cas, la stéréochimie du produit de départ peut empêcher la formation du produit de Zaitsev. Par exemple, lorsque le chlorure de menthyle est traité par l’éthoxyde de sodium, le produit de Hofmann est formé exclusivement : mais avec un rendement très faible :

Ce résultat est dû à la stéréochimie du produit de départ. Les éliminations E2 nécessitent une géométrie anti-périplanaire, dans laquelle le proton et le groupe partant se trouvent sur des côtés opposés de la liaison C-C, mais dans le même plan. Lorsque le chlorure de menthyle est dessiné dans la conformation de la chaise, il est facile d’expliquer la distribution inhabituelle du produit.

La formation du produit de Zaitsev nécessite une élimination en position 2, mais le groupe isopropyle – et non le proton – est antipériplanaire au groupe partant du chlorure ; cela rend l’élimination en position 2 impossible. Pour que le produit de Hofmann se forme, l’élimination doit avoir lieu en position 6. Comme le proton à cette position a la bonne orientation par rapport au groupe partant, l’élimination peut se produire et se produit effectivement. Par conséquent, cette réaction particulière ne produit que le produit de Hofmann.